张 峰,徐元宏,高 勇,李风成,张 建,李 卫
(1.安徽医科大学第一附属医院检验科,合肥 230022;2.安徽医科大学阜阳传染病临床学院阜阳市第二人民医院检验科,安徽阜阳 236015;3.安徽医科大学阜阳传染病临床学院阜阳市第二人民医院肝病科,安徽阜阳 236015)
不同肝纤维化程度慢性HBV感染者HBV基因分型及γ-GT与HBsAg定量比值检测分析
张 峰1,2,徐元宏1△,高 勇2,李风成3,张 建3,李 卫3
(1.安徽医科大学第一附属医院检验科,合肥 230022;2.安徽医科大学阜阳传染病临床学院阜阳市第二人民医院检验科,安徽阜阳 236015;3.安徽医科大学阜阳传染病临床学院阜阳市第二人民医院肝病科,安徽阜阳 236015)
目的 分析不同肝纤维化程度慢性乙型肝炎病毒(HBV)感染者的HBV基因分型,以及γ-谷氨酰转移酶(γ-GT)与乙型肝炎表面抗原(HBsAg)定量比值(GqHBsR)的诊断价值。方法 选取阜阳市第二人民医院2013年5月至2016年6月收治的317例慢性HBV感染者,采用荧光定量PCR法进行HBV基因分型检测,比较GqHBsR与γ-GT、HBsAg及天冬氨酸氨基转移酶(AST)/血小板比值指数(APRI)、基于4因子的纤维化指数(FIB-4)诊断模型对肝纤维化程度的诊断效果。结果 B、C基因型在不同肝纤维化分期患者中的分布比较,差异均有统计学意义(P<0.05);γ-GT、GqHBsR值及肝纤维化评分随肝纤维化分期级别的增高而上升,HBsAg定量则逐渐降低,不同肝纤维化分期患者的γ-GT、HBsAg定量、GqHBsR值及肝纤维化评分比较,差异均有统计学意义(P<0.05);肝纤维化评分与GqHBsR值呈正相关(r=0.423 5,P<0.01);GqHBsR、γ-GT、HBsAg、FIB-4、APRI诊断显着肝纤维化的受试者工作特征(ROC)曲线下面积(AUC)分别为0.860、0.599、0.590、0.789、0.775,GqHBsR诊断各期肝纤维化的AUC均在0.9左右,灵敏度(Se)、特异度(Sp)、阳性预测值(PPV)和阴性预测值(NPV)均较高。结论 GqHBsR模型对慢性HBV感染者肝纤维化程度具有较高的诊断价值,可在一定程度上降低此类患者接受肝穿刺活检的比例。
γ-谷氨酰转移酶;肝炎表面抗原,乙型;肝炎,乙型,慢性;基因分型
我国为乙型肝炎病毒(HBV)感染的高流行区,乙型肝炎表面抗原(HBsAg)在一般人群中的携带率为9.09%[1],而慢性乙型肝炎为肝硬化与肝癌发生的重要原因之一。相关研究表明,慢性乙型肝炎患者每年大概有2.1%会进展为肝硬化或肝癌,同时肝硬化患者的肝癌年发生率为3%~6%[2-3]。作为慢性肝病的重要病理特征,肝纤维化被认为是多数慢性肝炎患者进一步恶化发展为肝硬化与肝炎的重要中间环节[4]。对慢性乙型肝炎患者的肝纤维化程度及时做出早期诊断尤为重要。目前,肝组织病理活检仍是肝纤维化诊断的“金标准”,但因操作有创且复杂,易出现取材误差及诱发并发症等缺陷,在一定程度上应用受限。近年来,肝纤维化的无创性诊断方法愈发获得临床重视,但目前国内外现有的肝纤维化无创性诊断模型的灵敏度与特异度仍存在不足[5]。另有研究表明,HBV基因型与慢性肝病的多种病理改变的严重程度有密切相关性。本研究通过对317例不同肝纤维化程度慢性HBV感染者的HBV基因分型进行检测,同时以天冬氨酸氨基转移酶(AST)/血小板(PLT)比值指数(APRI)、基于4因子的纤维化指数(FIB-4)两种应用相对普遍的模型作对比,考察γ-谷氨酰转移酶(γ-GT)与HBsAg定量比值(GqHBsR)对肝纤维化程度的诊断价值,现报道如下。
1 资料与方法
1.1 一般资料 选取阜阳市第二人民医院2013年5月至2016年6月收治的317例慢性HBV感染者作为研究对象,所有患者均接受肝组织病理学检查,均符合2010年中华医学会肝病学分会与感染病学分会联合修订的《慢性乙型肝炎防治指南》中的相关诊断标准。其中,男248例,女69例;年龄12~78岁,平均(34.6±11.2)岁;肝纤维化分期:S0期40例、S1期100例、S2期129例、S3期28例、S4期20例。本研究有通过阜阳市第二人民医院医学伦理委员会审核同意,在研究正式开展前征得研究对象同意并签署知情同意书。
1.2 方法
1.2.1 肝活检 经超声引导进行肝脏穿刺并取得肝组织标本,将获得标本采用10%中性甲醛固定处理,再以乙醇脱水,石蜡包埋后行常规组织切片,对切片行苏木精-伊红(HE)染色与网织纤维染色,选择至少具有3个以上完整汇管区的切片进行多视野镜检。根据肝活检结果诊断肝纤维化分期,明显肝纤维化定义为纤维化分期S2级以上,无或轻度肝纤维化定义为纤维化分期低于S2。
1.2.2 基因分型检测 采血并分离血清后采用荧光定量PCR法进行检测,仪器为LineGene9600全自动荧光实时定量PCR仪。
1.2.3 其他实验室检测 γ-GT、AST、丙氨酸氨基转移酶(ALT)采用日立7600-020全自动生化仪,检测试剂由上海申能德赛公司提供;PLT计数采用Sysmex X2100全自动血细胞分析仪及配套试剂进行检测;HBsAg定量采用美国雅培公司试剂盒,应用化学发光法进行检测。根据γ-GT与HBsAg定量检测结果计算GqHBsR值。GqHBsR=γ-GT(U/L)/HBsAg(log10IU/mL);FIB-4=年龄×AST/PLT计数×ALT1/2;APRI=AST/PLT计数。
1.2.4 肝纤维化评分 参考中华肝脏病学会肝纤维化学组所提出的“肝纤维化诊断及疗效评估共识”进行肝纤维化评分,并将该评分值与GqHBsR值进行相关性分析。

2 结 果
2.1 不同肝纤维化分期的HBV基因型分布 B、C基因型在不同肝纤维化分期患者中的分布比较,差异均有统计学意义(P<0.05),见表1。
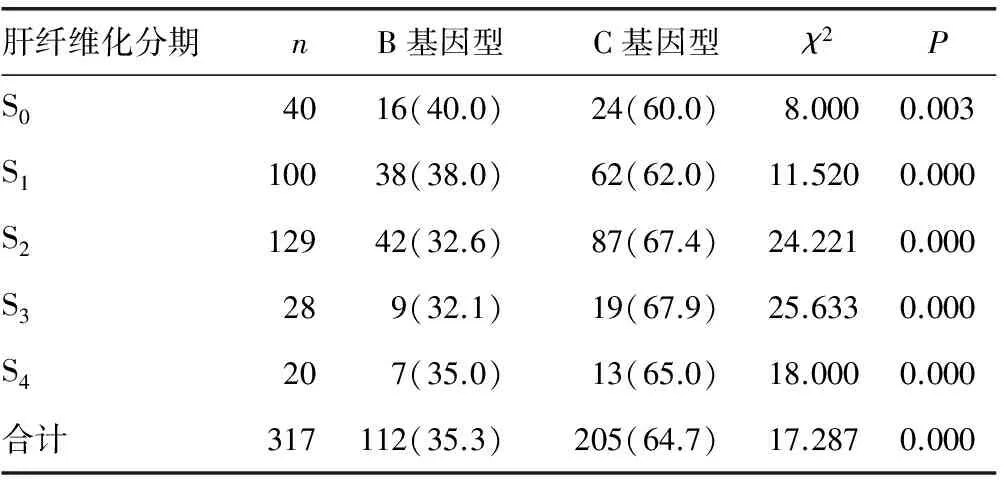
表1 不同肝纤维化分期的HBV基因型分布[n(%)]
2.2 不同肝纤维化分期患者γ-GT、HBsAg定量、GqHBsR值及肝纤维化评分比较 γ-GT与GqHBsR值随肝纤维化分期级别的增高而上升,HBsAg定量则逐渐降低,不同肝纤维化分期患者的γ-GT、HBsAg定量、GqHBsR值及肝纤维化评分比较,差异均有统计学意义(P<0.05),见表2。肝纤维化评分与GqHBsR值呈正相关性(r=0.423 5,P<0.01),见图1。

表2 不同肝纤维化分期患者的γ-GT、HBsAg定量、GqHBsR值及肝纤维化评分比较
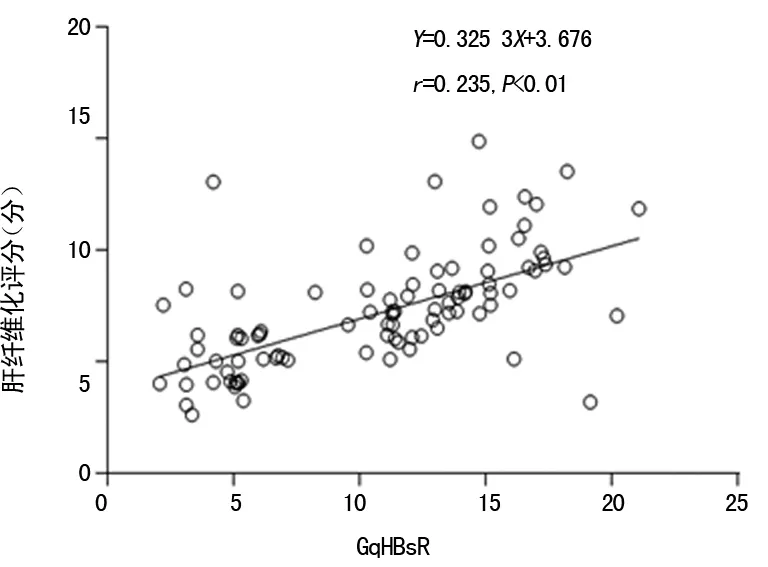
图1 肝纤维化评分与GqHBsR值的相关性
2.3 GqHBsR、γ-GT、HBsAg及FIB-4、APRI对显着肝纤维化的诊断效能比较 GqHBsR、γ-GT、HBsAg、FIB-4、APRI诊断显着肝纤维化的ROC曲线图见图2,对应AUC分别为0.860、0.599、0.590、0.789、0.775,GqHBsR对显着肝纤维化的诊断价值更高,见表3。

图2 不同指标诊断显着肝纤维化的ROC曲线
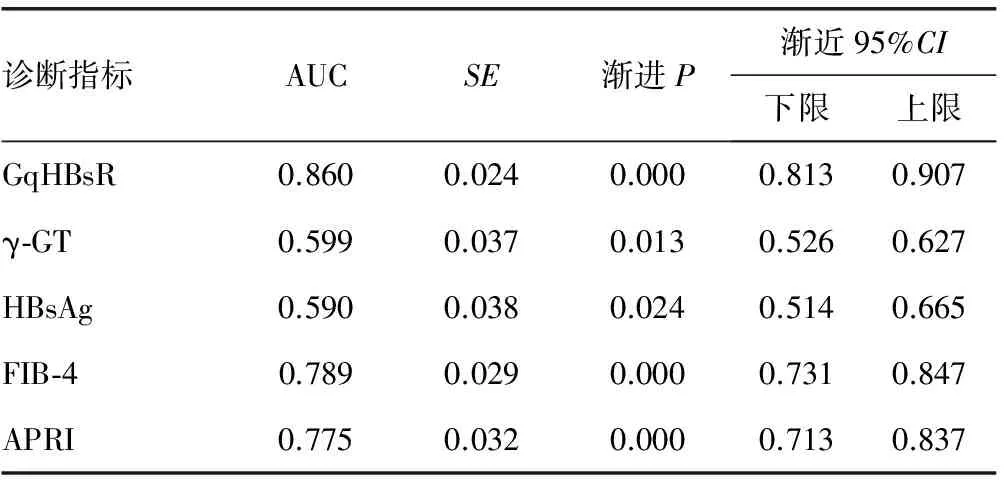
表3 GqHBsR、γ-GT、HBsAg、FIB-4及APRI诊断显着肝纤维化的诊断效能

图3 GqHBsR诊断各期肝纤维化的ROC曲线

表4 GqHBsR对各期肝纤维化的诊断效能

表5 GqHBsR诊断各期肝纤维化的评价结果
2.4 GqHBsR诊断各期肝纤维化的ROC曲线 GqHBsR诊断各期肝纤维化的ROC曲线见图3;各期AUC均在0.9左右,见表4;Se、Sp、PPV 及NPV均较高,见表5。
3 讨 论
HBV感染后的临床转归受多种因素的影响,HBV基因型可能是其中重要的因素之一。研究表明,B基因型与较轻的病变有关,C基因型与较重的病变有关。本研究结果显示,B、C基因型在不同肝纤维化分期患者中的分布比较,差异均有统计学意义(P<0.05),同时不同肝纤维化分期患者的肝纤维化评分比较,差异有统计学意义(P<0.05)。可见C基因型引起的肝纤维化病变比B基因型严重。同时也说明肝脏病理检查对判断肝纤维化病变严重程度的重要性。其原因可能与C基因型更容易发生T1762变异及基本核心启动子(BCP)变异,更易导致肝脏病变加重有关[6]。肝纤维化评分与GqHBsR值的相关性分析结果显示,二者呈正相关(r=0.423 5,P<0.01),提示采用GqHBsR诊断慢性HBV感染患者肝纤维化程度具有可行性。
Friedm[7]通过研究发现,肝细胞损伤→肝实质炎症坏死→肝星状细胞激活→细胞外基质发生大量沉积这一序列下的病理改变为肝纤维化的核心环节。慢性乙型肝炎为HBV感染所致的免疫介导性疾病,当HBsAg水平到达一定程度即可通过对机体发挥刺激作用而促使免疫应答,非特异性免疫介导虽能清除HBV,但该过程同时也会对肝细胞造成免疫性损伤,继而导致“核心环节”的启动[8]。本研究结果显示,HBsAg定量随肝纤维化分期级别的增高而逐渐降低,这与Chou等[9]的推测性结论一致。但这并不能表示HBsAg对肝纤维化具有良好的诊断效果。在本研究中,HBsAg诊断显着肝纤维化的AUC为0.590,低于γ-GT、GqHBsR、FIB-4及APRI,可见诊断效果并不理想。其原因可能为:机体在HBV感染的不同阶段HBsAg水平存在较大程度的差异,尤其是在部分患者有接受免疫调节及抗病毒治疗的情况下,还会呈现出更为明显的个体化差异[10]。γ-GT是一种广泛分布于哺乳动物组织中的质膜结合糖蛋白。有研究认为γ-GT与肝纤维化程度有一定相关性。Vardar等[11]发现,与处于S0~1期的轻度肝纤维化患者比较,处于S3~4期的重度肝纤维化患者的血清γ-GT水平明显更高。本研究中的检测结果与之相符。张凡等[12]认为,血清γ-GT水平与肝脏炎症及肝脏纤维化程度均具有关联;Fung等[13]认为,γ-GT水平与肝纤维化程度呈正相关,并将γ-GT纳为了评价肝纤维化程度最稳定的指标之一。但也有部分学者持有不同甚至截然相反的意见,如王功遂等[14]发现,部分患者在进入到S4期后其γ-GT水平反而会降低;冼永超等[15]的研究表明,基于炎症活动可能出现较大程度γ-GT水平的变化;魏立等[16]则指出,γ-GT水平与肝纤维化程度无明显相关性。故总体而言,γ-GT诊断肝纤维化尚存在较大争议。本研究结果显示γ-GT诊断显着肝纤维化的AUC为0.599,略大于HBsAg。
本研究对不同肝纤维化分期患者的γ-GT、HBsAg定量及GqHBsR值的检测结果显示,作为γ-GT、HBsAg定量二者的比值,GqHBsR值在不同肝纤维化分期患者中的差异最为明显,同时参考Xun等[17]的研究成果,认为基于γ-GT、HBsAg定量二者联合检测所形成的GqHBsR诊断模型或许可获得对肝纤维化更高的预测价值。本研究结果证实,无论是与HBsAg和γ-GT两项单因子的纵向比较,还是与FIB-4、APRI两种常用诊断模型的横向比较,GqHBsR模型诊断显着肝纤维化均更具优势。而FIB-4与APRI两种模型的诊断效果虽然也较为满意,但可能由于均包含ALT或 AST等炎性指标,易受炎症活动干扰[18]。以ALT为例,研究认为ALT并不能完全反映慢性乙型肝炎患者的炎症活动度。随肝脏炎症活动度加重,ALT可能下降,如“酶胆分离”现象;而ALT明显升高者,肝组织炎症活动度并不一定严重。当肝组织由于病变活动时,血清学改变可能会早于或晚于组织学表现,或病情恢复时,组织炎症消退较缓慢。此外,ALT并非肝脏疾病的特异性指标,当机体器官出现其他实质性损伤,如急性心肌梗死[19]、大叶性肺炎[20]等,ALT均可增高。在明确GqHBsR对显着肝纤维化的诊断效果后,本研究还进一步参考了GqHBsR对不同分期肝纤维化患者的诊断价值,结果显示,各期AUC均在0.9左右;Se、Sp、PPV及NPV的计算结果数值均较高,提示GqHBsR对各期肝纤维化均能做出满意诊断。
综上所述,无创性诊断模型是当前肝纤维化程度临床诊断的热点领域之一,GqHBsR模型对慢性HBV感染患者肝纤维化程度具较高诊断价值,可在一定程度上降低此类患者接受肝穿刺活检的比例,值得进一步在临床推广应用。
[1]宋攀,刘伟,刘天杰,等.糖皮质激素对慢性重度乙型肝炎疗效及安全性的Meta分析[J].重庆医学,2015,44(24):3407-3410.
[2]Chu CM,Liaw YF.Hepatitis B virus-related cirrhosis:natural history and treatment[J].Semin Liver Dis,2006,26(2):142-152.
[3]Chen YC,Chu CM,Yeh CT,et al.Natural course following the onset of cirrhosis in patients with chronic hepatitis B:a long-term follow-up study[J].Hepatol Int,2007,1(1):267-273.
[4]Grigorescu M.Noninvasive biochemical markers of liver fibrosis[J].J Gastrointestin Liver Dis,2006,15(2):149-159.
[5]程捷瑶,马红.慢性肝病肝纤维化无创诊断的研究进展[J].临床肝胆病杂志,2014,30(2):178-181.
[6]Orito E,Mizokami M,Sakugawa H,et al.A case-control study for clinical and molecular biological differences between hepatitis B viruses of genotypes B and C[J].Hepatology,2001,33(1):218-223.
[7]Friedm SL.Lirer fibrosis-from bench to bedside[J].J Hepatol,2003,38(1):538-539.
[8]Mukherjee R,Reddy PB,Arava J,et al.Relationship between serum HBsAg level,HBV DNA level,and peripheral immune cells in patients with chronic hepatitis B virus infection[J].Hepat Med,2010,2:157-162.
[9]Chou YC,Yu MW,Wu CF,et al.Temporal relationship between hepatitis B virus enhancer II/basal core promoter sequence variation and risk of hepatocellular carcinoma[J].Gut,2008,57(1):91-97.
[10]安宏亮,江海燕,伍华林.HBsAg水平对慢性乙型病毒性肝炎肝纤维化病变的诊断价值[J].广东医学,2014,35(13):2090-2092.
[11]Vardar R,Vardar E,Demiri S,et al.Is there any noninvasive marker replace the needle liver biopsy predictive for liver fibrosis,in patients with chronic hepatitis[J].Hepatogastroenterology,2009,56(94/95):1459-1465.
[12]张凡,邓林,王波,等.腺苷脱氨酶、γ-谷氨酰转肽酶与肝纤维化程度的相关性分析[J].中国冶金工业医学杂志,2009,26(3):367-368.
[13]Fung J,Lai CL,Fong DY,et al.Correlation of liver biochemistry with liver stiffness in chronic hepatitis B and development of a predictive model for liver fibrosis[J].Liver Int,2008,28(10):1408-1416.
[14]王功遂,刘梅华,姜湘宁,等.血清谷氨酸转肽酶在慢性在慢性乙型肝炎中的诊断价值[J].中华肝脏病杂志,2002,10(2):120-122.
[15]冼永超,杨景毅,徐茹,等.血清谷氨酸转肽酶含量测定在慢性乙型肝炎中的临床意义[J].中华实验和临床病毒学杂志,2007,21(4):383-385.
[16]魏立,张丽娟,张跃新.肝病患者血清学指标与肝纤维化程度的关系[J].标记免疫分析与临床,2009,16(4):205-208.
[17]Xun YH,Zang GQ,Guo JC,et al.Serum hepatitis B surface antigen quantification as a useful assessment for significant fibrosis in hepatitis B e antigen-positive hepatitis B virus carriers[J].J Gastroenterol Hepatol,2013,28(11):1746-1755.
[18]Du DN,Zhu XE,Kuno A,et al.Comparison of LecT-Hepa and FibroScan for assessment of liver fibrosis in hepatitis B virus infected patients with different ALT levels[J].Clinica Chimica Acta,2012,413(21/22):1796-1799.
[19]Giesen P,Peltenburg H,Zwaan C,et al.Greater than expected alanine aminotransferase activities in plasma and in hearts of patients with acute myocardial infarction[J].Clin Chem,1989,35(2):279-283.
[20]Kudryashov AV,Vavilin VA,Kolpakova TA,et al.Relationship between CYP2E1 Polymorphism and Increase of ALT Activity during Therapy of Patients with Pulmonary Tuberculosis[J].Bull Exp Biol Med,2011,151(6):741-746.
张峰(1985-),主管检验师,硕士,主要从事传染病方面的研究。
△通信作者,E-mail:xyhong1964@163.com。
10.3969/j.issn.1671-8348.2017.21.027
R512.6
B
1671-8348(2017)21-2968-04
2017-02-14
2017-04-18)



