梁馨云,赵 毅#,黎银潮,李湛豪,曾慧玲,王 燕△
(广东医科大学:1.基础医学院;2.第二临床医学院,广东东莞 523808)
论着·基础研究doi:10.3969/j.issn.1671-8348.2017.28.003
稳定eIF1过表达的鼻咽癌细胞株的构建及其功能研究*
梁馨云1,赵 毅1#,黎银潮2,李湛豪2,曾慧玲2,王 燕1△
(广东医科大学:1.基础医学院;2.第二临床医学院,广东东莞 523808)
目的构建稳定真核翻译起始因子1(eIF1)过表达的鼻咽癌细胞株,研究其对鼻咽癌细胞增殖和迁徙活性的影响。方法采用pEGFP-C1真核表达系统,构建eIF1过表达载体,转染鼻咽癌CNE1细胞,进而获得稳定转染细胞株CNE1-eIF1及其对照细胞,以实时荧光定量PCR(qPCR)和蛋白质印迹法(Western blot)验证该细胞中eIF1的过表达情况。采用细胞增殖与迁徙实验分别检测CNE1-eIF1细胞增殖和迁徙活性。结果酶切电泳鉴定及测序检测显示pEGFP-C1-eIF1真核表达载体构建成功。稳定eIF1过表达的鼻咽癌CNE1细胞CNE1-eIF1的eIF1基因和蛋白的表达水平与空载质粒转染相比分别增加2.85倍和2.58倍(P<0.05),而其增殖和迁徙活性组分别下调55%和36%(P<0.05)。结论成功构建eIF1过表达鼻咽癌细胞株,eIF1过表达可显着下调鼻咽癌细胞的增殖和迁徙活性,提示其具有潜在的抑癌作用。
鼻咽肿瘤;稳定细胞株;EIF1;基因转染;真核翻译因子
真核翻译起始因子1(eukaryotic initiation factor1,eIF1)是该家族中最早被命名的成员,其蛋白相对分子质量约12×103,基因位于17q21.2区[1-2]。eIF1因被发现能够以其不同的蛋白质表面区域结合40S核糖体亚基、eIF2、eIF3及eIF5等,参与组装43S翻译前起始复合物,高保真扫描并选择翻译起始密码子而备受关注[3-4]。随着对eIF4E、eIF5A等家族成员的功能进一步研究,特别是在细胞发育、肿瘤发生与转移等进程中的作用不断引发研究热潮[5-6],针对该家族其他成员的研究探索逐渐成为研究热点[7-8]。本研究通过体外基因克隆技术,构建了过表达eIF1的鼻咽癌细胞株及阴性转染对照细胞[9],进而就过表达eIF1对鼻咽癌细胞增殖和迁徙活性的影响进行了研究,以期为探讨真核翻译调控机制对肿瘤发生、发展的影响提供重要的实验基础。
1 材料与方法
1.1材料
1.1.1细胞 真核表达载体pEGFP-C1及鼻咽癌CNE1细胞为广东医科大学科研实验中心保存提供,大肠杆菌感受态细胞DH5α购自生工生物工程(上海)有限公司。
1.1.2试剂与引物 高纯度质粒小提中量试剂盒(DP107)、DNA Marker购自天根生化科技(北京)有限公司;2×Power Taq Plus PCR MasterMix(PR4001)购自北京百泰克生物技术有限公司;限制性核酸内切酶HindIII/BamHI、RNAiso Plus(9108)及PrimeScriptTMRT reagent Kit with gDNA Eraser(RR047A)购自宝生物工程(大连)有限公司;Lipofectamine®3000 Transfection Reagent(L3000008)购自Thermo Fisher Scientific公司;FastStart Universal SYBR Green Master(ROX,04913850001)购自罗氏(中国)公司;Anti-eIF1单克隆抗体(ab118979)、Anti-β Actin单克隆抗体(ab8226)购自Abcam公司;RIPA Lysis Buffer System(sc-364162)、BCA Protein Assay Kit(sc-202389)、Western Blotting Luminol Reagent(sc-2048)及HRP标记羊抗鼠二抗(sc-2005)购自Santa Cruz公司。CCK8检测试剂盒(CA1210)购自北京索莱宝科技有限公司;Transwell小室(3422)购自Corning公司。eIF1的Real-time PCR引物,上游:5′-TGT AAC CAT TTG GGG TCC GCT T-3′,下游:5′-TTT GTA ATC TTA GGG CTC TGG GCTT-3′。内参GAPDH的Real-time PCR引物,上游:5′-TGA CTT CAA CAG CGA CAC CCA-3′,下游:5′-CAC CCT GTT GCT GTA GCC AAA-3′。
1.2方法
1.2.1质粒构建与鉴定 以Genbank中eIF1的mRNA序列(NM_005801.3)为模板,pEGFP-C1载体为基础,构建eIF1过表达载体,插入序列两端携带限制性核酸内切酶HindⅢ/BamHⅠ的靶序列。以测序、PCR鉴定及酶切电泳验证插入序列及过表达载体构建情况。
1.2.2细胞培养 将鼻咽癌CNE1细胞于含10%FBS的DMEM培养液中,在37 ℃、5%CO2培养箱中饱和湿度、常规培养。分别设置常规培养组(Blank组)、过表达质粒转染组(CNE1-eIF1组)、空载质粒转染组(CNE1-NC组)及阴性转染对照组(Control组),每组3复孔。
1.2.3细胞转染 参照说明书,采用Lipofectamine®3000 Transfection Reagent以试剂盒参考比例转染质粒DNA入鼻咽癌CNE1细胞中,转染后12 h换液。转染后24~48 h观察细胞荧光表达情况,计算转染效率,经预实验验证,以转染后48 h荧光表达为鉴定细胞转染效率的依据。
1.2.4稳定过表达细胞株筛选及鉴定 转染后48 h,以含有G418(800 μg/mL)的DMEM培养基稀释细胞,而后挑取单克隆加压筛选2个月,3~4 d更换含有G418(终浓度400 μg/mL)的DMEM培养液1次筛选培养,待细胞数稳定增长后,挑取单克隆细胞簇进行RNA及蛋白水平鉴定,其中RNA检测采用实时荧光定量PCR(qPCR),严格按试剂盒说明书操作,采用宝生物工程(大连)有限公司RNAiso plus试剂盒提取细胞总RNA,以PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒合成cDNA,并用FastStart Universal SYBR Green Master(ROX)进行检测。蛋白检测采用蛋白质印迹法(Western blot),参照说明书,以RIPA Lysis Buffer System试剂盒提取细胞总蛋白,以BCA Protein Assay Kit对总蛋白定量,而后以50 μg总蛋白及蛋白Marker上样,采用12% SDS/PAGE电泳,PVDF膜转印,特异性一抗4 ℃抚育过夜,以Western Blotting Luminol Reagent检测。留取与对照组相比,eIF1过表达水平最高的1株细胞株,即为CNE1-eIF1过表达细胞,同时结合荧光表达鉴定法构建空载体转染对照细胞株CNE1-NC细胞。
1.2.5细胞增殖实验 选用CCK8细胞增殖检测试剂盒,取对数生长期各组细胞以每孔3 000个分别接种于96孔细胞培养板中,细胞接种后12 h,设置重复孔,其后严格按照试剂盒说明书操作,BioTek公司Synergy 2多功能酶标仪450 nm波长测每孔吸光度(A)值。与对照组相比,计算细胞增殖比率。
1.2.6细胞迁徙实验 采用Corning公司Transwell小室,取对数生长期细胞,按每毫升5×105个细胞浓度加入200 μL无血清细胞悬液到小室中,下室中加入含10%FBS和1%纤维粘连蛋白的完全培养基500 μL,设置3复孔,继续培养48 h后,取出Transwell小室用PBS 轻轻洗2遍,用棉签去除上室膜表面的细胞。甲醇固定30 min,0.1%结晶紫室温下染色30 min,PBS洗3遍使结晶紫完全冲干净,在高倍镜视野下计数穿膜细胞数,取交叉十字共10 个视野,计算平均值。与对照组相比,计算细胞迁移比率。
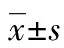
2 结 果
2.1质粒酶切电泳及测序结果 如图1所示,可见环状质粒DNA被切断后呈现线性条带改变。证明质粒构建插入内切酶HindⅢ及BamHⅠ的酶切位点正确可靠。双向测通,pEGFP-C1-eIF1载体MCS(Multiple cloning site)区插入序列与拟构建的eIF1表达序列一致,见图2。
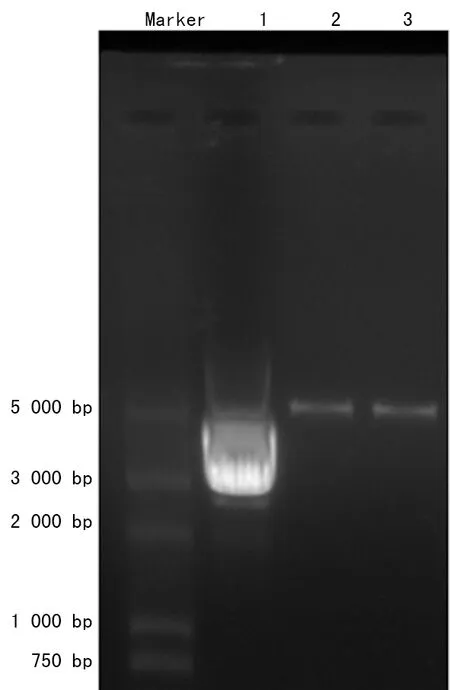
1:pEFGP-C1-eIF1载体;2:pEGFP-C1-eIF1载体经HindⅢ酶切后形成的线性DNA;3:pEGFP-C1-eIF1载体经BamHⅠ酶切后形成的线性DNA
图1 pEGFP-C1-eIF1质粒酶切电泳图
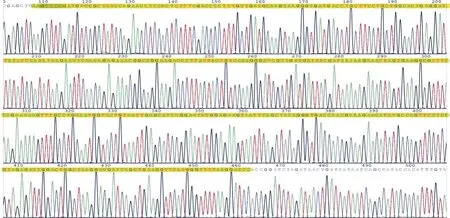
图2 pEFGP-C1-eIF1插入序列测序峰
2.2细胞转染情况 与Blank组、Control组相比,CNE1-eIF1组、CNE1-NC组细胞均出现大量明显的绿色荧光,计数200个细胞,两组细胞均显示转染效率为90%以上,说明转染成功,外源GFP绿色荧光蛋白表达正常。见图3。
2.3eIF1过表达鉴定 Blank组和CNE1-NC组细胞eIF1基因、蛋白的表达水平比较差异无统计学意义(P>0.05);与CNE1-NC组相比,CNE1-eIF1组细胞的eIF1 mRNA、蛋白的表达水平分别上调2.85倍、2.58倍(P<0.05)。见图4、5。
2.4eIF1过表达对鼻咽癌细胞增殖和迁徙活性的影响 Blank组和CNE1-NC组细胞增殖、迁移活性比较差异无统计学意义(P>0.05);与CNE1-NC组相比,CNE1-eIF1组细胞的增殖、迁移活性分别下调55%、36%(P<0.05)。见图6。
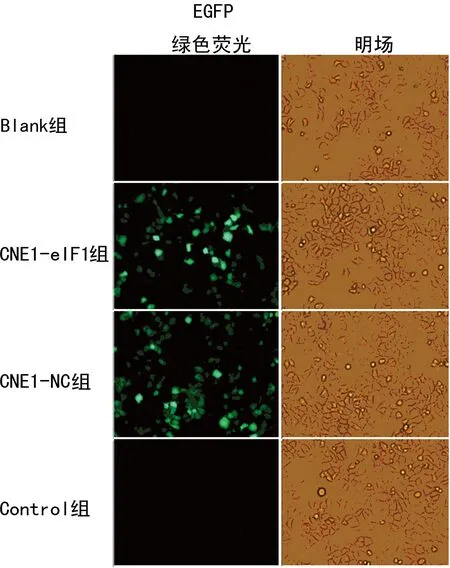
图3 细胞转染24 h荧光表达
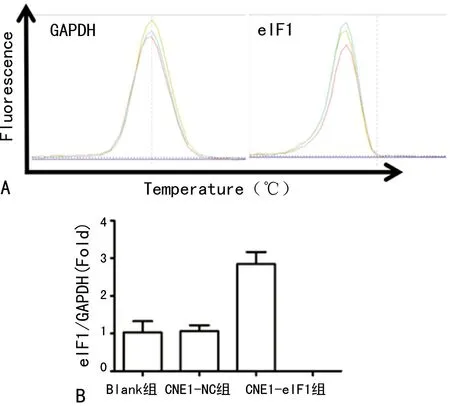
A:内参基因GAPDH及目的基因eIF1的溶解曲线图;B:3组细胞eIF1 mRNA相对表达量
图4 eIF1稳定转染细胞株eIF1 mRNA表达水平
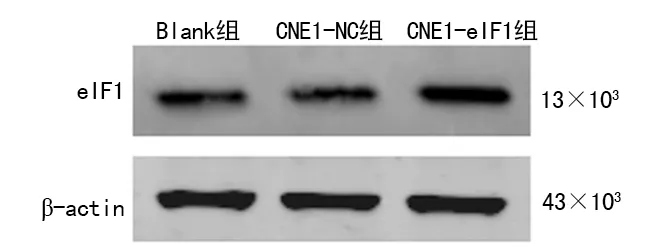
β-actin:内参基因GAPDH;eIF1:目的基因
图5 eIF1稳定转染细胞株eIF1蛋白表达水平
A:增殖;B:迁徙
图6过表达eIF1对鼻咽癌CNE1细胞的增殖和迁徙活性的影响
3 讨 论
作为真核翻译起始因子家族成员中第1个与拟表达基因mRNA起始区域结合的成分,eIF1对于选择并扫描相关基因mRNA自5′帽子结构区至起始密码子AUG序列前,进而控制翻译起始的保真性与延续性等过程至关重要[3]。Lind等[1]研究发现,eIF1与eIF1A一起通过控制翻译起始阶段,针对mRNA起始密码第1位和第3位碱基配对的识别与自由能的调控,升高错配自由能需求,进而保真调节核糖体tRNA识别结合mRNA起始密码子的扫描过程。另外,在密码子与反密码子没有正确配对时,eIF1可以抑制GTP的水解,控制AUG上下游碱基序列的配对,调控翻译起始过程。当密码子的识别完成后,eIF1 的抑制作用被减弱,经由精确的起始密码子及其上下游碱基的配对eIF1的抑制作用得以减弱[10],从而启动翻译起始复合物的合成。有研究发现,蛋白翻译起始时40 S核糖体亚基上面的mRNA结合通道为关闭状态,当eIF1和eIF1A先后结合到亚基上面时,特别是eIF1 结合到40 S核糖体亚基P位点后,其mRNA结合通道才得以打开,拟表达基因的mRNA结合到核糖体亚基上,核糖体tRNA开始沿mRNA的5′端进行扫描,识别AUG起始密码子及其上下游碱基序列,碱基配对无误后,eIF1 从核糖体亚基上释放出来,翻译起始复合物开始形成, mRNA结合通道关闭,蛋白翻译起始[11-12]。在此过程中,特别是在核糖体完成与拟表达基因mRNA起始密码子识别后,eIF1的存在对翻译前起始复合物的形成,GTP水解和能量释放,乃至蛋白翻译过程的抑制作用,不容忽视[13]。
目前,随着真核翻译起始家族成员在多种人类疾病,尤其是肿瘤相关疾病中的研究日渐深入,如eIF4E、eIF5A等在乳腺癌、大肠癌和鼻咽癌等多种肿瘤中的促癌作用已成为相关研究热点[14-15],作为启动真核蛋白翻译起始的关键分子,eIF1在肿瘤发生、发展进程中的作用亟待进一步的研究。为研究eIF1在鼻咽癌发生、发展中作用,本研究成功构建了eIF1真核表达载体,转染至鼻咽癌CNE1细胞中,筛选并成功构建了过表达eIF1的鼻咽癌CNE1-eIF1细胞及其对照阴性CNE1-NC细胞,从而为进一步探讨蛋白翻译起始调控在癌基因表达和肿瘤形成、复发、转移中的影响提供了研究工具。在此基础上,笔者就eIF1对鼻咽癌细胞增殖和迁徙活性的影响进行了初步的探索,结合文献研究,笔者发现过表达的eIF1可明显下调鼻咽癌细胞的增殖和迁徙活性,提示eIF1在鼻咽癌CNE1细胞的蛋白翻译起始过程中具有重要的调控作用,其对CNE1细胞翻译起始复合物的形成和真核细胞蛋白翻译的启动可能具有重要的开关抑制作用,并可由此影响到细胞的一系列生物学行为,对肿瘤细胞可能具有潜在的抑癌作用。
目前国内外虽已有多家研究机构致力于此方面的相关研究,但均无明确的突破,本研究的发现为真核细胞蛋白翻译的机制研究和肿瘤癌基因异常表达的调控研究提示了研究方向,为进一步的探讨eIF1影响鼻咽癌病变转移机制奠定了一定的基础。
[1]Lind C,Aqvist J.Principles of start codon recognition in eukaryotic translation initiation [J].Nucleic Acids Res,2016,44(17):8425-8432.
[2]Sheikh MS,Fernandez-Salas E,Yu M,et al.Cloning and characterization of a human genotoxic and endoplasmic reticulum stress-inducible cDNA that encodes translation initiation factor 1(eIF1(A121/SUI1))[J].J Biol Chem,1999,274(23):16487-16493.
[3]Hussain T,Llácer JL,Fernández IS,et al.Structural changes enable start codon recognition by the eukaryotic translation initiation complex [J].Cell,2014,159(3):597-607.
[4]Lind C,Esguerra M,Åqvist J.A close-up view of codon selection in eukaryotic initiation [J].RNA Biol,2017,14(7):815-819.
[5]Nakanishi S,Cleveland JL.Targeting the polyamine-hypusine circuit for the prevention and treatment of cancer [J].Amino Acids,2016,48(10):2353-2362.
[6]Fischer PM.Cap in hand:targeting eIF4E [J].Cell cycle,2009,8(16):2535-2541.
[7]刘岱松,杨思思,谭江琳,等.真核起始因子6抑制小鼠肾间质纤维化的组织学研究[J].重庆医学,2014,43(16):2022-2025.
[8]Lu C,Makala L,Wu D,et al.Targeting translation:eIF4E as an emerging anticancer drug target [J].Expert Rev Mol Med,2016,18:e2.
[9]聂伟,王小毅,邱干,等.ABCG2过表达对乳腺癌细胞上皮间质化能力的影响 [J].重庆医学,2016,45(26):3622-3623,3626.
[10]Ivanov IP,Loughran G,Sachs MS,et al.Initiation context modulates autoregulation of eukaryotic translation initiation factor 1 (eIF1) [J].Proc Natl Acad Sci U S A,2010,107(42):18056-18060.
[11]Martin-Marcos P,Nanda JS,Luna RE,et al.Enhanced eIF1 binding to the 40S ribosome impedes conformational rearrangements of the preinitiation complex and elevates initiation accuracy [J].RNA,2014,20(2):150-167.
[12]Maduzia LL,Moreau A,Poullet N,et al.The role of eIF1 in translation initiation codon selection in Caenorhabditis elegans [J].Genetics,2010,186(4):1187-1196.
[13]Llácer JL,Hussain T,Marler L,et al.Conformational differences between open and closed states of the eukaryotic translation initiation complex [J].Mol Cell,2015,59(3):399-412.
[14]Ramon S,De Mattos-Arruda L,Sonenberg N,et al.The intra-tumor heterogeneity of cell signaling factors in breast cancer:p4E-BP1 and peIF4E are diffusely expressed and are real potential targets [J].Clin Transl Oncol,2014,16(11):937-941.
[15]Mathews MB,Hershey JW.The translation factor eIF5A and human cancer [J].Biochim Biophys Acta,2015,1849(7):836-844.
StudyonconstructionandfunctionofCNE1cellsstablyover-expressingeIF1gene*
LiangXinyun1,ZhaoYi1#,LiYinchao2,LiZhanhao2,ZengHuiling2,WangYan1△
(1.BasicMedicalCollege;2.SecondClinicalMedicalCollege,GuangdongMedicalUniversity,Dongguan,Guangdong523808,China)
ObjectiveTo establish nasopharyngeal carcinoma cell line (CNE1) with eIF1 gene stable over-expression and to study its effects on the proliferation and migration of nasopharyngeal carcinoma cells.MethodsEIF1 over-expression vector was constructed by adopting the pEGFPC1 eukaryotic expression system for transfecting nasopharyngeal carcinoma CNE1 cells.Thus the stably transfected EIF1-elF1 and its control cells were obtained.The over-expression situation of eIF1 in these cells was verified by real time fluorescence quantitative PCR(qPCR) and Western blot.The proliferation and migration activity of CNE1-eIF1 cells were tested by adopting the cell proliferation and migration tests.ResultsThe enzyme digestion electrophoresis identification and sequencing showed that the pEGFPC1-eIF1 eukaryotic expression vector was successfully constructed.After mRNA and protein expression identification,compared with the reloading plasmid transfection group,the eIF1 gene mRNA and protein expression levels in nasopharyngeal carcinoma cell line CNE1 stably over-expressing elF1 were up-regulated by 2.85 folds and 2.58 folds respectively (P<0.05),while its proliferation and migration activities were down-regulated by 55% and 36% respective (P<0.05).ConclusionThe nasopharyngeal carcinoma cell line over-expressing elF1 is successfully constructed,the eIF 1 over-expression could significantly down-regulate the proliferation and migration activities of nasopharyngeal carcinoma cells,suggesting that eIF1 has potential anti-tumor effect.
nasopharyngeal neoplasms;stable cell lines;EIF1;gene transfection;eukaryotic translation factor
广东省自然科学基金资助项目(2015A030310046);广东省中医药局科研基金资助项目(20151261);广东医科大学国家级大学生创新创业训练计划基金资助项目(201510571003)。
梁馨云(1981-),实验师,本科,主要从事肿瘤学与病原生物学研究。#共同第一作者赵毅(1978-),副教授,博士,主要从事肿瘤免疫学研究。△
,E-mail:657057106@qq.com。
R73-35
A
1671-8348(2017)28-3896-04
2017-04-18
2017-06-06)



