王程强,李胜联,欧超燕,施文祥,宋家乐
(桂林医学院公共卫生学院,广西桂林 541001)
·论着·
低水平母源性BDE209暴露对子鼠甲状腺激素及甲状腺激素脱碘酶的影响*
王程强,李胜联,欧超燕,施文祥,宋家乐△
(桂林医学院公共卫生学院,广西桂林 541001)
目的探讨孕哺期低剂量十溴联苯醚(BDE209)暴露对子代小鼠甲状腺激素及甲状腺激素代谢酶碘化甲状腺氨酸脱碘酶Ⅱ(D2)的影响。方法将64只成年SPF级昆明雌鼠分为4组,受孕成功后分别经口灌胃给予0(对照组)、50(低剂量组)、100(中剂量组)、300(高剂量组) μg·kg-1·d-1BDE209染毒处理,染毒持续至母鼠分娩后第21天。各组随机抽取10只子鼠取外周血和大脑组织,测定外周血甲状腺激素水平、大脑氧化损伤情况及大脑D2 mRNA表达量。结果与对照组比较,不同BDE-209剂量组的子鼠血清中总甲状腺素(TT4)、总三碘甲腺原氨酸(TT3)、游离四碘甲腺原氨酸(FT4)和游离三碘甲腺原氨酸(FT3)水平出现不同程度的升高(P<0.05);脑组织中抗氧化酶谷胱甘肽S-转移酶(GST)、超氧化物歧化酶(SOD)活性随着BDE209剂量增高而降低(P<0.05),丙二醛(MDA)随着BDE209剂量增高而升高(P<0.05);中、高剂量组脑组织中D2 mRNA相对表达量较对照组下降(P<0.05)。结论低水平母源性BDE209暴露可导致子代小鼠甲状腺激素水平的上升进而引起大脑氧化损伤和D2基因表达的下降。
十溴联苯醚;甲状腺激素类;碘化物过氧化物酶;氧化损伤
随着阻燃剂多溴联苯醚(PBDEs)的广泛使用,在人类、鱼类等多种生物体内及大气、水底沉积物、土壤和室内灰尘等外界环境中不断有BDE209检出,同时其浓度也在不断升高[1-3]。作为PBDEs暴露的主要来源,环境和生物体中的BDE209在光降解、微生物降解及生物代谢等条件下可以转化为毒性更大的BDE-47、BDE-99等低溴联苯醚[4-6]。溴系阻燃剂因为其生物毒性正在被逐渐禁止使用,但含溴系阻燃剂的产品在使用、拆解和回收过程中的仍将有PBDEs的释放和接触,未来几十年内BDE209和其他PBDEs的暴露还将持续。大量研究证明,低浓度的PBDEs(BDE-47,BDE-99)可以通过干扰甲状腺激素的转运或降低靶组织反应能力造成甲状腺激素水平异常进而引起神经发育障碍等异常反应[7-8]。目前,关于BDE209对甲状腺功能损害的研究十分有限。人群流行病学资料提示PBDEs的敏感人群主要为孕妇、婴幼儿。而也有研究表明,母亲孕期暴露PBDEs与出生儿童的神经发育和智力障碍存在高度相关性[9]。碘化甲状腺氨酸脱碘酶(iodothyroninedeiodinases,DI)是一组含硒整合膜蛋白,能够调节组织细胞内甲状腺激素的生物活性,大脑皮层的T3主要是由星型胶质细胞质中的T4在碘化甲状腺氨酸脱碘酶Ⅱ(D2)催化下生成,研究BDE209暴露下D2的活性有助于进一步揭示BDE209引起神经发育障碍的机制。因此,本实验通过对孕母鼠进行BDE209染毒,观察BDE209对子鼠甲状腺激素的干扰。
1 材料与方法
1.1动物分组及处理 成年昆明雌鼠64只(购于桂林医学院实验动物中心,合格证号SCXK桂2013-0001),体质量18~20 g,适应性饲养1周,按雌雄比例3∶1合笼交配,以雌鼠阴道分泌物涂片中观察到活动的精子,作为交配成功的标志。将受孕成功的雌鼠分为对照组、低剂量组、中剂量组和高剂量组。 将BDE209(纯度100%,美国Sigma公司)溶于玉米油,分别给予0、50、100、300 μg·kg-1·d-1剂量BDE209灌胃处理(对照组母鼠灌胃与中剂量组等量花生油)至母鼠分娩的第21天。各剂量组选取子鼠10只(雌雄各半),乙醚麻醉后心脏取血法取子鼠外周血,离心后取上清液,放射免疫分析法检测血清中总四碘甲腺原氨酸(TT4)、总三碘甲腺原氨酸(TT3)、游离四碘甲腺原氨酸(FT4)和游离三碘甲腺原氨酸(FT3)水平。无菌环境下采集子鼠脑组织后将其速冻于液氮中,-80 ℃保存待用。

表1 GAPDH、D2基因引物的基本信息
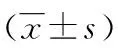
表2 各组子鼠甲状腺激素水平比较
a:P<0.05,与对照组比较;b:P<0.05,与低剂量组比较;c:P<0.05,与中剂量组比较
1.2子鼠海马组织氧化应激指标的检测 取0.5 g脑组织,解冻后用预冷的4 ℃生理盐水稀释10倍,冰上研磨制备匀浆,3 000 r/min 离心15 min,取超滤离心后的上清液备检,按照谷胱甘肽-S-转移酶(GST)、丙二醛(MDA)、超氧化物歧化酶(SOD)测试盒(南京建成生物工程研究所)说明书比色法检测GST、MDA和SOD的水平。
1.3大脑D2 mRNA表达检测 取冻存大脑,液氮研磨后用TRIzol(北京全式金生物技术有限公司)提取总RNA,采用紫外分光光度计和琼脂糖凝胶电泳对提取RNA进行定性定量验证;取2 μg总RNA反转录反应合成cDNA,反转录条件:37 ℃ 15 min;85 ℃ 5 s;4 ℃保存;按照TakaraSYBR Premix Ex TaqTM定量试剂盒说明书,按顺序在PCR 管中加入H2O 7.2 μL、引物(10 μmol/L) 各 0.4 μL、模板2.0 μL、ROX Reference Dye 0.4 μL、SYBR Premix Ex Taq 10.0 μL,混匀离心后在 Takara Thermal Cycler Dice TP800 PCR 仪上反应检测,反应程序如下:预变性95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环;95 ℃ 15 s,60 ℃ 30 s,95 ℃ 15 s。内参GAPDH和D2基因引物序列见表1。使用TP800 v4.01软件对结果进行分析,以GAPDH的表达量对结果进行标准化。

2 结 果
2.1各组子鼠甲状腺激素水平比较 母源性BDE209暴露21 d后子鼠血清中TT4、TT3、FT4、FT3水平出现不同程度的升高。其中,高、中、低剂量组中TT4、TT3、FT4、FT3水平与对照组相比差异均有统计学意义(P<0.05)。随着剂量的增高,子鼠甲状腺激素水平增高,见表2。
2.2各组子鼠大脑氧化应激指标比较 母源性BDE209暴露后各剂量组子代小鼠大脑组织中抗氧化酶GST、SOD活性随着剂量增高而降低,均低于对照组(P<0.05)。而氧化应激损伤标志物MDA的水平随着剂量增高上升显着(P<0.05),均高于对照组(P<0.05),见表3。
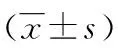
表3 各组子鼠大脑氧化应激指标比较
a:P<0.05,与对照组比较;b:P<0.05,与低剂量组比较;c:P<0.05,与中剂量组比较
2.3各组子鼠大脑D2基因表达比较 母源性BDE209暴露后中、高剂量组子代小鼠大脑组织D2 mRNA相对表达量与对照组和低剂量组相比下降(P<0.05),见图1。

a:P<0.05,与对照组比较;b:P<0.05,与低剂量组比较;c:P<0.05,与中剂量组比较
图1各组子鼠大脑D2基因表达比较
3 讨 论
目前对于环境中PBDEs的暴露对生物体甲状腺激素水平的影响存在争议。如有研究发现我国莱州湾生产源区人体血清中较高水平的PBDEs暴露与甲状腺激素水平显着相关。较高暴露水平的BDE28和BDE47可以造成人体内T3水平升高,而BDE28、BDE153、BDE183则与FT3水平之间均具有显着的正相关[10]。而本次研究结果也发现孕期低剂量BDE209暴露会造成小鼠子代甲状腺激素T3、FT3水平的升高。同样,PBDEs暴露也会引起鱼类中T4和反T3(rT3)水平的升高[11]。但一些学者也得出不同的结论,即孕期BDE209暴露导致雄性子鼠T3水平下降[12],在人群研究中发现成年男性体内BDE47和甲状腺激素水平呈负相关[13]。而Julander等[14]和Bloom等[15]的研究则认为甲状腺激素水平和PBDEs及其同系物水平并没有相关性。因此,笔者认为出现上述不一致的原因较为复杂,可能与不同的环境暴露条件及不同种属不同个体对PBDEs的代谢差异有关。
在本研究中,实验用的低、中剂量(50、100 μg·kg-1·d-1)的BDE209远低于迄今为止大多数啮齿类动物实验剂量,而更贴近于PBDEs在人群中实际的环境暴露剂量,更容易反映出其低水平环境的暴露特点[16-17]。而高计量(300 μg·kg-1·d-1)则主要反映食物中被环境污染后的BDE209蓄积剂量[16-17]。而本研究也发现,低剂量的BDE209会造成子代小鼠甲状腺激素水平的降低。而低剂量BDE209通过母体代谢后,可能生产多种不同类别的代谢产物,如脱溴代谢产物、甲氧基代谢产物及羟基代谢产物等[18]。而这一类低剂量代谢产物可能对子鼠产生低剂量兴奋效应,引起机体出现亚临床甲状腺功能亢进症状。
许多研究表明,较高的甲状腺激素水平在介导自由基所引发的氧化损伤中起关键作用。甲状腺激素异常升高会导致机体基础代谢增加,而线粒体呼吸链功能紊乱则会造成大量自由基的产生。一旦自由基的生成量超出自身抗氧化系统的清除能力,就会引起生物体内有机大分子变异,进而造成细胞和组织器官的氧化损伤[19-20],本实验发现孕期低剂量BDE209暴露会造成子代小鼠脑组织中抗氧化酶GST和SOD活性随着剂量增高而降低,而氧化应激损伤标志物MDA的水平对随着剂量增高而显着上升。作为机体代谢最高的器官,大脑富含脂质,但其自身的抗氧化能力较弱,对自由基产生非常敏感,极易发生氧化损伤而引起自身的功能障碍。这为PBDEs导致生物体神经发育障碍的机制研究提供了新的方向。
本研究发现,孕期低水平的BDE209暴露导致子鼠甲状腺激素增高,引起机体出现亚临床甲状腺功能亢进症状。甲状腺功能亢进除了高代谢综合征外还有精神和神经症状[21]。D2是甲状腺激素的重要代谢酶,主要分布在脑组织中。D2的活性变化与机体甲状腺激素的水平关系密切。而本实验采用实时荧光定量PCR技术检测孕期低剂量BDE209子鼠大脑D2 mRNA表达水平时发现,各组剂量小鼠大脑D2 mRNA表达量与对照组小鼠相比出现下降,这提示甲状腺激素水平异常升高对大脑D2基因表达水平起一定的抑制作用。国外学者也得到了相似的结论,高水平甲状腺激素抑制中枢神经系统D2表达,甲状腺激素降低时D2 mRNA表达增高[22]。D2能导致血液中的T4脱碘转化成T3,适量的T3在大脑发育及生理功能中起着关键的作用。甲状腺功能亢进时高水平的甲状腺激素可导致D2 mRNA表达减少进而减少脱碘酶的生成,使脑中T3生成减少,这有助于了解BDE209暴露导致神经发育障碍的发生机制,但其具体的发生机制还有待于进一步研究。
[1]Bi XH,Thomas O,Jones C,et al.Exposure of electronics dismantling workers to polybrominated diphenyl ethers,polychlorinated biphenyls,and organochlorine pesticides in South China[J].Environ Sci Technol,2007,41(16):5647-5653.
[2]La Guardia J,Hale C,Harvey E.Evidence of debromination of decabromodiphenyl ether(BDE209) in biota from a wastewater receiving stream[J].Environ Sci Technol,2007,41(19):6663-6670.
[3]Chen D,Letcher J,Burgess M,et al.Flame retardants in eggs of four gull species(Laridae) from breeding sites spanning Atlantic to Pacific Canada[J].Environ Pollut,2012,168(5):1-9.
[4]Stapleton M,Dodder G.Photodegradation of decabromodiphenyl ether in house dust by natural sunlight[J].Environ Toxicol Chem,2008,27(2):306-312.
[5]Gerecke C,Hartmann C,Heeb V,et al.Anaerobic degradation of decabromodiphenyl ether[J].Environ Sci Technol,2005,39(4):1078-1083.
[6]Stapleton M,Alaee M,Letcher J,et al.Debromination of the flame retardant decabromodiphenyl ether by juvenile carp(Cyprinus carpio) following dietary exposure[J].Environ Sci Technol,2004,38(1):112-119.
[7]徐志强,周启星,张悫,等.多溴二苯醚动物毒理学研究进展及其生态毒理学展望[J].应用生态学报,2007,18(5):1143-1152.
[8]Mcdonald A.A perspective on the potential health risks of PBDEs[J].Chemosphere,2002,46(5):745-755.
[9]Chen A,Yolton K,Rauch SA,et al.Prenatal polybrominated diphenyl ether exposures and neurodevelopment in U.S.children through 5 years of age:the HOME study[J].Environ Health Perspect,2014,122(8):856-862.
[10]李明圆,金军,杨从巧,等.生产源区人血中多溴联苯醚水平与甲状腺激素相关性研究[J].环境科学,2011,32(11):3271-3276.
[11]Turyk E,Persky W,Imm P,et al.Hormone disruption by PBDEs in adult male sport fish consumers[J].Environ Health Perspect,2008,116(12):1635-1641.
[12]Tseng LH,Li MH,Tsai SS,et al.Developmental exposure to decabromodiphenyl ether(PBDE 209):effects on thyroid hormone and hepatic enzyme activity in male mouse offspring[J].Chemosphere,2008,70(4):640-647.
[13]Hagmar L,Björk J,Sjödin A,et al.Plasma levels of persistent organohalogens and hormone levels in adult male humans[J].Arch Environ Health,2001,56(2):138-143.
[14]Julander A,Karlsson M,Hagström K,et al.Polybrominated diphenyl ethers--plasma levels and thyroid status of workers at an electronic recycling facility[J].Int Arch Occup Environ Health,2005,78(7):584-592.
[15]Bloom M,Spliethoff H,Vena J,et al.Environmental exposure to PBDEs and thyroid function among New York anglers[J].Environ Toxicol Pharmacol,2008,25(3):386-392.
[16]Shaw D,Kurunthachalam K.Polybrominated diphenyl ethers in Marine ecosystems of the American continents:foresight from current knowledge[J].Rev Environ Health,2009,24(3):157-229.
[17]LawRJ,HerzkeD.Currentlevelsandtrends of brominated flame retardants in the environment[M].Heidelberg:Springer,2010.
[18]冯承莲,许宜平,何悦,等.十溴联苯醚(BDE209)在虹鳟体内的羟基代谢产物及其对甲状腺激素水平影响的初步研究[J].生态毒理学报,2010,5(3):327-333.
[19]Venditti P,Di Meo S.Thyroid hormone-induced oxidative stress[J].Cell Mol Life Sci,2006,63(4):414-434.
[20]Videla A.Hormetic responses of thyroid hormone calorigenesis in the liver:association with oxidative stress[J].IUBMB Life,2010,62(6):460-466.
[21]刘微,熊吉东,陶永红,等.甲状腺功能异常伴发精神障碍的临床分析[J].中国地方病学杂志,2003,22(3):262-263.
[22]石峰,刘春蓉,李兰英,等.甲状腺功能亢进对大鼠中枢神经系统Ⅱ型脱碘酶mRNA表达的影响[J].中国地方病学杂志,2006,25(3):250-253.
TheeffectoflowdoseofBDE209onthyroidhormoneandthyroidhormonedeiodinaseinoffspringmiceafterpregnancyexposure*
WangChengqiang,LiShenglian,OuChaoyan,ShiWenxiang,SongJiale△
(SchoolofPublicHealth,GuilinMedicalCollege,Guilin,Guangxi541004,China)
ObjectiveTo investigate the effect of low dose of BDE209 on thyroid hormone and thyroid hormone metabolism enzyme-iodothyroninedeiodinases Ⅱ(D2) in off spring mice after pregnancy exposure.MethodsTotal 64 adult SPF female Kunming mice were randomly divided into 4 groups,which treated with oral gavage of 0,50,100,300 μg·kg-1·d-1dose of BDE209 after successful pregnancy,the exposure continue to 21 days after delivery.10 mice was randomly selected in each offspring group and get the peripheral blood and brain sample,the serum thyroid hormones level,oxidative damage and the expression of D2 mRNA in brain were detected.ResultsCompared with the control group(0 μg·kg-1·d-1dose of BDE209),the TT4,TT3,FT4 and FT3 levels of offspring mice increased significantly in every exposure group(P<0.05);antioxidant enzyme glutathione-S transferees (GST),superoxide dismutase (SOD) activity decreased with the BDE209 dose increase (P<0.05),and malondialdehyde (MDA) level increased (P<0.05);the D2 mRNA relative expression of brain in middle(100 μg·kg-1·d-1dose of BDE209) and high(300 μg·kg-1·d-1dose of BDE209) dose group decreased when compared with control group(P<0.05).ConclusionLow level of BDE209 exposure in pregnancy resulted in the increasing of thyroid hormone levels in offspring mice,which may cause oxidative damage and decrease expression of D2 mRNA in the brain.
] BDE 209;thyroid hormone;Iodide peroxidase;oxidative damage
10.3969/j.issn.1671-8348.2017.36.001
国家自然科学基金资助项目(81560530);2016年广西壮族自治区大学生科技创新项目(201610601085)。
王程强(1981-),讲师,硕士,主要从事地方医学、公共卫生研究。△
,E-mail:songjiale@glmc.edu.cn。
X174
A
1671-8348(2017)36-5041-03
2017-08-19
2017-09-27)



