王 烨,付聪敏,贾丽荣,李松燃,党晓伟,马秀芬,秦博文△
(1.承德护理职业学院,河北承德 067000;2.空军军医大学,陕西西安 710032)
穿龙薯蓣皂苷元(diosgenin,Dio)是从薯蓣科植物穿龙薯蓣的干燥根茎即穿山龙中提取、水解产生,是穿山龙的主要有效成分[1-3]。现代药理学研究证明,Dio具有抗肿瘤、调节免疫、祛痰平喘、抗变态反应、抗骨质疏松等多种药理作用[4-9],还具有激素类作用,是合成甾体激素类药物的重要原料[10]。本实验以正常小鼠脾脏T淋巴细胞为研究对象,研究Dio在体外对T淋巴细胞增殖活性的影响及对白细胞介素-2(IL-2)、干扰素-γ(IFN-γ)mRNA表达的影响,为揭示Dio的免疫调节机制提供实验依据。
1 材料与方法
1.1材料
1.1.1受试动物 清洁级C57近交系小鼠,雄性,8~10周龄,由中国医学科学院实验动物中心提供。
1.1.2药品与试剂 Dio(南京泽朗医药科技有限公司,纯度98%,批号:20132516),刀豆蛋白A(ConA)(美国Sigma公司),氢化可的松(HC,天津生物化学制药有限公司),CCK-8试剂(碧云天生物技术研究所),反转录PCR试剂盒[宝生物工程(大连)有限公司],IL-2、IFN-γ引物[生工生物工程(上海)股份有限公司]。
1.1.3仪器 DNP-9052型电热恒温培养箱(上海精宏实验设备有限公司)、YT-CJ-1N 超净工作台(北京亚泰科隆实验科技开发中心)、Multiskan MK3酶联仪(芬兰雷勃公司)、PTC-100PCR仪(美国MJ RESEARCH公司)、反转录扩增仪(美国Applied Biosytems公司)等。
1.2方法
1.2.1溶液配制 (1)Dio溶液配制:将Dio干粉加入无水乙醇,充分溶解混匀制成原液。按比例加入RPMI-1640培养基及用RPMI-1640培养基配置的15%乙醇进行稀释,制成(终浓度分别为:0.937 5、1.875 0、3.750 0、7.500 0、15.000 0 μg/mL)工作液,工作液中乙醇浓度为0.5%。(2)ConA溶液配制:称取3 mg ConA干粉,加入RPMI-1640培养基10 mL,充分溶解混匀,制成工作液,终浓度为2.5 μg/mL。(3)完全培养液配制:按比例在RPMI-1640培养基中加入10%的胎牛血清、1%的青链霉素溶液,混合均匀,制成完全培养液。
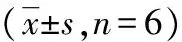
表1 Dio对各组T淋巴细胞增殖抑制率比较
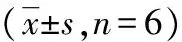
续表1 Dio对各组T淋巴细胞增殖抑制率比较
a:P<0.01,与ConA组比较;b:P<0.01,与阳性对照组比较;c:P<0.01,与7.500 0 μg/mL组比较
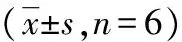
表2 Dio对IFN-γ mRNA、IL-2 mRNA表达的影响
a:P<0.01,与对照组比较;b:P<0.01,与ConA组比较;c:P<0.01,与7.500 0 μg/mL 浓度组比较
1.2.2T淋巴细胞制备 断颈处死小鼠,无菌取脾,制备脾淋巴细胞混悬液,用尼龙毛柱对其进行分离,收取T淋巴细胞,台盼蓝染色判断细胞存活率(要求存活率均在97%以上)。调整T淋巴细胞密度为2×106个/mL[11]。
1.2.3CCK-8检测Dio对T淋巴细胞增殖的影响[11-12]实验设对照组:T细胞悬液+完全培养液,ConA组:T细胞悬液+ConA溶液(2.5 μg/mL)+完全培养液,阳性对照组:T细胞悬液+ConA溶液(2.5 μg/mL)+HC溶液(1.0 μg/mL)+完全培养液,药物组:T细胞悬液+ConA溶液(2.5 μg/mL)+Dio溶液(0.937 5、1.875 0、3.750 0、7.500 0、15.000 0 μg/mL)+完全培养液,每组6个复孔,将铺好的96孔培养板放置于培养箱(37 ℃、5% CO2)中培养,总时间分别为24、48、72 h,待培养至20、44、68 h时取出,加入CCK-8试剂,充分混匀后置培养箱中继续培养4 h。用酶联仪测定各组吸光度值(OD值):450 nm处,计算Dio对T淋巴细胞增殖的抑制率(PI):PI=[1-(AConA+Dio-A对照组)/(AConA-A对照组)]×100%。
1.2.4反转录PCR法检测Dio对IL-2、IFN-γ mRNA表达的影响 实验设对照组、ConA组、阳性对照组、药物组(Dio溶液浓度3.750 0、7.500 0、15.000 0 μg/mL),每组6个复孔,将铺好的培养板置于培养箱(37 ℃、5% CO2)中,48 h后离心收集T淋巴细胞,洗涤后以TRizol提取总RNA,反转录成cDNA,用反转录PCR试剂盒检测各组T淋巴细胞IL-2、IFN-γ mRNA的表达情况[13-14]。
2 结 果
2.1Dio对T淋巴细胞增殖的影响 Dio浓度在0.937 5~7.500 0 μg/mL范围内,对T淋巴细胞增殖有抑制作用,随药物浓度递增抑制作用增强,7.500 0 μg/mL为最佳抑制浓度,超过最佳抑制浓度后抑制作用逐渐减弱,见表1。
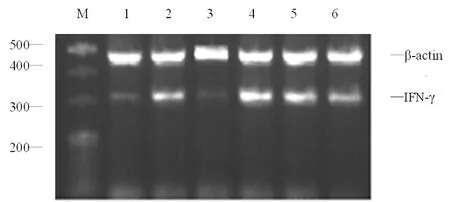
M:Mark;1:对照组;2:ConA组;3:阳性对照组;4:15.000 0 μg/mL组;5:7.500 0 μg/mL组;6:3.750 0 μg/mL组
图1各组IFN-γ mRNA的表达
2.2Dio对IL-2、IFN-γ mRNA的影响 Dio浓度在3.750 0~7.500 0 μg/mL时,对T淋巴细胞IL-2、IFN-γ mRNA的表达具有抑制作用,随药物浓度增加抑制作用增强,Dio 7.500 0 μg/mL时抑制作用最明显,为最佳抑制浓度。超过最佳抑制浓度后,对IL-2、IFN-γ mRNA的表达抑制作用逐渐减弱,见表2,图1、2。
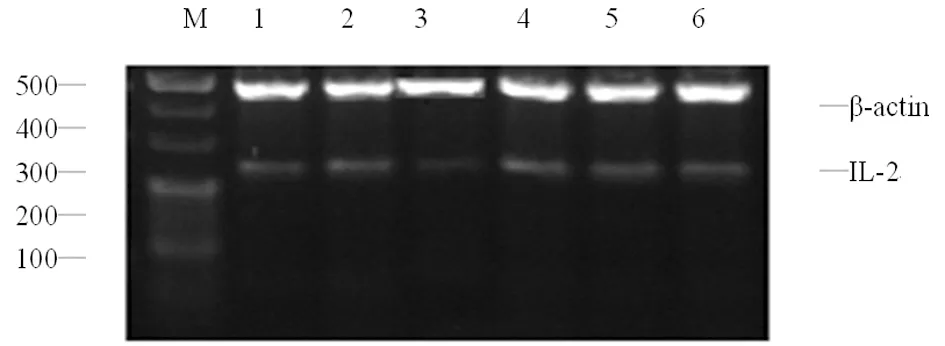
M:Mark;1:对照组;2:ConA组;3:阳性对照组;4:15.000 0 μg/mL组;5:7.500 0 μg/mL组;6:3.750 0 μg/mL组
图2各组IL-2 mRNA的表达
3 讨 论
T淋巴细胞可介导细胞免疫应答,对机体免疫应答的调节起着至关重要的作用,其活化和增殖是执行免疫功能的基础,但过度活化增殖有可能导致自身免疫性疾病和器官移植排斥反应的发生,以T淋巴细胞为靶向的免疫干预能有效地控制对机体有害的免疫应答[15]。因此,能抑制T淋巴细胞活化增殖的药物在控制对机体有害的免疫应答方面具有积极的作用。本研究先用ConA作为刺激剂,使T淋巴细胞在体外显着增殖,再用Dio进行干预,结果显示Dio各浓度组对T淋巴细胞增殖均有抑制作用,且抑制作用随浓度增加而增强,并具有一定的量效关系。
IL-2是引起T淋巴细胞增殖的主要细胞因子,可通过提高T淋巴细胞的数量和功能达到增强机体免疫功能的效果,在机体复杂的免疫网络中起调节作用[15]。IFN-γ即Ⅱ型干扰素,具有促进T淋巴细胞的分化、激活单核巨噬细胞、诱导和增加组织相容性复合体(MHC)分子的表达等功能,可以介导并且调节机体的特异性免疫[15]。IL-2、IFN-γ mRNA的表达水平与IL-2、IFN-γ水平呈正相关,因此可间接反映T淋巴细胞增殖的情况。在本研究中,T淋巴细胞经ConA刺激、Dio干预后,各浓度组T淋巴细胞IL-2、IFN-γ mRNA的表达与ConA组相比较均有明显下降,且抑制作用随药物浓度增加而增强。经Dio干预后IL-2、IFN-γ mRNA的表达情况与T淋巴细胞增殖实验中的结果相符,从而进一步印证了Dio对T淋巴细胞增殖影响的结果。
综上所述,Dio对T淋巴细胞的增殖及对IL-2、IFN-γ mRNA的表达均有抑制作用。研究Dio在体外对正常T淋巴细胞的增殖、活化的影响,以及其对IL-2、IFN-γ mRNA表达的影响,可反映出Dio发挥免疫调节功能的过程及机制,其结果为揭示Dio的免疫调节机制奠定基础,并为进一步开发其作为免疫调节剂应用于自身免疫性疾病的治疗提供实验依据。
[1]国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2010:250.
[2]庞晓东,庞发忠,林耀庚,等.穿地龙的成分、药理及临床应用[J].山西中医,2002,18(5):50-51.
[3]赵景婵,郭治安,成小飞,等.穿山龙薯蓣中薯蓣皂苷元的高效液相色谱法测定[J].药物分析杂志,2000,20(1):27.
[4]张数鑫,周录英,于元杰.穿龙薯蓣研究进展[J].分子植物育种,2005,3(1):107-111.
[5]宋宇,梁长青,何忠梅,等.薯蓣皂苷元体外抗肿瘤作用的研究[J].中国肿瘤,2004,13(10):651-653.
[6]MOALIC S,LIAGRE B,CORBIRE C,et al.A plant steroid,diosgenin,induces apoptosis,cell cycle arrest and COX activity in osteosarcoma cells[J].FEBS Lett,2001,506(3):225-230.
[7]高志捷,陈信义,刘江涛,等.薯蓣皂苷体外抑制白血病细胞增殖研究[J].中国中医基础医学杂志,2003,9(8):17-19.
[8]江洋珍,王俊俊,梁继超,等.薯蓣皂苷元对大鼠成骨细胞增殖、分化及OPG/RANKL mRNA表达的影响[J].中华中医药杂志,2010,25(1):134-136.
[9]雷励.穿山龙注射液穴位注射治疗重症支气管哮喘临床观察[J].中国中医急症,2005,14(5):419-419,424.
[10]HAFEZ N A,BENGHUZZI H,TUCCI M.Histomorphometric evaluation of renal glomeruli exposed to sustained delivery of estrogen using adult ovariectomized rats[J].Biomed Sci Instrum,2003,39(1):487-492.
[11]郝树彬,温红玲,尹玉霞,等.BALB/c 鼠脾脏T 淋巴细胞体外转化试验条件的优化研究[J].中国医疗器械信息,2011,17(8):31-34.
[12]侯春梅,李新颖,叶伟亮,等.MTT法和CCK-8法检测悬浮细胞增殖的比较[J].军事医学科学院院刊,2009,33(4):400.
[13]林仁勇,丁剑冰,温浩,等.半定量反转录PCR检测细胞因子表达的研究[J].新疆医科大学学报,2003,26(5):427-429.
[14]唐微,景冬梅,董兰,等.小鼠IL-2基因的反转录PCR克隆[J].湖北农业科学,2013,52(14):3367-3369.
[15]陈慰峰.医学免疫学[M].北京:人民卫生出版社,2004:27-33.



