陈贤明,张 森,王爱民,王子明
(陆军军医大学大坪医院野战外科研究所骨科,重庆 400042)
骨肉瘤是儿童和青年人群中最常见的原发性骨肿瘤,占原发性骨肿瘤的20%[1-2]。遗传学的改变与骨肉瘤的发生发展有着紧密的联系,因此寻找一个重要的基因治疗靶标成为了人们关注的重点。微小RNA(miRNA)是一类小非编码RNA分子,大量的研究已经证实miRNA参与了多种生物学进程,包括细胞增殖、分化、凋亡等[3-4]。近年有研究发现,miR-650在包括胃癌、肝癌、肺腺癌等多种肿瘤组织中都有着高表达,并且参与了细胞的异常增殖[5-9],提示其可能是一种潜在的促癌因子。本研究用实时荧光定量PCR的方法检测了骨肉瘤患者组织及人骨肉瘤细胞系中miR-650的表达情况,同时检测在抑制miR-650后人骨肉瘤细胞增殖情况的变化并探讨可能的机制。
1 材料与方法
1.1主要材料 骨肉瘤组织及癌旁正常组织收自本科室治疗患者,共计4例:1号病例为男性,19岁,发病于右侧股骨远端,大小约7 cm×9 cm,ⅠB期,为软骨母细胞型骨肉瘤;2号病例为男性,17岁,发病于左侧股骨远端,大小约2 cm×2 cm,ⅠA期,为骨母细胞型骨肉瘤;3号病例为女性,14岁,发病于左腓骨小头,大小约3 cm×5 cm,ⅡA期,为骨母细胞型骨肉瘤;4号病例为女性,21岁,发病于右侧股骨远端,大小约3 cm×6 cm,ⅠB期,为纤维母细胞型骨肉瘤。样本搜集在经医院伦理委员会审查通过,患者签署知情同意书后进行。人骨肉瘤细胞系MG63及健康人成骨细胞系hFOB1.19购自中国科学院典型培养物保藏委员会细胞库,RPMI 1640培养基(Gibico,美国)、转染用培养基OPTI MEMI(Gibico,美国)、胎牛血清(Gibico,美国)、Lipofectamine 2000 转染试剂(Invitrogen,美国)、细胞培养箱(Thermo,美国)、TRIzol(Invitrgen,美国)、RIPA裂解液(碧云天,江苏)、TRIzol试剂(Invitrogen,美国)、四甲基偶氮唑盐(MTT,Sigma,美国)、miRNA cDNA第一链合成试剂盒(天根公司,北京)、抗体(Santa cruz,美国)。
1.2方法
1.2.1细胞培养 MG63细胞及hFOB1.19均用含有10%胎牛血清的RPMI 1640培养基进行培养,培养条件为37 ℃、含5% CO2气体、湿度饱和的培养箱中。2~3 d换液1次。取对数生长期的细胞进行实验。
1.2.2MiR-650抑制剂及ING4 siRNA转染 采用Lipofectamine 2000试剂对MG63细胞进行转染,在转染24 h后用qPCR的方法检测MG63细胞中miR-650的表达情况。将处于对数生长期的细胞接种到6孔板中,设置阴性对照组(NC)、乱序组及miR-650抑制剂组。转染步骤根据Lipofectamine 2000试剂盒说明书进行。转染后24 h通过qPCR进行验证转染效率。MiR-650抑制剂及ING4 siRNA购自锐博生物科技有限公司(广州),miR-650抑制剂序列为5′-GTC CTG AGA GCG CTG CCT CCT-3′,ING siRNA序列为5′-GCC ACT GAG TAT ATG AGT A-3′。
1.2.3RNA提取与实时荧光定量PCR分析 收集了4例骨肉瘤患者的骨肉瘤组织及癌旁正常组织,并用qPCR的方法测定了4对组织的miR-650表达情况。同时对比了健康人成骨细胞系(hFOB 1.19)及人骨肉瘤细胞系(MG63)中miR-650的表达情况。按照TRIzol试剂说明书,提取细胞总RNA。测定A260 nm/A280 nm,以检测总RNA的浓度及纯度。根据逆转录试剂盒说明书的步骤将RNA逆转录为cDNA。用q-PCR的方法检测miR-650及ING4水平。其中miRNA-650的上游引物为:5′-AGA GGA GGC AGC GCT CT-3′,下游引物为:5′-CAG TGC GTG TCG TGG AGT-3′;内参U6的上游引物为:5′-CTC GCT TCG GCA GCA CA-3′,下游引物为:5′-AAC GCT TCA CGA ATT TGC GT-3′;ING4的上游引物为:5′-TTT CAG AGG GAG GGT CCT TT-3′,下游引物为:5′-GCC AGA GCC TAG ATG ACC TG-3′;β-actin的上游引物为:5′-AAA GAC CTG TAC GCC AAC AC-3′,下游引物为:5′-GTC ATA CTC CTG CTT GCT GAT-3′。反应条件如下:95 ℃预变性5 min;随后95 ℃ 15 s变性,59 ℃ 30 s退火,72 ℃ 30 s延伸及检测。通过Ct值及计算2-ΔΔCt得到其相对表达量。
1.2.4细胞增殖实验 将MG63细胞以每孔5×103个细胞的数量接种于96孔板中,在指定的时间点加入20 μL无菌MTT染料(5 mg/mL,Sigma,美国),于37 ℃中孵育4 h,随后移除培养基,加入150 μL二甲基亚砜,并在室温摇床上摇10 min。测量490 nm波长的A。
1.2.5Western blot检测ING4蛋白的表达 用RIPA裂解液对细胞进行裂解,刮取细胞悬液用超声处理10~15 s,在冰上裂解1 h后,12 000×g离心30 min,收集上清液。用BCA法对蛋白浓度进行测定,随后在蛋白样本中加入上样缓冲液,于沸水中煮5 min,-20 ℃保存。在Western blot实验中,用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)对蛋白样品进行分离后,将蛋白用半干转膜的方法将蛋白转移到NC膜上。用5%的脱脂奶粉进行封闭。随后加入1∶200比例稀释的ING4一抗(Santa cruz),4 ℃过夜。用TBST清洗膜3次后,用相应的荧光二抗孵育1 h。随后用Odyssey激光成像系统(LI-COR,Lincoln,美国)进行扫膜成像。结果用ING4/GAPDH的比值来表示。

2 结 果
2.1miR-650在骨肉瘤细胞系中表达升高 在骨肉瘤组织中的miR-650表达量显着高于癌旁正常组织,见图1;同时MG63细胞中miR-650的表达也显着高于hFOB 1.19细胞(1.00±0.17vs. 4.27±0.23),差异有统计学意义(P<0.05)。
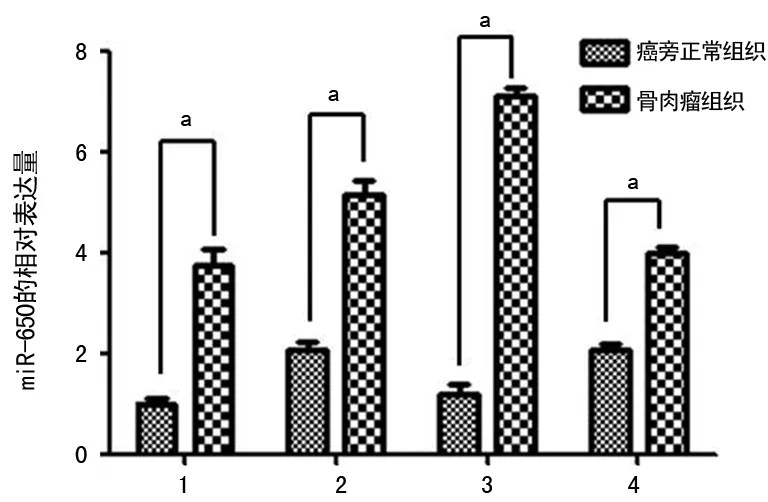
1:1号病例;2:2号病例;3:3号病例;4:4号病例;a:P<0.05
图1患者的骨肉瘤组织和癌旁组织中miR-650的表达情况
2.2miR-650抑制剂对miR-650表达的抑制效率 miR-650抑制剂组miR-650的表达量为0.32±0.14,较阴性对照组(1.00±0.15)、乱序组(1.02±0.1)显着降低且差异有统计学意义(P<0.05)。
2.3抑制miR-650后,MG63细胞增殖显着减弱 相对于乱序组和对照组,抑制miR-650后在48、72、96 h时,MG63细胞的增殖能力均显着受到抑制,且差异有统计学意义(P<0.05),见图2。
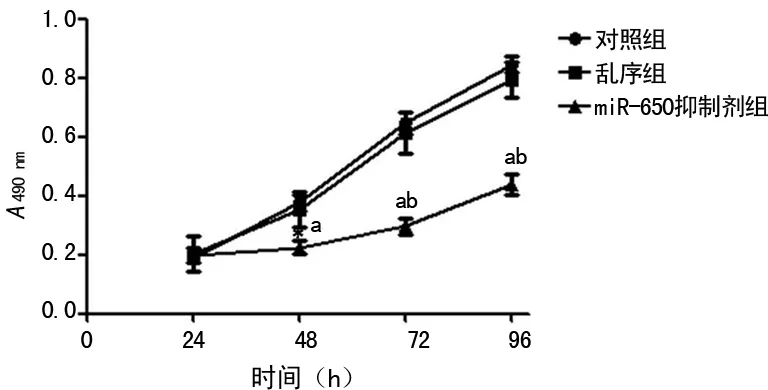
a:P<0.05,与对照组比较;b:P<0.05,与乱序组比较
图2抑制miR-650后MG63细胞的增殖情况
2.4抑制miR-650后ING4 mRNA及蛋白表达显着升高 相对于对照组和乱序组,在miR-650抑制剂组,ING4的mRNA水平和蛋白表达水平均显着升高(mRNA表达分别为1.00±0.16、1.08±0.14、5.35±0.32;蛋白表达分别为0.62±0.06、0.59±0.12、2.45±0.20),见图3。

A:抑制miR-650后ING4的mRNA表达情况;B:抑制miR-650后ING4的蛋白表达情况;a:P<0.05,与对照组比较;b:P<0.05,与乱序组比较
图3抑制miR-650后ING4的mRNA及蛋白表达情况
2.5siRNA干扰ING4 mRNA表达后,抑制miR-650后对MG63细胞增殖的抑制作用 在干扰ING4后,ING4的mRNA水平显着降低;而在干扰掉ING4后,抑制miR-650降低MG63增殖的作用显着减弱,且在72 h及96 h处差异有统计学意义(P<0.05) ,见图4。

a:P<0.05,与miR-650抑制剂组比较
图4 miR-650抑制细胞增殖的能力比较
3 讨 论
大量的研究已经证实,miRNA在肿瘤组织中的表达谱与对应正常组织有着显着的差异,并且这种差异与肿瘤的发生、发展密切相关[10-12]。miR-650 在多种肿瘤组织中都有着高表达,提示其可能是潜在的促癌因子。ZENG等[13]和ZHANG等[4]分别发现miR-650促肝癌及胃癌形成的作用与其靶向ING4有关。为了研究miR-650在骨肉瘤中是否也发挥同样的促进肿瘤细胞生成的作用,本研究对其在骨肉瘤细胞系MG63细胞的增殖情况进行了研究。在本研究中,证实了miR-650在骨肉瘤细胞系中表达较正常成骨细胞中升高,提示miR-650与骨肉瘤有着密切的联系。而随后的研究中发现抑制miR-650后可以显着降低MG63细胞的增殖,说明miR-650可能参与了骨肉瘤的发生及肿瘤组织的快速增殖。
miR-650参与了MG63细胞增殖的调节,是通过什么机制完成的呢?有研究认为miR-650可以通过抑制包括肝癌及胃癌等肿瘤细胞中的ING4发挥促肿瘤形成的作用。ING4是一种新的肿瘤抑制基因家族的一员,近年来有多项研究证实ING4在人骨肉瘤的发病过程中扮演了重要的作用。研究发现ING4能与p53相互作用并增强其功能。而p53是一种已经被广泛研究的抑癌基因,它可以通过调节细胞凋亡防止癌变,同时协助修复受损DNA,所以增强p53功能对肿瘤抑制有着重要的意义。此外, ING4还能直接阻断NF-κB信号通路,从另一个途径抑制肿瘤的生成与侵袭。ING4可能通过多个通路对肿瘤的发生及转移发挥抑制作用,因此也成了抑制肿瘤的热门靶点。miR-650已经在多项研究中证实可以调节ING4的表达,但在骨肉瘤细胞中尚未有研究,因此,为了探索miR-650促进MG63细胞促癌作用是否与ING4有关,本研究检测了在抑制miR-650后ING4的mRNA和蛋白的表达情况。结果证实抑制miR-650后,MG63细胞中ING4的mRNA和蛋白的表达水平都显着升高,提示miR-650可以在转录和翻译水平降低ING4的表达。ING4是否是介导了miR-650调节MG63细胞增殖?为了证实这个问题,本研究用siRNA抑制了ING4的表达,随后观察了miR-650抑制剂对MG63细胞增殖的抑制作用。结果发现抑制ING4表达后,miR-650抑制剂对MG63细胞增殖的抑制作用显着减弱,提示ING4在miR-650对MG63细胞增殖的调节中发挥着重要的作用。本研究结果提示miR-650可能通过ING4调节骨肉瘤细胞的增殖,为骨肉瘤的治疗提供了新的靶点和思路。
[1]MARAIS L C,BERTIE J,RODSETH R,et al.Pre-treatment serum lactate dehydrogenase and alkaline phosphatase as predictors of metastases in extremity osteosarcoma[J].J Bone Oncol,2015,4(3):80-84.
[2]OTTAVIANI G,JAFFE N.The epidemiology of osteosarcoma[J].Cancer Treat Res,2009,152:3-13.
[3]ZHAO Y,SRIVASTAVA D.A developmental view of microRNA function[J].Trends Biochem Sci,2007,32(4):189-197.
[4]ZHANG X,ZHU W,ZHANG J,et al.MicroRNA-650 targets ING4 to promote gastric cancer tumorigenicity[J].Biochem Biophys Res Commun,2010,395(2):275-280.
[5]FAROOQI A A,QURESHI M Z,COSKUNPINAR E,et al.MiR-421,miR-155 and miR-650:emerging trends of regulation of cancer and apoptosis[J].Asian Pac J Cancer Prev,2014,15(5):1909-1912.
[6]HUANG J Y,CUI S Y,CHEN Y T,et al.MicroRNA-650 was a prognostic factor in human lung adenocarcinoma and confers the docetaxel chemoresistance of lung adenocarcinoma cells via regulating Bcl-2/Bax expression[J].PLoS One,2013,8(8):e72615.
[7]TANG J F,YU Z H,LIU T,et al.Five miRNAs as novel diagnostic biomarker candidates for primary nasopharyngeal carcinoma[J].Asian Pac J Cancer Prev,2014,15(18):7575-7581.
[8]WU H,HAAG D,MULEY T,et al.Tumor-microenvironment interactions studied by zonal transcriptional profiling of squamous cell lung carcinoma[J].Genes Chromosomes Cancer,2013,52(3):250-264.
[9]ZUO Z H,YU Y P,DING Y,et al.Oncogenic Activity of miR-650 in Prostate Cancer Is Mediated by Suppression of CSR1 Expression[J].Am J Pathol,2015,185(7):1991-1999.
[10]BRONTE F,BRONTE G,FANALE D,et al.HepatomiRNoma:The proposal of a new network of targets for diagnosis,prognosis and therapy in hepatocellular carcinoma[J].Crit Rev Oncol Hematol,2016,97:312-321.
[11]THOMAS J,OHTSUKA M,PICHLER M,et al.MicroRNAs:Clinical Relevance in Colorectal Cancer[J].Int J Mol Sci,2015,16(12):28063-28076.
[12]NAIDU S,GAROFALO M.microRNAs:An emerging paradigm in lung cancer chemoresistance[J].Front Med(Lausanne),2015,2:77.
[13]ZENG Z L,LI F J,GAO F,et al.Upregulation of miR-650 is correlated with down-regulation of ING4 and progression of hepatocellular carcinoma[J].J Surg Oncol,2013,107(2):105-110.



