唐一锋,石 蓓,王冬梅,沈长银
(1.贵州航天医院心内科,贵州遵义 563003,2.遵义医学院附属医院心内科,贵州遵义 563099)
随着生活水平的提高和经济的发展,心血管疾病已成为损害人类健康的重要慢性非传染性疾病,给社会和家庭带来沉重的负担。既往研究报道,干细胞移植的能够成为改善心肌梗死预后的新途径,其中,骨髓间充质干细胞(MSCs)移植治疗能够有效地减少梗死区面积,促进交界区的微血管形成,有效提高心肌梗死后的心脏功能。本课题组在前期研究中同样发现了MSCs移植的治疗方法对于急性心肌梗死的预后存在有益作用[1-2]。高迁移率族蛋白1(HMGB-1)是细胞染色体结合蛋白家族的成员,具有引导树突状细胞和平滑肌细胞进行迁移的作用,同时也是血管原性和心脏性干/祖细胞的分化增强因子[3-5]。本研究通过建立雄性SD大鼠急性心肌梗死的生物学模型,分别对实验大鼠注射HMGB-1及HMGB-1拮抗剂,同时联合MSCs移植治疗手段,进而观察其梗死后的心肌组织附近局部新生血管的密度、心肌梗死的面积及心脏功能的变化情况,并测定大鼠血清血管生成因子和相关炎症细胞因子水平的变化进而揭示其内在相关的作用机制,从而探究外源性HMGB-1对梗死区域的心肌组织的局部微循环环境、移植的MSCs存活状态及新生血管形成的作用。本研究旨在探究目前该领域存在的移植干细胞存活率较低,移植归巢梗死区干细胞数量少等关键难题的解决方案。
1 材料与方法
1.1材料 干细胞培养选取的是体质量为100~150 g的雄性3周龄SD大鼠;心肌梗死生物学模型建立则采用的是体质量为200~250 g的2~3月龄的雄性SD大鼠。将144只SD大鼠分入健康对照组、模型对照组、MSCs移植组、HMGB-1注射组、HMGB-1注射+MSCs移植组、HMGB-1 BoxA注射+MSCs移植组等6个不同处理组,每组包含24只实验大鼠。在术后第3、7、28天时对大鼠的心脏功能和血清炎症相关细胞因子的水平进行检测,取其组织标本进行病理学检测分析。本实验中采用的雄性SD大鼠全部来自陆军军医大学大坪医院实验动物中心,通过检疫,全部符合国家实验动物标准[证书号:SCXK(渝)2012-0005]。
1.2方法
1.2.1大鼠MSCs体外培养和鉴定 取100~150 g 3周龄的SD实验大鼠,采用无菌分离的方法对双侧股骨、胫骨进行剥离提取,并通过贴壁离心的方法培育骨髓间充质原代细胞,本研究中选取的是第3~4代干细胞进行操作。采用流式细胞仪对MSCs表面标记物进行检测鉴定。
1.2.2大鼠心肌梗死模型的建立 10%浓度的水合氯醛溶液按照3 mL/kg体质量水平用于腹腔的麻醉,同时进行心电图的监测,连通小动物呼吸机,给予正压通气,呼吸比为1∶3,潮气量设为3 mL/100 g体质量,呼吸频率为100次/分钟。于大鼠胸骨左缘的3~4肋间靠近下一肋骨的上缘打开胸腔,按照左心耳的根部和肺动脉的圆锥交叉点下方约2 mm的位置进行缝扎,并用5-0的缝合线对左冠状动脉(后简称冠脉)前降支进行结扎,观察到结扎冠脉供血区域心肌缺血苍白且室壁局部运动减弱,监测心电图见J点明显抬高则提示心肌梗死模型已成功建立。
1.2.3各组实验动物处理方式 模型对照组:结扎前降支后心肌内注射磷酸盐缓冲液(PBS)150 μL;MSCs移植组:沿冠脉前降支走形心肌内两点注射1.0×106MSCs 150 μL;HMGB-1注射组:在结扎左前降支后,于前后腹膜内各注射1次100 ng HMGB-1(10 μg/mL);HMGB-1注射+MSCs移植组:在结扎左前降支后,于前后腹膜内各注射1次100 ng HMGB-1(10 μg/mL)并沿冠脉前降支走形的心肌内两点注射1.0×106MSCs 150 μL;HMGB-1 BoxA注射+MSCs移植组:在结扎前降支后沿冠脉前降支后,于心肌内两点注射1.0×106MSCs 150 μL同时在腹膜内注射HMGB-1 BoxA 400 μg。然后分别于第3、7和28天时处死各组实验大鼠,从而保证每个时间点各个实验组有6只大鼠。
1.2.4实验动物取材 各组动物于各时间点予10%水合氯醛按3 mL/kg体质量腹腔注射麻醉。剪开胸腔并剥离心脏,采集下腔静脉血约4~5 mL于采血管中,室温下静置1.5 h后,在4 ℃低温离心机条件下进行离心,采用3 000 r/min离心速度,离心15 min,取出血清,放于-80 ℃冰箱进行保存。用10%浓度的氯化钾溶液(3 mL/kg)通过下腔静脉注射,使心脏停搏于舒张期,取出心脏,观察各组心脏外观并进行拍照。切取包含心肌的梗死区域的横断面。其中第28天的部分大鼠心脏置于浓度为4%的多聚甲醛溶液进行固定,24 h后进行石蜡包埋切片。
1.2.5心肌组织苏木精-伊红(HE)染色和Masson染色 染色过程均按照南京建成生物工程研究所HE及Masson染色试剂盒说明书操作。
1.2.6超声心动图测定心功能 术后第28天,经胸壁测量3个连续心动周期内的左心室射血分数(LVEF)、左心室收缩末期内径(LVDS)、左心室舒张末期内径(LVDD)及短轴缩短率(LVFS)的结果。取3次结果均值纳入分析。
1.2.72,3,5-氯化苯基四氮唑(TTC)染色测定心肌梗死面积 大鼠心肌梗死后的第28天,行TTC染色测定心肌梗死面积。通过下腔静脉内注射1.5 mL浓度为1%的TTC染液,5 min后注射浓度为10%的氯化钾溶液造成心脏停搏。后取出心脏,用生理盐水清洗,纱布吸干水分,并置于-80 ℃冰箱冻存10 min后,从心尖向心底部至心脏表面结扎点之间切取5~6个横断面,每片厚约1 mm。根据横断面观察心肌染色情况,必要时将组织置于浓度为1%的TTC染液中,在室温下重复染色5~8 min,用多聚甲醛固定15 min,纱布吸水后拍照。
1.2.8免疫组织化学检测新生微血管 术后第28天时对各组大鼠进行处死处理,取材石蜡切片,免疫组织化学对CD31阳性的细胞和微血管进行计数。一抗:兔抗大鼠CD31(1∶50,1∶100,1∶200);二抗:生物素化羊抗兔免疫球蛋白G(IgG)。本研究是根据Weidner微血管方法对上述组织细胞进行计数的。
1.2.9细胞因子水平变化检测 通过酶联免疫吸附法(ELISA)检测术后第3、7和28天时血清中Toll样受体4(TLR4)、血管内皮生长因子(VEGF)、白介素-6(IL-6)、HMGB-1,核转录因子kappa B(NF-κb)、肿瘤坏死因子α(TNF-α)的水平。

2 结 果
2.1MSCs的培养、鉴定和标记 将MSCs培育至第3~4代后,选出生长状态较为良好的干细胞(共6.0×106),CD45、CD29、CD90的阳性率分别为2.7%、99.1%和91.6%,该结果提示培养出的细胞为MSCs。选用第3代生长状态较好的MSCs,予4′,6-二脒基-2-苯基吲哚(DAPI)染色,观察到MSCs细胞染色成功,细胞核蓝色荧光表现。在计数时将高倍镜调制为400倍,选取3个高倍视野进行计数,以镜下平均数计算标记率为94%,见图1。

A:培养第 4代MSCs(×100);B:荧光显微镜下显示DAPI标记的细胞核为蓝色(×100)
图1 DAPI标记MSCs
2.2大鼠急性心肌梗死模型评估 大鼠健康心肌细胞排列整齐有序,形态健康(图2A、B)。成功建模后28 d,取心脏组织作石蜡切片HE、Masson染色,见肌细胞排列紊乱,结构消失,核溶解,被大量纤维组织所替代,并瘢痕组织形成(图2C、F)。病理改变证实心肌梗死建模成功。

A:大鼠健康心肌(HE染色,×200);B:大鼠健康心肌(Masson染色,×200);C:梗死心肌(HE染色,×100);D:梗死心肌(Masson染色,×100);E:梗死心肌(HE染色,×200);F:梗死心肌(Masson染色,×200)
图2健康大鼠心肌及大鼠心肌梗死模型HE及
Masson染色图片
2.3心功能测定 心肌梗死术后第28天进行心脏彩超测定。结果显示,与模型对照组相比,MSCs移植组、HMGB-1注射组、HMGB-1注射+MSCs移植组及HMGB-1 BoxA注射+MSCs移植组LVDD、LVDS水平明显降低,LVFS、LVEF水平明显升高(P<0.05),其中,HMGB-1注射+MSCs移植组心功能改善最好,见表1。
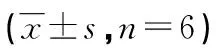
表1 心肌梗死术后第28天各组心脏超声检测结果
a:P<0.05,与模型对照组比较;b:P<0.05,与HMGB-1注射+MSCs移植组比较
2.4心肌梗死面积测定及新生血管检测 模型对照组梗死面积占左室面积(35.23±4.20)%;与模型对照组相比,MSCs移植组[(24.58±1.50)%]、HMGB-1注射组[(28.11±2.10)%]、HMGB-1注射+MSCs移植组[(21.23±1.80)%]、HMGB-1 BoxA注射+MSCs移植组[(27.74±1.30)%]梗死的面积占左室的面积均较小,其中HMGB-1注射+MSCs移植组的梗死面积与MSCs移植组、HMGB-1注射组、HMGB-1 BoxA注射+MSCs移植组梗死面积比较,明显缩小(P<0.05),见图3。

A:正常对照组;B:模型对照组;C:MSCs移植组;D:HMGB1注射组;E:HMGB1注射+MSCs移植组;F:HMGB1 BoxA注射+MSCs移植组。
图3心肌梗死模型建立后28 d心肌TTC染色图
另外,与健康对照组微血管的数量(2.12±0.18)相比,模型对照组的梗死区及梗死周围区的新生微血管显着增加(6.38±0.25),差异有统计学意义(P<0.05);MSCs移植组、HMGB-1注射组、HMGB-1注射+MSCs移植组、HMGB-1 BoxA注射+MSCs移植组的梗死区及梗死交界区的微血管数量分别为12.54±1.50、9.16±1.10、13.95±1.80、11.55±1.10。HMGB-1注射+MSCs移植组较其他组明显增加(P<0.05)。
2.5血清各细胞因子水平变化情况 模型对照组、MSCs移植组的血清HMGB-1水平在术后均呈升高趋势,MSCs移植组的血清HMGB-1水平明显高于健康对照组,而低于模型对照组(P<0.05),见表2。除健康对照组外其余各组的血清VEGF水平在术后均呈升高趋势。HMGB-1注射+MSCs移植组VEGF水平最高(P<0.05)。除健康对照组外,其他各组大鼠的血清TLR4、IL-6、NF-κb、TNF-α水平在术后均呈现升高趋势。HMGB-1注射+MSCs移植组与模型组与其他各组比较差异有统计学意义(P<0.05)。第3天和第7天,除健康对照组其余各组的TLR4水平均明显高于健康对照组(P<0.05)。第3天HMGB-1注射组IL-6、NF-κb、TNF-α水平高于模型对照组,第7天MSCs移植组、HMGB-1注射组、HMGB-1注射+MSCs移植组、HMGB-1 BoxA注射+MSCs移植组IL-6、NF-κb、TNF-α水平低于模型对照组(P<0.05),见表3。

表2 不同时间点各组血清HMGB-1水平比较
a:P<0.05,与MSCs移植组比较

表3 不同时间点各血清细胞因子水平

续表3 不同时间点各血清细胞因子水平
a:P<0.05,与健康对照组比较;b:P<0.05,与HMGB-1注射+MSCs移植组比较
3 讨 论
近年采用MSCs移植治疗心肌梗死是新的研究靶点,既往研究表明,MSCs主要可以分化为心肌样细胞[6-8],并通过血管分化和细胞融合作用促进血管生长[3]。除此之外,MSCs还具有一定旁分泌作用,主要包括抗凋亡、促增殖分化、促血管生成、免疫调节、抗疤痕、化学趋化等作用[4,9]。因此,MSCs成为了心血管疾病治疗领域的重要种子细胞之一,其应用前景比较广阔。
本研究结果表明,MSCs移植组与模型对照组相比,可以明显改善心肌梗死后心脏的受损程度。MSCs移植组的抗炎因子的表达水平升高、促炎因子的表达水平降低,均说明MSCs在急性心肌梗死后梗死区及梗死交界区的恢复过程中发挥了减轻免疫炎性反应、促进修复和改善心室重塑的保护作用。因此,提高移植细胞的生物学效应对改善干细胞移植治疗心肌梗死方法的临床预后具有关键作用,后续研究应在这一领域进行深入的探究。
在心肌梗死的病理生理过程中,HMGB-1可能是促进早期炎性反应及参与后期组织修复的重要因素[10-13]。本课题组前期体外研究结果提示,MSCs的细胞质和细胞核中分别存在TLR4和RAGE受体,HMGB-1可以促进MSCs分泌VEGF和IL-10,分泌量均与HMGB-1的剂量和时间明显相关[14]。既往研究表明,HMGB-1与MSCs细胞内HMGB-1受体的结合,可能是MSCs增殖及旁分泌作用得到促进的重要因素[15]。综上,HMGB-1可能是通过作用于MSCs表面HMGB-1受体,进而协同MSCs发挥改善心功能、促进心室重塑的功能。
值得注意的是,在心肌梗死病理生理转归过程中,是HMGB-1产生的促炎症级联反应[15-16]导致心肌组织的损伤加重,还是其作用于MSCs受体,促进免疫和炎症细胞迁移及旁分泌而改善免疫炎性反应从而帮助心肌修复,目前仍存在争论,有待接下来的研究进一步揭示。AIKAWA等[5]的研究发现,HMGB-1还可以通过加强c-kit+细胞的增殖与分化促进心肌梗死后的心室重塑。另外也有研究表明HMGB-1可以作用于人心脏成纤维细胞表面的RAGE受体促进生长因子如VEGF、IL-10等的表达,改善心肌细胞的修复[17-18]。因此,MSCs移植后在心功能改善中何种机制占主导作用,以及TLRs及RAGE信号通路如何调节MSCs趋化作用和旁分泌诱导作用等机制还需进一步研究。
综上,本研究发现,较单MSCs移植治疗或单HMGB-1注射治疗方法,HMGB-1联合MSCs移植治疗对大鼠急性心肌梗死后心功能改善、心肌梗死面积减少和局部新生血管生成等更为有益,其机制可能是通过促进生长因子如VEGF、TLR4等细胞因子水平,同时降低IL-6、TNF-α、NF-κb等促炎因子水平来介导的。
参考文献
[1]石蓓,刘志江,赵然尊,等.骨髓间充质干细胞移植对心肌梗死后心脏功能及损伤血管再狭窄的影响[J].中华医学杂志,2011,91(32):2269-2273.
[2]龙仙萍,邓文文,赵然尊,等.干扰Nrf2基因后骨髓间充质干细胞移植对大鼠心肌梗死后心肌凋亡的影响[J].第三军医大学学报,2015,37(13):1319-1322.
[3]LIN F,ZHANG W,XUE D,et al.Signaling pathways involved in the effects of HMGB-1 on mesenchymal stem cell migration and osteoblastic differentiation[J].Int J Mol Med,2016,37(3):789-797.
[4]XIE H L,ZHANG Y,HUANG Y Z,et al.Regulation of high mobility group box 1 and hypoxia in the migration of mesenchymal stem cells[J].Cell Biol Int,2014,38(7):892-897.
[5]AIKAWA E,FIJITA R,KIKUCHI Y,et al.Systemic high-mobility group box 1 administration suppresses skin inflammation by inducing an accumulation of PDGFRα(+) mesenchymal cells from bone marrow[J].Sci Rep,2015(5):11008.
[6]VOGEL S,BORGER V,PETERS C,et al.Necrotic cell-derived high mobility group box 1 attracts antigen-presenting cells but inhibits hepatocyte growth factor-mediated tropism of mesenchymal stem cells for apoptotic cell death.[J].Cell Death Differ,2015,22(7):1219-1230.
[7]XIE H L,ZHANG Y,HUANG Y Z,et al.Regulation of high mobility group box 1 and hypoxia in the migration of mesenchymal stem cells[J].Cell Biol Int,2014,38(7):892-897.
[8]HERRMANN J L,ABARBANELL A M,WEIL B R,et al.Postinfarct intramyocardial injection of mesenchymal stem cells pretreated with TGF-alpha improves acute myocardial function[J].Am J Physiol Regul Integr Comp Physiol,2010,299(1):R371-378.
[9]SITTICHOKECHAIWUT A,EDWARDS J H,SCUTT A M,et al.Short bouts of mechanical loading are as effective as dexamethasone at inducing matrix production by human bone marrow mesenchymal stem cell[J].Eur Cell Mater,2010(20):45-57.
[10]KIKUCHI H,YAGI H,HASEGAWA H,et al.Therapeutic potential of transgenic mesenchymal stem cells engineered to mediate anti-high mobility group box 1 activity:targeting of colon cancer[J].J Surg Res,2014,190(1):134-143.
[11]VOGEL S,CHATTERJEE M,METZGER K,et al.Activated platelets interfere with recruitment of mesenchymal stem cells to apoptotic cardiac cells via high mobility group box 1/Toll-like receptor 4-mediated down-regulation of hepatocyte growth factor receptor MET[J].J Biol Chem,2014,289(16):11068-11082.
[12]LIN Y,CHEN L,LI W,et al.Role of high-mobility group box-1 in myocardial ischemia/reperfusion injury and the effect of ethyl pyruvate[J].Exp Ther Med,2015,9(4):1537-1541.
[13]XU H,WANDERSEE N J,GUO Y,et al.Sickle cell disease increases high mobility group box 1:a novel mechanism of inflammation[J].Blood,2014,124(26):3978-3981.
[14]王晓武,张卫达,罗林,等.大鼠心肌梗死后心肌高迁移率族蛋白1的时程变化[J].南方医科大学学报,2008,28(9):1688-1690.
[15]WANG J,HU X,XIE J,et al.Beta-1-adrenergic receptors mediate Nrf2-HO-1-HMGB-1 axis regulation to attenuate hypoxia/reoxygenation-induced cardiomyocytes injury in vitro[J].Cell Physiol Biochem,2015,35(2):767-777.
[16]WANG J,YANG H,HU X,et al.Dobutamine-mediated heme oxygenase-1 induction via PI3K and p38 MAPK inhibits high mobility group box 1 protein release and attenuates rat myocardial ischemia/reperfusion injury in vivo[J].J Surg Res,2013,183(2):509-516.
[17]KWAK M S,LIM M,LEE Y J,et al.HMGB-1 binds to lipoteichoic acid and enhances TNF-α and IL-6 production through HMGB-1-mediated transfer of lipoteichoic acid to CD14 and TLR2[J].J Innate Immun,2015,7(4):405-416.
[18]YAO H C,ZHOU M,ZHOU Y H,et al.Intravenous high mobility group box 1 upregulates the expression of HIF-1α in the myocardium via a protein kinase B-dependent pathway in rats following acute myocardial ischemia[J].Mol Med Rep,2016,13(2):1211-1219.



