周 珊,刘彦婷,赵飞鹏,冯华君,涂晓敏,杨金亮,梁传余,覃 纲△
(1.西南医科大学附属医院耳鼻咽喉头颈外科,四川泸州 646000;2.四川大学生物治疗国家重点实验室,成都 610041;3.四川大学华西医院耳鼻咽喉头颈外科,成都 610041)
鼻咽癌(nasopharyngeal carcinoma,NPC)是一种头颈部常见的恶性肿瘤,多起源于鼻咽黏膜的上皮,在西方国家发病率极低(0.5/100 000),但高发于我国南方(30/100 000)[1]。经以放疗为主的综合治疗,早期NPC患者5年生存率可达90%,而晚期NPC患者的5年生存率仅维持在70%左右,甚至更低[2]。因此,研究NPC的发病机制和寻找新的治疗靶点具有重要的临床意义。免疫球蛋白(immunoglobulin,Ig)是一类重要的免疫球蛋白分子,经典的免疫学理论认为仅由B淋巴细胞产生。近年的研究发现,上皮来源的组织和细胞系也可以表达Ig,如IgA、IgG和IgM[3-4]。研究证实,IgM在多种人上皮来源的肿瘤细胞中高表达,可能参与肿瘤免疫反应[5],在肝癌、前列腺癌和卵巢癌的筛选和诊断方面具有生物标志物的潜力[6-8]。然而,IgM在NPC中的表达和功能尚不明确。本研究旨在探讨抗人IgM抗体对NPC HNE-1细胞增殖、凋亡和细胞周期的影响,并构建裸鼠移植瘤模型进行验证,为NPC的研究提供新的思路。
1 材料与方法
1.1材料与试剂 人鼻咽癌HNE-1细胞系由四川大学华西医院实验室提供;RPMI-1640和胎牛血清(FBS)购自美国Thermo公司;羊抗人IgM抗体、羊抗IgG纯化免疫球蛋白和碘化丙啶(PI)均购自美国Sigma公司;3-(4,5-二甲基吡啶-2-基)-5-(3-羧基甲氧基苯基)-2-(4-磺苯基)-2H-四唑(MTS)实验试剂盒和脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TUNEL)检测试剂盒均购自美国Promega公司;细胞周期检测试剂盒购自南京吉凯科技有限公司;兔抗人gp96多克隆抗体购自北京博奥森生物技术有限公司;兔抗人IgM多克隆抗体、生物素化羊抗IgG抗体、二氨基联苯胺(DAB)显色试剂盒均购自北京中杉金桥生物技术有限公司;免疫组织化学SP试剂盒购自美国Santa Cruz公司;BALB/c-nu裸鼠(雌性)购自成都达硕实验动物有限公司。
1.2方法
1.2.1细胞培养 HNE-1细胞在37 ℃、5% CO2的饱和湿度孵箱中采用含10% FBS+1%青链霉素的RPMI-1640培养基培养。
1.2.2细胞增殖检测 严格按照试剂盒说明书进行。浓度梯度检测:取对数生长期的细胞,以2×103个/孔接种于96孔板,培养24 h后,弃培养液,分3组加药:实验组(100 μL含不同浓度羊抗人IgM抗体+含2.5% FBS的RMPI-1640)、IgG/磷酸盐缓冲液(PBS)对照组(100 μL含相同浓度羊抗IgG或PBS+含2.5% FBS的RMPI-1640)、空白对照组(100 μL 含2.5% FBS的RMPI-1640),羊抗人IgM抗体、羊抗IgG和PBS设置的浓度梯度均为12.5、25.0、50.0、100.0、200.0、400.0 μg/mL,设置校正孔,未接种细胞,加入100 μL含2.5% FBS的RMPI-1640校正吸光度值(A值),培养3 d后,加入20 μL MTS,酶标仪测490 nm处A值(A490值)。时间梯度检测:种板、分组同前,培养24 h后,弃培养液,分3组加药,每隔24 h加入20 μL MTS,酶标仪测A490值,连续测6 d。空白对照组调零,每组设3个复孔,重复3次;细胞增殖抑制率(%)=(1-处理组A490/空白对照组A490)×100%。
1.2.3细胞凋亡检测 流式细胞仪检测:将细胞以2×105个/孔接种于6孔板中,含10% FBS的RPMI-1640培养24 h,弃上清液;分3组,对应分别加1 mL含已调整浓度为200 μg/mL的羊抗人IgM抗体、羊抗IgG或含有相同体积的PBS的2.5% FBS的RMPI-1640,继续培养72 h;收集每孔细胞制成含(1~5)×106个细胞的单细胞悬液,离心,70%乙醇固定,加1 mL PI染液,调整细胞密度为5×105个/毫升,上机检测及铺片拍照;细胞凋亡率(%)=(凋亡细胞总数/总细胞数)×100%。TUNEL试剂盒检测:按试剂盒说明书进行,将细胞以2×103个/孔接种于96孔板中培养;阴性对照组以1 μL双蒸水代替rTdT酶,阳性对照组以DnaseⅠ预处理细胞,通过荧光显微镜观察拍照,将细胞核呈强蓝色荧光的细胞作为阳性细胞;细胞凋亡指数(%)=(一个视野的凋亡细胞数/通过视野的细胞总数)×100%。
1.2.4细胞周期检测 按照周期试剂盒说明书处理细胞,调整细胞密度为5×105个/毫升,流式细胞仪检测红色荧光,用Multicycle软件分析。
1.2.5体内移植瘤实验 将1×106个HNE-1细胞皮下接种于雌性BALB/c-nu裸鼠(4~5周龄)的右背腹侧;建模成功后,随机分成实验组、IgG对照组和PBS对照组,分别于腹腔注射等量的羊抗人IgM抗体、羊抗IgG及PBS,每3天注射1次,每只裸鼠1.5 mg,共5次;每4天测肿瘤体积;在第5次给药完成后1周处死裸鼠,剥离移植瘤,称重。瘤体体积=(D×d2)/2,D为最长径,d为最短径。动物实验得到西南医科大学动物实验伦理委员会的批准,批准号为201605045。

A:培养72 h后,3组细胞在不同浓度下的A490值曲线;B:培养72 h后,3组细胞在不同浓度下的增殖抑制率曲线;C:3组细胞在不同时间下的A490值曲线;D:3组细胞在不同时间下的增殖抑制率曲线;*:P<0.05,与PBS对照组、IgG对照组比较
图1抗人IgM抗体抑制HNE-1细胞增殖

A:3组细胞PI染色后的凋亡形态观察(×200);B:流式细胞术测3组细胞凋亡的柱形图;C:3组细胞TUNEL染色后的凋亡形态观察(×200);D:TUNEL染色后3组细胞凋亡的柱形图;*:P<0.05,#:P<0.01,与实验组比较
图2抗人IgM抗体诱导HNE-1细胞凋亡
1.2.6免疫组织化学检测 将石蜡包埋的移植瘤组织4 μm切片,按免疫组织化学SP试剂盒说明书进行;双盲法观察每张切片的阳性表达,细胞质呈黄棕色为阳性表达;每张切片选5个视野,显微镜(×400倍)下拍照,Image Pro-Plus 6.0图像分析软件检测平均光密度(MOD)值。
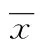
2 结 果
2.1抗人IgM抗体对HNE-1细胞增殖的影响 与IgG和PBS对照组比较,不同浓度抗人IgM抗体培养HNE-1细胞72 h后,随浓度的增加A490值减小,增殖抑制率增加,从浓度为50 μg/mL开始,A490值和增殖抑制率出现明显差异,见图1A、B。含100 μg/mL浓度的抗人IgM抗体培养HNE-1细胞6 d,结果显示:A490值和增殖抑制率随时间的增加而增加;与IgG和PBS对照组比较,实验组从第3天出现明显抑制,见图1C、D。
2.2抗人IgM抗体对HNE-1细胞凋亡的影响 流式细胞仪检测结果:浓度为200 μg/mL的抗人IgM抗体作用于实验组HNE-1细胞,培养72 h后显示,实验组的凋亡率[(31.10±2.81)%]明显高于IgG对照组[(6.56±1.14)%]和PBS对照组[(7.79±1.21)%],差异有统计学意义(F=161.667 3,P<0.05),见图2B;并且用PI染色也可观察到类似结果,见图2A。TUNEL检测结果:HNE-1细胞经含抗人IgM抗体培养基培养72 h后,细胞凋亡明显,呈较强的绿色荧光,见图2C;实验组凋亡指数[(26.19±2.17)%]明显高于IgG对照组[(4.18±0.27)%]和PBS对照组[(3.38±0.77)%],差异有统计学意义(F=281.098 9,P<0.01),见图2D。
2.3抗人IgM抗体对HNE-1细胞周期的影响 流式细胞检测结果显示,与IgG对照组和PBS对照组比较,实验组HNE-1细胞G1期细胞百分比减少、S期细胞百分比增加,差异有统计学意义(P<0.05),见图3。
*:P<0.05,与实验组比较
图3流式细胞仪检测HNE-1细胞周期分布
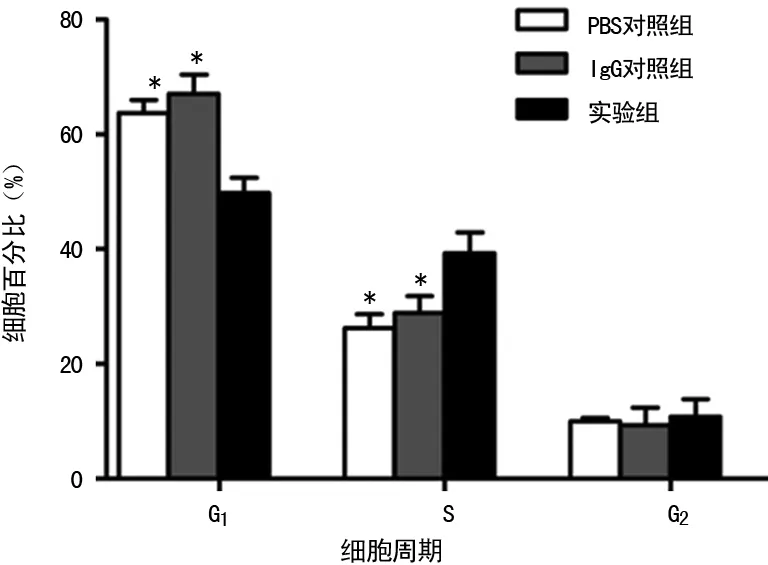
2.4抗人IgM抗体对移植瘤的影响 裸鼠皮下接种HNE-1细胞,成功构建移植瘤模型,分3组(每组5只),3组裸鼠在实验期间均无死亡。实验结果显示:腹腔注射药物结束后1周,实验组的平均瘤体体积[(26.73±16.51)mm3]明显低于IgG对照组[(204.97±151.88)mm3]和PBS对照组[(230.16±167.78)mm3],差异有统计学意义(P<0.05);实验组的瘤体平均质量[(0.09±0.07)g]明显低于IgG对照组[(0.35±0.10)g]和PBS对照组[(0.38±0.08)g],差异有统计学意义(P<0.05),见图4。相对于IgG对照组和PBS对照组,实验组的瘤体质量抑瘤率分别为74.29%和76.32%。
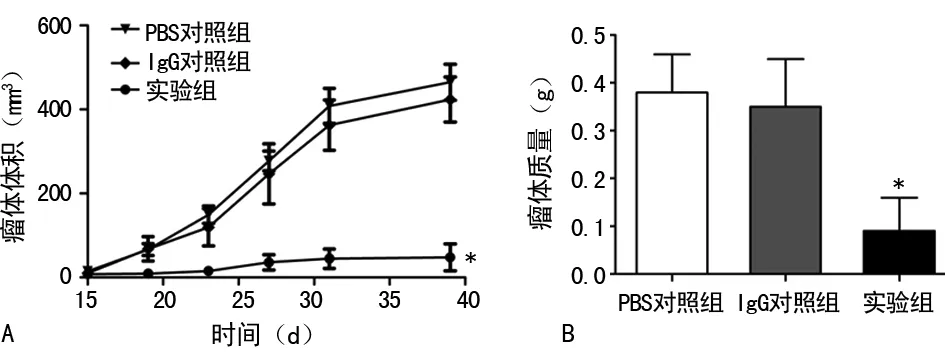
A:瘤体体积;B:瘤体质量;*:P<0.05,与PBS对照组、IgG对照组比较
图4裸鼠移植生长情况
2.5移植瘤中IgM与糖蛋白96(gp96)的表达 将HNE-1移植瘤组织切片行免疫组织化学染色,结果显示:IgM蛋白和gp96蛋白主要表达于细胞质中,呈棕黄色,见图5;实验组的IgMMOD值(0.01±0.01)明显低于IgG对照组(0.06±0.03)和PBS对照组(0.05±0.03),差异有统计学意义(P<0.05);同样,实验组的gp96MOD值(0.05±0.01)明显低于IgG组(0.10±0.03)和PBS对照组(0.11±0.02),差异有统计学意义(P<0.05)。
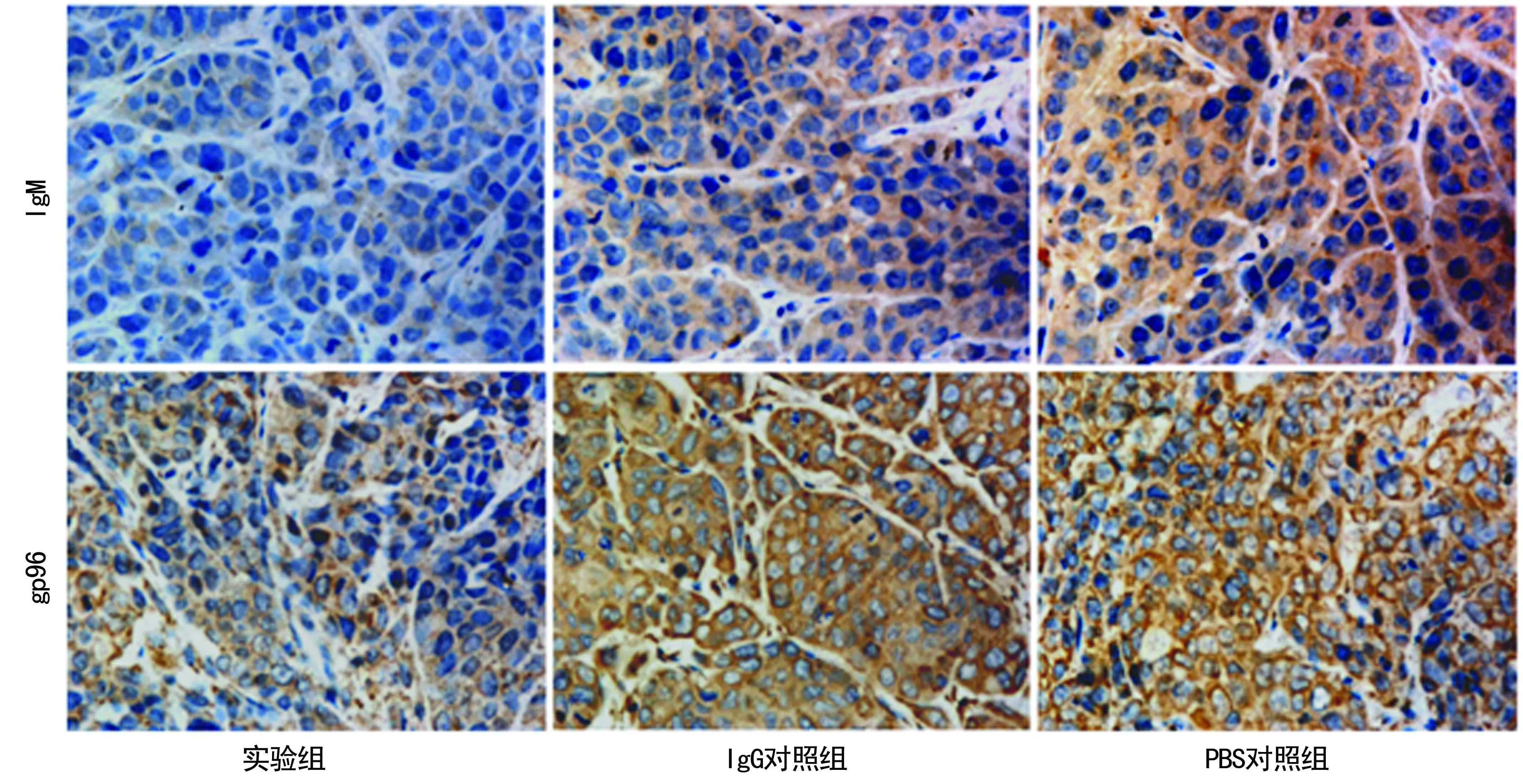
图5 免疫组织化学检测瘤体中IgM和gp96蛋白的表达(×400)
3 讨 论
目前,上皮来源的恶性肿瘤组织和细胞中Ig的生物学活性和潜在机制已成为肿瘤研究的热点之一。如ZHENG等[3]研究发现,人上皮肿瘤细胞衍生的IgA轻链可以诱导S期增加,促进细胞生长。尿道上皮肿瘤中IgG的高表达可促进细胞增殖,抑制细胞凋亡;抗IgG抗体可诱导其细胞凋亡,IgG也可抑制胰腺癌细胞凋亡,促进肿瘤生长[9]。QIU等[10]证实了肿瘤细胞分泌的IgG是细胞生存和生长所必需的,利用特异性羊抗IgG抗体可诱导细胞凋亡、抑制细胞增殖、抑制裸鼠移植瘤的生长,提出肿瘤来源的IgG能促进肿瘤细胞的生长。最近,观察到含特异性CDR3片段的反义重组载体能够抑制结肠癌HT-29细胞中Ig表达,诱导细胞凋亡,成功地抑制肿瘤细胞的增殖,认为肿瘤来源的Ig能够促进细胞增殖及生长,即肿瘤细胞衍生的Ig具有生长因子样活性[11]。
同样,本实验结果也揭示了抗人IgM抗体可能具有抑制HNE-1细胞增殖和生长的作用,并且抗人IgM抗体能有效地诱导HNE-1细胞凋亡。ZHENG等[3]发现抗人Igα单克隆抗体封闭肿瘤细胞Ig的功能,抑制CNE-1和Hela细胞的生长活性,随后进一步证实Igα能够增加其恶性增殖能力,而且发现肿瘤来源的Igα可促进细胞周期进入S期。本研究结果显示,抗人IgM抗体改变HNE-1细胞周期分布,阻滞于S期,G1期减少,与ZHENG等[3]结果一致。
gp96属于热休克蛋白90(HSP90)家族中的一个成员,能够参与肿瘤抗原的合成、装配及抗原提呈,与肿瘤特异性抗原肽结合形成gp96-肽复合物,激活抗肿瘤特异性免疫应答和免疫调节[12]。gp96在多种恶性肿瘤细胞中高表达,可能是恶性肿瘤诊断和免疫的靶点。研究表明,在喉癌组织高表达的gp96与喉癌的发生、发展和预后相关[13]。QIAN等[14]发现提取不同骨髓瘤细胞系分泌的gp96混合成疫苗,可抑制小鼠骨髓瘤的侵袭。以上研究证明gp96在肿瘤免疫治疗中发挥重要的作用。有研究报道,肺癌组织中gp96和IgG高表达,可能二者共同参与肿瘤的免疫防御和逃逸[15]。在本实验中构建裸鼠移植瘤模型,发现抗人IgM抗体可抑制移植瘤的生长,免疫组织化学检测瘤体组织中IgM和gp96表达情况,发现实验组中IgM和gp96表达明显低于对照组(P<0.05),提示抗人IgM抗体能抑制移植瘤的生长可能与抑制IgM和gp96蛋白表达有关。
综上所述,抗人IgM抗体能抑制HNE-1细胞的增殖,促进细胞凋亡,阻滞细胞周期于S期,减少细胞的G1期,并可能通过抑制IgM和gp96蛋白的表达进而抑制裸鼠移植瘤的生长。本研究结果可能为抗NPC研究提供新的思路。
[1]LEE A W,MA B B,NG W T,et al.Management of nasopharyngeal carcinoma:current practice and future perspective[J].J Clin Oncol,2015,33(29):3356-3364.
[2]BENSOUDA Y,KAIKANI W,AHBEDDOU N,et al.Treatment for metastatic nasopharyngeal carcinoma[J].Eur Ann Otorhinolaryngol Head Neck Dis,2011,128(2):79-85.
[3]ZHENG H,LI M,LIU H,et al.Immunoglobulin alpha heavy chain derived from human epithelial cancer cells promotes the access of S phase and growth of cancer cells[J].Cell Biol Int,2007,31(1):82-87.
[4]LIANG P Y,LI H Y,ZHOU Z Y,et al.Overexpression of immunoglobulin G prompts cell proliferation and inhibits cell apoptosis in human urothelial carcinoma[J].Tumour Biol,2013,34(3):1783-1791.
[5]HU F,ZHANG L,ZHENG J,et al.Spontaneous production of immunoglobulin M in human epithelial cancer cells[J].PLoS One,2012,7(12):e51423.
[6]MOSSAD N A,MAHMOUD E H,OSMAN E A,et al.Evaluation of squamous cell carcinoma antigen-immunoglobulin M complex (SCCA-IGM) and alpha-L-fucosidase (AFU) as novel diagnostic biomarkers for hepatocellular carcinoma[J].Tumour Biol,2014,35(11):11559-11564.
[7]GALLOTTA A,ZIGLIOLI F,FERRETTI S A,et al.A novel algorithm for the prediction of prostate cancer in clinically suspected patients[J].Cancer Biomark,2013,13(4):227-234.
[8]BANDIERA E,ZANOTTI L,FABRICIO A S,et al.Cancer antigen 125,human epididymis 4,kallikrein 6,osteopontin and soluble mesothelin-related peptide immunocomplexed with immunoglobulin M in epithelial ovarian cancer diagnosis[J].Clin Chem Lab Med,2013,51(9):1815-1824.
[9]WAN X,LEI Y,LI Z,et al.Pancreatic expression of immunoglobulin G in human pancreatic cancer and associated diabetes[J].Pancreas,2015,44(8):1304-1313.
[10]QIU X Y,ZHU X H,ZHANG L,et al.Human epithelial cancers secrete immunoglobulin G with unidentified specificity to promote growth and survival of tumor cells[J].Cancer Res,2003,63(19):6488-6495.
[11]邓郁青,郑杰,李国辉,等.免疫球蛋白在结肠癌HT-29细胞中的表达及其生物学活性探讨[J].中华肿瘤杂志,2006,28(2):88-91.
[12]WANG X,WANG Q,LIN H.Correlation between clinicopathology and expression of heat shock protein 72 and glycoprotein 96 in human esophageal squamous cell carcinoma[J].Clin Dev Immunol,2010(2010):212537.
[13]陈才伟,贾晓娟,孟颂东,等.Gp96蛋白的免疫学及其临床应用研究进展[J].生物工程学报,2011,27(5):704-711.
[14]QIAN J,HONG S,WANG S,et al.Myeloma cell line-derived,pooled heat shock proteins as a universal vaccine for immunotherapy of multiple myeloma[J].Blood,2009,114(18):3880-3889.
[15]王慧贤,刘彦仿,杨守京,等.热休克蛋白70,葡萄糖调节蛋白94和IgG在人肺癌组织中的表达[J].细胞与分子免疫学杂志,2008,24(5):447-449.



