陈益国,邓林强,陈 会,熊章华,桂晓美,曾黎峰,喻金梅
(1.江西省人民医院检验科,南昌 330008;2.江西省妇幼保健院肿瘤科 南昌330006)
金黄色葡萄球菌是院内感染率较高的细菌之一,自上世纪60年代检出第1株耐甲氧西林金黄色葡萄球菌(MRSA)以来,其分离率已逐年上升,目前MRSA已由院内感染扩展到社区[1-2],自2002年以来,耐万古霉素金黄色葡萄球菌分离逐年增加[3],使临床用药面临严峻考验[4]。因此,寻找免疫学治疗和预防金黄色葡萄球菌感染已成为人们关注的焦点, TLR2受体是机体免疫系统识别革兰阳性细菌的主要模式识别受体。本课题组前期研究表明,TLR2受体合成配基Pam3Csk4预处理小鼠能显着降低MRSA小鼠肺炎模型的病死率,并在体外能增强巨噬细胞和中性粒细胞的杀菌功能[5-6],提示Pam3Csk4能增强感染动物对金黄色葡萄球菌的抵抗能力,由于金黄色葡萄球菌血流感染后,脏器脓肿是常见并发症之一,所形成脓肿可源源不断地提供感染源,是金黄色葡萄球菌感染久治不愈的常见原因之一。因此本研究拟用亚致死剂量的MRSA进行小鼠造模,探索Pam3Csk4对金黄色葡萄球菌感染后对肾脏的保护功能。
1 材料与方法
1.1材料 18~22 g的SPF级昆明(KM)小鼠购自于江西省中医药大学实验动物中心;MRSA标准菌株 (MRSA,ATCC43300)于本室保存;PE/CY5.5-anti- Gr-1,PE-anti-CD11b 来源于biolegend公司(美国),胶原酶Ⅰ和DNAse来源于美国sigma公司,RT-PCR和Q-PCR扩增试剂盒购自TaKaRa公司(日本),其余试剂均为国产分析纯。Beckman低温冷冻高速离心机、CO2恒温细菌培养箱和 Q-PCR仪(CFX96)由江西省人民医院中心实验室提供。
1.2方法
1.2.1引物合成 由上海英韦创津公司合成下列引物序列,见表1。
1.2.2MRSA制备 将MRSA转种于血琼脂平板,18~24 h后挑选单个菌落移种于LB培养继续培养4~6 h到对数期,4 ℃ 6 000×g离心10 min,留取沉淀,无菌pH 7.4 PBS洗5次后重悬,细菌数按照文献[6]计算后备用。
1.2.3肾脓肿模型 MRSA菌悬液制备同前,将所得菌悬液稀释至每100 μL含1×108CFU MRSA,尾静脉注射每只100 μL,Pam3Csk4预处理剂量每只50 μg,注射体积每只100 μL,每组动物4只,3、7 d后断颈处死并收集肾脏观察小鼠脓肿肾个数和切片作HE染色,观察脓肿大小和数量、WBC浸润情况。
1.2.4肾脏中性粒细胞浸润流式检测 将小鼠分为未处理正常小鼠组、生理盐水组和Pam3Csk4处理组共3组,每组4只,Pam3Csk4处理组按每只50 μg尾静脉注射Pam3Csk4,生理盐水组注射体积每只100 μL生理盐水。除未处理正常小鼠组外,Pam3Csk4或生理盐水处理24 h后以每只1×108CFU的MRSA 尾静脉攻击,攻击小鼠攻击12 h后断颈处死并摘取左肾,匀浆,胰酶消化,肾中性粒细胞制备按文献[5]方法进行,即用10 U/mL胶原酶Ⅰ和2 μg /mL的DNAs消化30 min,离心收集细胞后加入进行PE/CY5.5 Gr-1和PE-anti-CD11b室温孵育30 min后,1×PBS洗3次,4%多聚甲醛固定后检测。
1.2.5肾组织PCR 将雌性20~22 g SPF级的KM小鼠分成组,每组动物4只,Pam3Csk4预处理剂量每只50 μg。 MRSA亚致死量感染细菌量为每只1×108CFU,尾静脉注射。攻击小鼠6、12 h后断颈处死并摘取左肾、匀浆。Q-PCR按参考文献[7]略有改动进行,按TaKaRa试剂盒提取总RNA,反转录后进行Q-PCR;反转录条件按TakaRa提供方法进行;Q-PCR:95 ℃变性5 min,58 ℃退火30 s,72 ℃延伸30 s,共进行35~40个循环。

表1 cDNA序列

2 结 果
2.1Pam3Csk4预处理抑制MRSA导致的肾脓肿 Pam3Csk4预处理小鼠感染MRSA后,脓肿主要在集中于肾脏,MRSA感染3、7 d Pam3Csk4处理组脓肿肾数量少于生理盐水组(P<0.05),见表2,图1箭头所示白色部分为肾脓肿,生理盐水组7 d内1只小鼠出现死亡,其余肾脏已变形且脓肿较为明显,切片结果显示Pam3Csk4处理组肾脓肿的病变程度明显减轻低于生理盐水组(切片均来源于左肾),见图2。肝组织未见肉眼可见脓肿,切片也少见脓肿迹象。

表2 MRSA感染后的脓肿肾个数(个)
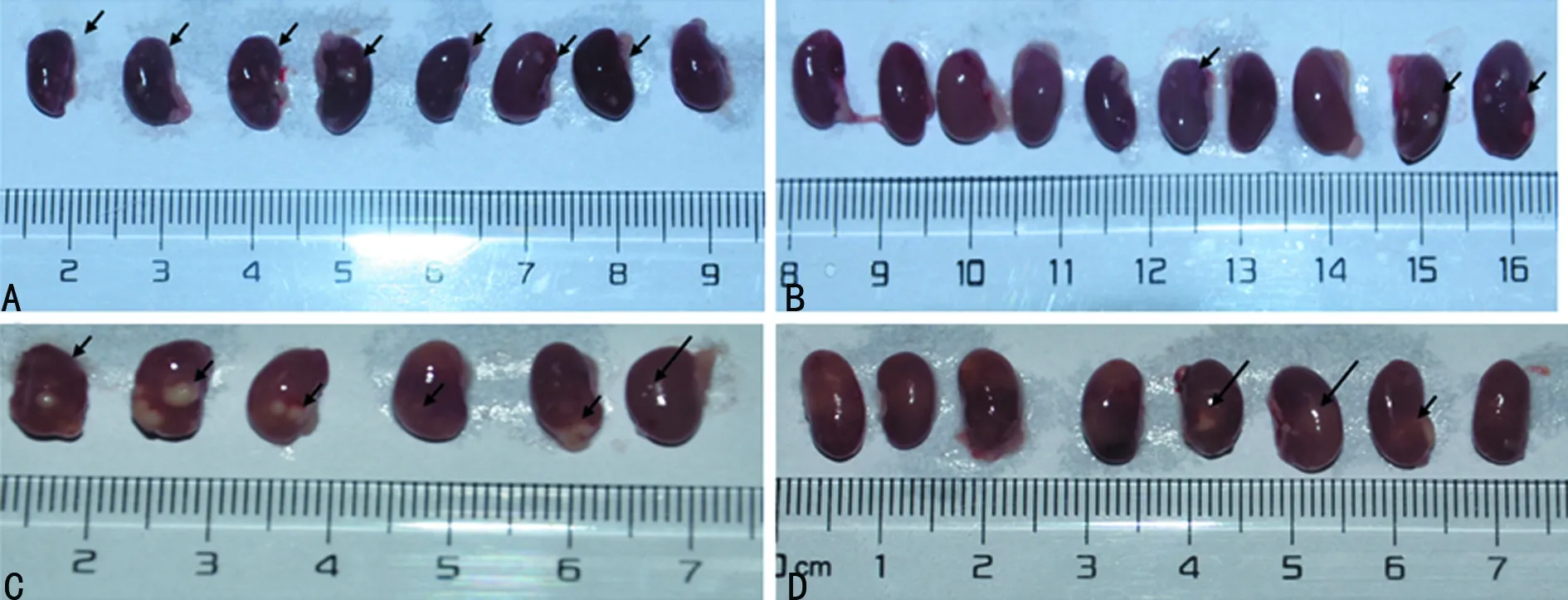
A:生理盐水组3 d;B:Pam3Csk4处理组3 d;C:生理盐水组7 d;D:Pam3Csk4处理组7 d
图1 Pam3Csk4预处理抑制MRSA导致的肾脓肿大体观

A:正常小鼠组;B:Pam3Csk4处理组3 d;C:Pam3Csk4处理组7 d;D:生理盐水组3 d;E生理盐水组7 d
图2 Pam3Csk4预处理抑制MRSA导致的肾脓肿切片(HE×200)
2.2Pam3Csk4预处理抑制中性粒细胞的浸润 流式结果显示,MRSA感染后12 h,Pam3Csk4处理组小鼠肾组织中性粒细胞浸润为1.5%,低于生理盐水组(3.7%),差异有统计学意义(P<0.01),见图3。
2.3Pam3Csk4预处理抑制小鼠肾脏CXCL1/2 mRNA的表达 Pam3Csk4预处理后CXCL1/2显着增强(P<0.01),但MRSA感染6 h和12 h后,Pam3Csk4处理组小鼠CXCL1/2表达均低于生理盐水组(P<0.01),见图4。

A:中性粒细胞值;B:正常小鼠组;C:Pam3Csk4处理组;D:生理盐水组;b:P<0.01
图3 Pam3Csk4预处理抑制中性粒细胞的浸润
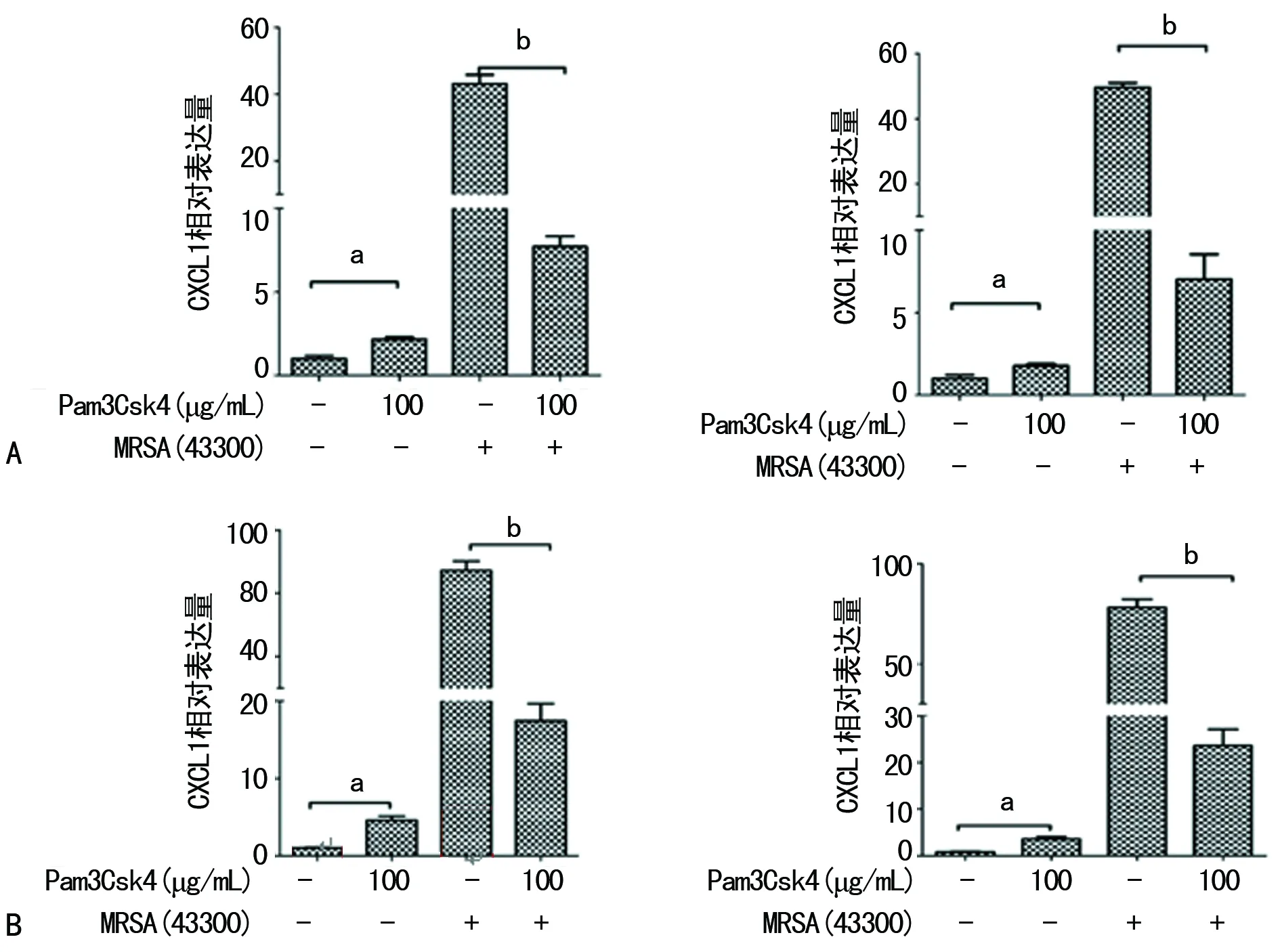
A:MRSA感染后6 h;B:MRSA感染后12 h;a:P<0.05,b:P<0.01
图4 MRSA感染后小鼠肾脏CXCL1/2基因表达
2.4Pam3Csk4预处理降低MRSA感染后肾脏炎症介质的释放 在感染后不同时间点,Pam3Csk4预处理显着限制感染小鼠炎症介质TNF-α、 IL-1β和 IL-6而促进抗炎因子IL-10基因表达,见图5。
2.5Pam3Csk4预处理降低小鼠肾组织HGMP1和HSP70基因表达 Pam3Csk4预处理小鼠在MRSA感染6 h内与生理盐水组比较差异无统计学意义(P>0.05),但12 h能显着降低HSP70和HGMP1的基因表达,见图6。
2.6Pam3Csk4预处理增强小鼠肾组织FcγRⅢ和CR3基因表达 在6、12 h时间点Pam3Csk4处理组CR3和FcγRⅢ均显着高于生理盐水组,而CR3在感染后6 h Pam3Csk4处理组与生理盐水组间差异无统计学意义(P>0.05),在感染12 h后Pam3Csk4处理组显着高于生理盐水组,见图7。

A:MRSA感染后 6 h;B:MRSA感染后12 h;a:P<0.05;b:P<0.01
图5 MRSA感染后肾组织TNF-α、IL-6、IL-1β和IL-10的mRNA表达

A:MRSA感染后 6 h;B:MRSA感染后12 h;a:P<0.05
图6 Pam3Csk4预处理降低小鼠肾脏HGMP1和HSP70的表达

A:MRSA感染后 6 h ; B:MRSA感染后12 h;a:P<0.01
图7 Pam3Csk4预处理增强FCr R Ⅲ和CR3的表达
3 讨 论
金黄色葡萄球菌血流感染后,脏器脓肿是常见并发症之一,所形成脓肿可源源不断地提供感染源,是金黄色葡萄球菌慢性感染久治不愈的常见原因之一,因此本研究探索Pam3Csk4是否能抑制金黄色葡萄球菌内脏脓肿的形成;本研究结果显示,MRSA感染小鼠,肝组织未见肉眼可见脓肿,切片也少见脓肿迹象,Pam3Csk4预处理后,脓肿主要集中于肾脏,MRSA感染3 d和7 d的结果显示,Pam3Csk4处理组肾脏脓肿数量显着减少,切片结果显示其肾脓肿的病变程度明显减轻低于生理盐水处理组。
中性粒细胞是天然抗感染免疫的一线细胞[7],当金黄色葡萄球菌侵入机体后,中性粒细胞快速聚集到感染部位,从而发挥抗感染作用,但过度的中性粒细胞浸润也会导致不同程度组织损伤和过度炎性反应[8]。另一方面,中性粒细胞删除的小鼠也能显着降低其细菌清除率和感染动物的存活时间[9],因此适当控制中性粒细胞的浸润具有重要意义。与以往研究[10]一致,本研究结果表明,预处理Pam3Csk4减少MRSA感染小鼠肾脏中性粒细胞浸润。进一步研究表明,这种现象可能与降低中性粒细胞趋化因子CXCL1/2及细胞表面趋化性受体表达有关,其机制可能通过限制机体中性粒细胞的浸润而抑制因过度中性粒细胞聚集而导致的过度炎性反应[11]。本课题组前期已发表数据显示,Pam3CSK4鼻腔滴注也能显着降低MRSA感染后肺部中性粒细胞的浸润[5],但如何控制中性粒细胞的聚集量目前仍然是亟待解决的问题。
对于感染患者来说,过度的炎性反应往往是其死亡的重要因素[12],因此本研究对小鼠感染后肾脏炎症介质的基因表达进行了检测,结果发现,Pam3Csk4的预处理能抑制MRSA感染小鼠肾组织促炎症因子TNF-α、IL-1β和IL-6的释放,并且提高抗炎症因子IL-10的释放,提示Pam3Csk4预处理能抑制MRSA感染导致的过度炎性反应。
HGMP1和HSP70反应急性肾肾损伤的重要炎症指标,HGMP1和HSP70的表达增加能增加肾脏的炎性反应和肾细胞的急性损伤[13]。本研究表明,Pam3Csk4预处理小鼠在金黄色葡萄球菌感染6 h内与对照组比较无显着变化,但能显着降低12 h后HGMP1和HSP70的mRNA表达,提示Pam3Csk4能降低金黄色葡萄球菌感染小鼠肾脏的炎性反应。
调理吞噬是机体抗菌免疫重要机制,其中调理性Fcγ受体分为3类[14],通过结合不同的IgG亚型发挥调理吞噬作用,有研究报道TLR2激动剂处理能增强外周血单核细胞释放细胞因子和体外抗菌能力[15]。本研究结果表明,Pam3Csk4预处理能增强MRSA感染后肾FCγRⅢ基因表达,但单独Pam3Csk4预处理后其表达水平增加不明显,其潜在机制尚不明确。补体受体为另一类调理吞噬性受体,可通过结合与细菌结合的C3b和iC3b而发挥补体参与的杀菌作用,文献研究表明,机体感染病原微生物后补体受体的表达水平增加[15]。因此,本研究也检测肾组织中补体受体的表达,结果表明,Pam3Csk4预处理也能显着增强CR3的表达。结合上述研究结果提示,Pam3Csk4预处理增强的细菌清除率可能与增强肾组织免疫细胞表面调理吞噬性受体表达、抑或是增强中性粒细胞等免疫细胞氧化应激、杀菌性蛋白的释放有关[5]。
综上所述,Pam3Csk4预处理能显着降低MRSA导致肾脓肿,同时抑制因MRSA感染所导致的过度炎性反应,降低肾损伤程度,该现象并非增加PMN等免疫细胞数量,可能与增强肾组织浸润的免疫细胞的吞噬功能相关。



