王志景,马丽丽,王 慧,程 珂,何全中,孙 力
(新乡医学院第三附属医院妇产科,河南新乡 453003)
宫颈癌是女性常见的恶性肿瘤,严重影响我国妇女的健康。在我国,宫颈癌的发生率为98.9/100 000,病死率达到30.5/100 000,而且有逐渐年轻化的趋势[1]。宫颈癌的发生原因相对明确,即HPV病毒的反复感染。但是宫颈癌发生和转移的机制相对复杂,目前尚未完全阐明。笔者前期的研究发现,miR-144-3p在宫颈癌组织中的表达降低,本研究在体外进一步验证miR-144-3p对宫颈癌细胞株的作用,现将结果报道如下。
1 材料与方法
1.1材料与仪器 胎牛血清和RPMI 1640细胞培养基购自美国Hyclone公司,青-链霉素双抗、考马斯亮蓝、凝胶试剂盒、硝酸纤维素膜、ECL发光试剂盒、兔抗人一抗和羊抗兔二抗购自博士德生物工程有限公司,CCK-8试剂盒、反转录试剂盒均购自碧云天生物工程有限公司,实时定量PCR试剂盒购自天根生物工程有限公司,倒置相差显微镜及荧光显微镜均购自日本Nikon公司。
1.2细胞培养 宫颈癌Hela细胞购自中国科学院上海细胞库。用含10%胎牛血清,100 μg/mL青霉素及0.1 mg/mL链霉素的PRMI1640培养基培养,并置于含5%CO2的37 ℃细胞培养箱中。每2~3天换液1次。倒置相差显微镜观察细胞生长情况,铺满80%左右时,用0.25%胰酶(含0.02%EDTA)进行消化,按1∶3比例进行传代。细胞对数生长期内进行实验。
1.3细胞转染 细胞生长约80%时进行转染。将miR-144-3p mimics(mimics 组)、inhibitors(inhibitors组)和阴性对照(NC组)(仅使用Lipofectamine 2000)转染细胞,以未进行干预的Hela细胞为正常对照组(Hela组),操作步骤按照说明书进行,每组设3个复孔。
1.4CCK-8检测细胞增殖活性 细胞转染48 h后,消化离心,按每孔约2×103个细胞的浓度接种于96孔板中,每组设3个复孔。培养过夜吸弃培养基,用不含血清的DMEM培养基漂洗2遍,每孔加入CCK-8染色液100 μL,37 ℃避光孵育染色1 h,用酶联免疫标记仪测定细胞的吸光值(A450),计算出细胞的增殖率(以NC组为100%计算)。
1.5Transwell检测细胞迁移能力 细胞转染48 h后,分别将3组细胞制成约106/mL的细胞悬液(培养基不含胎牛血清),取200 μL接种于上层小室内,下层小室内加入300 μL含10%胎牛血清的培养基作为化学诱导物,每组设3个复孔。37 ℃培养24 h后,取出下层小室,吸干培养基,加入4%多聚甲醛固定30 min,PBS洗涤3次,Gemisa溶液染色5 min,在高倍镜下(×400)选取5个视野计数细胞,取平均数作为实验结果。以对照组为100%,计算各组细胞的迁移率。
1.6实时定量PCR检测NFE2L2 mRNA的变化 转染后取对数生长期的细胞,采用Trizol法提取细胞总RNA,按说明书进行操作。分光光度计测定RNA浓度后,取1 μg RNA反转录为cDNA,操作过程按反转录试剂盒说明书进行。引物序列:NFE2L2上游引物为5′-ACACGGTCCACAGCTCATC-3′,下游引物为5′-TGTCAATCAAATCCATGTCCTG-3′; GADPH内参 正义链5′-CTTCATTGACCTCAACTAC-3′,反义链5′-GCCATCCACAGTCTTCTG-3′。采用25 μL反应体系,按说明书进行。PCR反应条件:95 ℃预变性 5 min;95 ℃变性 10 s,60 ℃退火延伸30 s,共40个循环。采用2-ΔΔCt法进行分析。
1.7蛋白提取和Western Blot检测NFE2L2水平 转染后取对数生长期的细胞以106/mL的密度种植于6孔板中培养过夜。4 ℃ PBS漂洗3次;0.25%胰酶消化并收集细胞(漂洗液离心后收集细胞),加入200 μL RIPA裂解液(含体积分数为1%的PMSF)置于冰上裂解30 min。4 ℃ 12 000 r/min离心15 min(低温离心机提前30 min启动并预冷),收集上清液,考马斯亮蓝法测蛋白浓度。用RIPA裂解液调整样品蛋白浓度至相同水平,热变性蛋白。取相同总量的蛋白质进行凝胶电泳,转膜,孵育一抗(1∶1 000稀释)4 ℃过夜。加入二抗(1∶2 000稀释),室温孵育2 h,TBST漂洗3次,每次10 min。 在暗室内使用ECL发光液发光,压片后曝光盒曝光。图片照相后用Qantity-One分析软件进行分析测定。

2 结 果
2.1CCK-8结果显示miR-144-3P抑制Hela细胞的增殖 转染48 h后,mimics组细胞的增殖活性为(83.2±2.0)%;而inhibitors组细胞的增殖活性为(113.0±0.8)%,与NC组(100.2±0.2)%相比,差异有统计学意义(P<0.05),见图1。而NC组和Hela组相比,差异无统计学意义(P>0.05)。

图1 转染后各组细胞的增殖活性情况
2.2miR-144-3p抑制Hela细胞的迁移能力 转染48 h后,mimics组Hela细胞迁移到下层的数目为(78.3±3.5)个,而inhibitors组的数目为(109.3±4.2)个,和NC组(96.0±4.0)个相比,差异有统计学意义(P<0.05);而NC组和Hela组相比,差异无统计学意义(P>0.05),见图2。
2.3miR-144-3p抑制Hela细胞NFE2L2的表达 实时定量PCR结果发现,以正常Hela细胞为参照,NC组、mimics组和inhibitors组中NFE2L2的相对表达量分别为1.00±0.03、0.40±0.01、1.94±0.04,差异有统计学意义(P<0.05),见图3。而Western Blot结果显示,mimics组中NFE2L2的蛋白表达量明显降低,inhibitors组的表达量显着升高,和NC组(1.00±0.03)相比,差异有统计学意义(P<0.05),而NC组和Hela组之间差异无统计学意义(P>0.05),见图4。
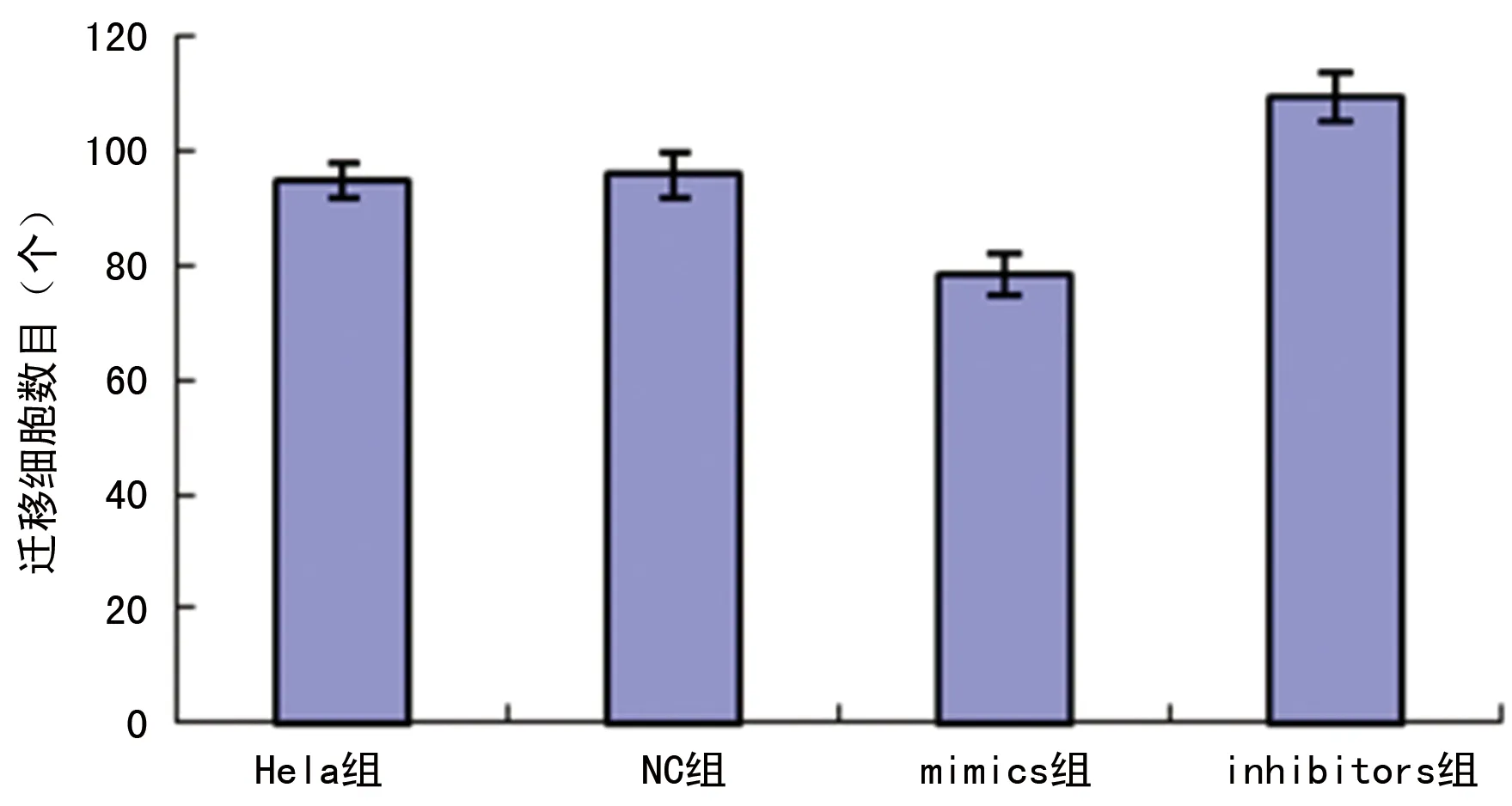
图2 转染后各组细胞迁移细胞数目情况
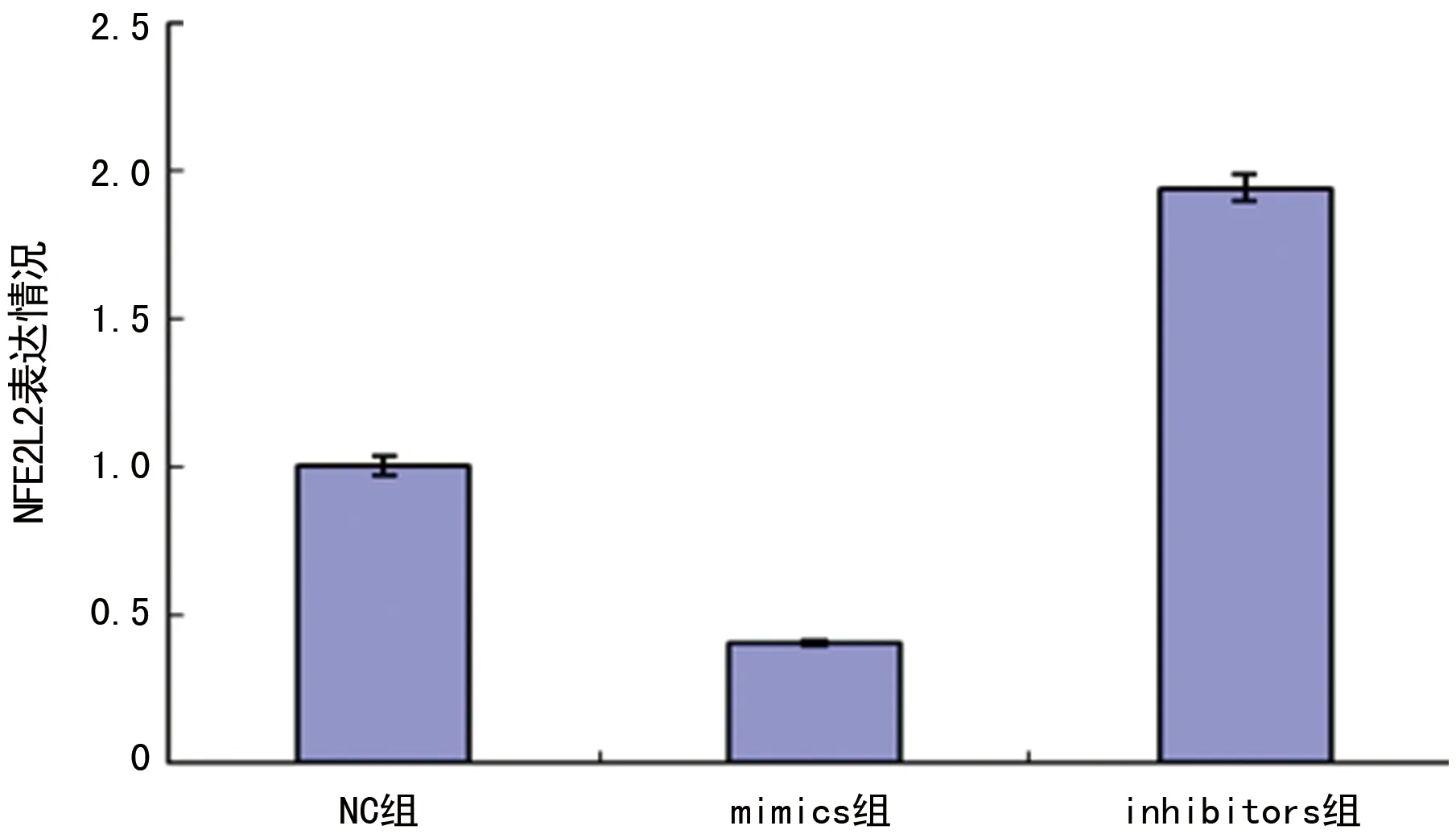
图3 转染后各组NFE2L2的表达情况

图4 Western Blot结果显示各组NFE2L2的表达情况
3 讨 论
MiRNAs是1993年在线虫中被发现的[2]。目前,医学界已经发现它在多种物种中均有表达,而且在心血管、感染、自身免疫性疾病和代谢障碍等方面发挥重要的调节作用[3-4]。研究表明,miRNAs在肿瘤的发生、发展中起重要的调节作用,可以作为癌基因或抑癌基因调节肿瘤的增生、浸润和转移等过程[5],有些miRNA有成为是肿瘤诊断标志物的潜力[6]。
miR-144-3p是miR-144的成熟体,在多种生理和病理过程中有发挥重要的调节作用。在创伤后的恐惧消退实验中发现,miR-144-3p集中表达在杏仁核附近,并促进恐惧消退的恢复,说明在中枢神经受损后miR-144-3p能够促进其恢复[7]。过表达的miR-144-3p能够抑制骨髓间充质干细胞向成骨细胞分化,通过荧光素酶报道实验和Western Blot结果显示,其能够通过抑制Smad4发挥作用[8]。在帕金森的发病过程中,过表达的miR-144-3p能够抑制β-前淀粉样蛋白,上调线粒体功能相关的重要基因如过氧化物酶体增殖物激活受体γ共激活因子-1α(PGC-1α)、核呼吸因子1(NRF-1)和线粒体转运因子A(TFAM)的表达,并且增加细胞内三磷酸腺苷(ATP)和细胞活性,而β-前淀粉样蛋白表达增多则起到相反的作用[9],说明miR-144-3p在帕金森病的发生过程中发挥重要的作用。
在肿瘤的发生和发展过程中,miR-144-3p也发挥重要的作用。在一项肝癌细胞的研究中发现,和癌旁组织相比,miR-144-3p表达明显下降,而且和患者的手术和预后存在相关性;通过生物学分析发现,其调节多种细胞功能和多条肝癌细胞相关的病理通路,包括P53通路[10]。在喉鳞状细胞癌的体外研究中发现,miR-144-3p能够特异性地作用于E26特异转录因子1(ETS-1),部分通过抑制上皮-间质的转化从而抑制细胞的增殖、浸润和转移[11]。在多发性骨髓瘤患者的血浆及细胞系中,miR-144-3p的表达均明显降低,而体外过表达miR-144-3p能够明显地抑制细胞的增殖和集落形成,促进细胞周期的停滞和凋亡;进一步检测发现其是通过抑制c-MET的表达,从而调控PI3K/AKT通路来发挥作用的[12]。在这些肿瘤中,miR-144-3p均发挥抑癌基因的作用。在急性髓系白血病的研究中发现,miR-144-3p在骨髓和外周血中的表达均明显升高,而且在细胞系HL-60中表达也明显增高,通过双荧光素酶报道实验发现其靶基因为NRF2。抑制miR-144-3p的表达后,NRF2能够降低细胞的活性并促进细胞的凋亡[13]。说明在急性髓系白血病中,miR-144-3p发挥癌基因的作用。而在肾透明细胞癌中的研究也发现,miR-144-3p能够促进细胞的增殖、浸润和耐药性的形成,发挥癌基因的作用[14]。这些研究说明,miR-144-3p在不同的肿瘤中发挥抑癌基因或癌基因的作用。笔者之前的研究发现,在宫颈癌中miR-144-3p的表达明显降低,而且和患者的临床特征相关,推测其可能发挥抑癌基因的作用。笔者通过体外研究进一步发现miR-144-3p能够抑制细胞的增殖和浸润。
NFE2L2是细胞内抗氧化应激的主要转录因子,在生理及病理过程中发挥重要的调节作用[15]。匈牙利的一项儿童哮喘的病例对照研究发现,NFE2L2的基因多态性和环境污染后感染引起的哮喘有相关性[16]。而NFE2L2的突变,会导致体内氧化-还原系统失衡,在多种肿瘤的发生和发展中发挥重要的作用。在结肠癌细胞系中研究发现,抑制NFE2L2的表达会导致miR-181c的激活,抑制线粒体的电子传递链的重要单位细胞色素C的氧化酶,从而抑制细胞内ATP的生成[17]。在恶性黑色素瘤中的标本免疫组织化学研究中发现,和原发灶相比,在转移灶中NFE2L2的表达更高而KEAP1的表达降低,而且细胞核中NFE2L2的表达和远处转移及TWIST蛋白的表达相关,而且MFE2L2和TWIST蛋白均表达和患者的预后差明显相关,说明NFE2L2在恶性黑色素瘤的转移和上皮-间质转化中可能发挥重要的作用[18]。而在维吾尔族妇女宫颈鳞癌中的研究发现,和宫颈上皮内瘤变及正常宫颈组织相比,NFE2L2的表达升高;宫颈癌细胞系中的研究发现,抑制NFE2L2表达能明显地抑制肿瘤细胞的增殖和浸润[19]。说明NFE2L2在宫颈癌的发生、发展中发挥重要的作用。笔者前期的研究结果证实,NFE2L2在宫颈癌中的表达是升高的;在本研究中,抑制NFE2L2的表达能够降低宫颈癌细胞的增殖和浸润。
综上所述,本研究在细胞系中验证了miR-144-3P在宫颈癌细胞中的作用,并进一步验证其靶基因可能是NFE2L2。但是本研究仍存缺陷,没有采用双荧光素酶法进行直接观察。本研究观察到miR-144-3p在宫颈癌的作用,但是其具体的调控成熟及其发挥作用的途径尚需要进一步的研究。



