张 伟,王 燕,曾毅文,邹国涛,罗 勇
(重庆医科大学附属永川医院儿科 402160)
呼吸道合胞体病毒(respiratory syncytial virus,RSV)为包膜负单链RNA病毒,RSV感染好发于婴儿期儿童,大部分患儿呈轻微上呼吸症状,而部分患儿将通过宿主免疫应答发展为更严重的支气管炎或肺炎[1]。因此,阐明RSV感染后患儿免疫应答机制对于RSV预防和治疗具有重要意义。微RNA(microRNA,miRNA)分子是一种长度为18~25个核苷酸的非编码小RNA序列,它通过与特异性靶RNA接合抑制信使RNA(mRNA)向蛋白翻译,实现基因转录后水平调节蛋白质表达,进而控制炎性反应和疾病进展[2-3]。近年来,大量研究通过体外培养细胞株和临床外周血液样品均证实miRNA能够调节RSV感染相关的免疫应答[4-5],但针对RSV感染后鼻黏膜上皮脱落细胞的miRNA表达研究较少[6],而事实上RSV优先感染对象为呼吸道黏膜上皮细胞[7]。因此,本研究将以RSV感染阳性患儿鼻黏膜拭子样品作为研究对象,分析RSV感染患儿鼻黏膜上皮脱落细胞miRNA表达谱,并进一步分析miRNA差异表达与RSV感染导致的疾病严重程度间的关系。
1 资料与方法
1.1一般资料 选取2017年9月至2018年2月RSV感染季来本院儿科门诊就诊儿童。试验组纳入标准:年龄6~12个月,初次就诊,临床表现咳嗽、气促和喘息;体格检测显示心率、呼吸频率加快,肺部听诊出现哮鸣音或湿罗音;间接免疫荧光试剂盒检测鼻黏膜拭子样品呼吸道RSV抗原阳性;其中,将胸部X线片提示支气管炎或支气管肺炎的RSV感染阳性患儿作为RSV感染重度组,无影像学特征的作为RSV感染轻度组。对照组纳入标准:相同时间段来本院进行儿保的健康儿童,年龄6~12个月,体温和发育正常,无既往RSV感染史和哮喘史,呼吸音清晰,RSV抗原阴性。排除标准:妊娠期小于34周;支气管/肺发育不良;慢性肺疾病;唐氏综合征;神经系统疾病;其他可能导致严重免疫反应的疾病类型。本研究经本院伦理委员会批准后实施,入选患儿和对照组儿童均告知监护人并签署知情同意书。研究共纳入26例RSV阳性患儿作为试验组(其中17例为轻度,9例为重度),12例健康儿童作为对照组。试验组和对照组之间、RSV重度组和RSV轻度组之间在性别、年龄、身高、体质量,差异均无统计学意义(P>0.05),RSV重度组和RSV轻度组病程周期差异也无统计学意义(P>0.05)。
1.2方法
1.2.1采样 移除呼吸道分泌物后,将专用Miraclean鼻咽植绒拭子(深圳市麦瑞科林科技有限公司)插入两侧鼻腔中旋转3~5圈采集鼻黏膜上皮细胞。随后将拭子放入RNA稳定试剂中,冲洗拭子使上皮细胞分离,-80 ℃保存待进行miRNA分析。选择5例对照组儿童和5例试验组患儿的鼻咽植绒拭子在载玻片上制成细胞涂片,用于细胞学分析。
1.2.2RNA纯化分离 将-80 ℃保存的上皮细胞离心后通过TRIpure试剂(BioTeke)裂解上皮细胞,随后使用氯仿和70%乙醇提取细胞样品总RNA,使用mirVana TM miRNA Isolation Kit(Ambion,Austin)纯化,最后采用NanoDrop 2000(Thermo)对获得的RNA纯度和完整度进行分析。
1.2.3miRNA微阵列芯片分析 选择2例重度,2例轻度RSV感染阳性患儿鼻黏膜样品和2例健康儿童样品进行miRNA微阵列芯片杂交。微阵列芯片使用Agilent Human miRNA芯片(V12.0),覆盖886种人类相关miRNA。按照试剂盒提供的实验方案完成标记、杂交反应和清洗后,通过Agilent G2565BA微阵列扫描仪(美国)扫描芯片,并使用Agilent Feature extraction software v8.5对扫描数据进行整理和评价芯片的杂交质量。每个miRNA探针的信号强度采用与内参基因信号强度比值表示。
1.2.4qPCR分析 通过miRNA微阵列分析选择出对照组和试验组样品中差异表达的miRNA,并对26例试验组和12例对照组样品进行qPCR验证。将样品提取的总RNA分别用Ambion mirVanaTM miRNA和mirVanaTM qRT-PCR miRNA 检测试剂盒进行分离和扩增。采用7900 HT Fast RealTime PCR系统(Applied Biosystems,CA)进行qPCR扩增实验,所有引物(RT引物和PCR引物)均由Invitrogen(Thermo Fisher Scientific Corp.,CA)公司合成。qPCR反应条件如下:95 ℃ 3 min 变性;95 ℃ 15 s,60 ℃ 30 s循环,共40个循环,每个样品重复3次。采用ABI Prism SDS2.4 软件分析,以内源性管家基因U6校准转录后表达水平,并采用2-△△Ct方法进行标准化和计算。miRNA微阵列芯片结果通过R语言分析,miRNA的差异表达用倍数变化方法进行评估。以倍数变化大于或等于2视作miRNA表达上调,以倍率变化小于或等于0.5视作miRNA表达下调。miRNA微阵列芯片结果聚类分析使用分层聚类分析。
1.3统计学处理 采用SPSS13.0软件分析数据,试验组和对照组之间一般资料学统计采用Mann-Whitney法检验。miRNA相对表达水平采用箱图表示,试验组和对照组之间、RSV感染重度组和RSV感染轻度组之间miRNA表达差异比较通过完全随机设计t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1一般资料比较 38例样品总RNA质量和数量均满足qPCR分析需要。脱落细胞学镜检发现5例对照组儿童和5例RSV感染阳性患儿样品中均含有大量鳞状和纤毛状上皮细胞,同时含有部分粒细胞。对照组和试验组两组样品所含细胞类型无明显差异。
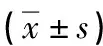
表1 RSV重度组和RSV轻度组患儿miRNA表达差异的qPCR验证
2.2miRNA微阵列芯片分析结果 2例RSV重度患儿,2例RSV轻度患儿和2例健康儿童miRNA差异化表达热图如图1所示。结果显示试验组和对照组中存在24个差异表达miRNA,其中15个miRNA表达上调,9个miRNA表达下调;RSV轻度组患儿和RSV重度组患儿间有8个差异表达miRNA,其中RSV重度组患儿有4个miRNA表达下调,4个miRNA表达上调。表达下调miRNA包括miR-34c、miR-125a、miR-31、miR-130a,表达上调miRNA包括miR-375、miR-205、miR-203a和miR-let-7f。

纵列代表不同分析样品,横排代表差异表达探针,红色代表较高表达水平,蓝色代表较低表达水平,白色代表相似表达水平
图1 RSV感染导致鼻黏膜拭子样品miRNA差异化表达热图
2.3qPCR验证结果 24个差异表达miRNA qPCR验证结果如图2所示。结果显示,与对照组比较,miR-320d、miR-34b、miR-125a和miR-429表达显着下调,miR-155、miR-203a和miR-106b表达显着上调;RSV轻度组患儿和RSV重度组患儿间差异表达的8个miRNAs的qPCR验证结果如表1所示。结果显示RSV重度组患儿miR-125a表达较RSV轻度组患儿显着下调(P<0.05),其余7个miRNA表达水平在两组间差异无统计学意义(P>0.05)。
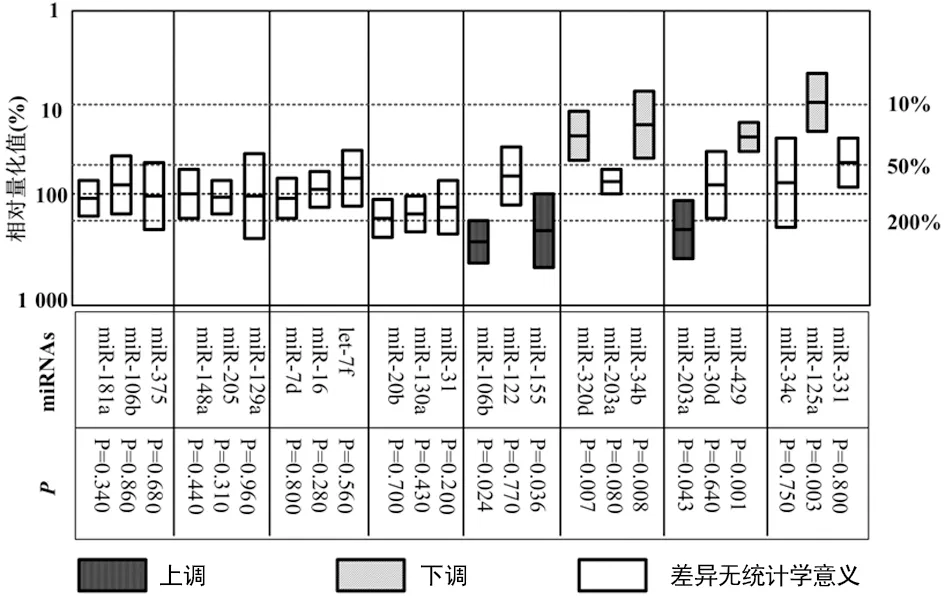
图2 RSV感染患儿鼻黏膜拭子样品miRNA的qPCR验证
3 讨 论
本研究首先通过miRNA微阵列芯片分析了RSV感染患儿鼻黏膜拭子样品miRNA表达谱。通过与对照组进行比较,发现24个差异表达miRNA。进一步通过对筛选出的24个miRNA进行qRCR验证,证实有7个差异表达的miRNA具有统计学意义(P<0.05)。其中miR-320d、miR-34b、miR-125a和miR-429表达显着下调,而miR-155、miR-203a、miR-106b表达显着上调。前期研究分析RSV感染患儿外周血miRNA表达谱,显示RSV感染患儿外周血miR-106b-5p、miR-20b-5p和miR-342-3p表达上调,而 miR-320e、miR-320d,miR-877-5p,miR-122-5p和miR-92b-5p表达下调[5,8];采用鼻黏膜拭子样品,INCHLEY等[6]发现RSV阳性患儿miR-34b、miR-34c、miR-125b、miR-29c、mir125a、miR-429和miR-27b表达下调,而miR-155,miR-31,miR-203a,miR-16和let-7d表达上调。通过对比发现,本研究能够验证部分RSV感染阳性患儿的miRNA表达,但也存在差异,推测其原因可能与分析样品不同及不同生物学个体间存在miRNA表达高度异质性有关。此外,与INCHLEY等[6]研究不同的是,本研究进一步比较不同疾病严重程度患儿的miRNA表达差异,结果显示miRNA-125a在轻、重度RSV感染阳性患儿间表达水平比较差异有统计学意义。
本研究显示RSV感染患儿差异表达miRNAs与宿主免疫系统调节密切相关。与对照组相比,miR-320d、miR-34b、miR-125a和miR-429表达下调均超过2倍,提示这些miRNAs表达降低与RSV感染引起的宿主响应密切相关。其中,miR-34b可能与炎症诱导的呼吸道上皮细胞分化有关。有研究显示当IL-13和糖皮质激素刺激培养的支气管上皮细胞时,能够调控miR-34b,且哮喘患者中支气管上皮脱落细胞中miR-34b表达下调[9]。在注射脂多糖时,老鼠肺组织中miR-34b表达上调[10];miR-125a已被多个研究证实与免疫系统中多个调控信号通路有关,包括对核因子-κB(NF-κB)信号通路的正向调控[11],抑制趋化因子5(CCL5)产生[12],巨噬细胞激活[13]等。miR-320d在免疫系统报道较少,有研究显示单纯疱疹病毒1(HSV-1)感染能够下调宿主细胞编码的miR-320d,miR-320d通过靶向转录激活因子(RTA)调控HSV-1诱导的肉瘤相关疱疹病毒(KSHV)下调细胞表达[14];miR-429被证实能够重新激活B细胞中静默的EB病毒[15]。INCHLEY等[6]报道RSV感染患儿miR-429表达下调。然而,miR-429在宿主免疫系统中的其他功能目前报道较少,其具体作用机制亟待进一步证实。在表达上调的miRNA中,miR-106b属于miR-17-92家族,被预测能够靶向Tgfbr2 mRNA 影响iNKT细胞发育。miR-17-92家族表达上调可抑制转化生化因子-β(TGF-β)信号通路,进而调节免疫系统反应[16];miR-155常在树突状细胞、T和B淋巴细胞中高表达,并调控着这类细胞功能。miR-155由Toll样受体4(TLR4)介导的NF-κB活化产生,正向调节髓细胞增殖和树突状细胞成熟,进而调控树突状细胞向淋巴结迁移和抗原呈递。因此,miR-155表达上调总伴随着急性的免疫反应[17]。
当RSV抗原与识别受体TLR4和视黄酸诱导基因蛋白1(RIG-1)结合时,激活NF-κB,进而启动宿主对RSV的免疫响应[18]。然而,过量NF-κB激活将对宿主造成有害效应,因此对NF-κB负调控将变得十分重要。通过对RSV阳性患儿miRNA表达进行分析,发现有4个与NF-κB调控密切相关的miRNAs,包括miR-34b、miR-125a、miR-155、miR-203a。该结果进一步证实RSV感染后,miRNA对NF-κB的精确正、负调控在宿主免疫响应中扮演重要作用。当儿童感染RSV后,大多数儿童症状较轻,而部分患儿将进一步进展为支气管炎或肺炎。因此研究RSV感染后影响病情发展相关因素具有重要意义。因此,本研究进一步鉴别轻度和重度RSV感染阳性患儿间miRNA表达差异,结果显示miR-125a表达在两组RSV患儿间存在差异,且轻度患儿表达低于重度患儿。研究显示,miR-125a通过对TNFAIP3抑制蛋白的负调控成为NF-κB的正向调节因子,而TNFAIP3抑制蛋白为CCL5的负调控因子,也是天然免疫和获得性免疫系统中的一个重要细胞因子。当NF-κB活化后,miR-125a将在激活的人巨噬细胞中过表达[19]。本研究中,RSV感染轻度患儿鼻黏膜脱落细胞中miR-125a下调可能提示巨噬细胞活化减弱或/和NF-κB信号通路被抑制,从而抑制过度的先天性免疫应答,避免向肺炎或支气管炎等更严重的临床重度症状发展。
本研究通过miRNA微阵列芯片和qRCR对RSV感染患儿的鼻黏膜上皮脱落细胞miRNA表达谱进行分析,发现RSV患儿miRNA谱表达模式与宿主免疫系统调节密切相关,尤其包含了一系列与NF-κB调控密切相关的miRNA。其中,通过对轻、重度RSV患儿miRNA表达谱的分析,发现 miR-125a在轻度患者中表达显着下调,提示miR-125a为经NF-κB通路的RSV免疫反应的一个重要调节因子,其功能还待进一步研究。此外,RSV感染患儿鼻黏膜样品中与固有免疫反应有关miRNA的表达动态模式也将在下一步工作中进行研究。



