蔡宜诺,刘景华△,张美玉,周 凡,杨 莹,王吉刚,刘彦琴,佟丹江
(1.北部战区总医院血液科,沈阳 110016;2.中国医科大学附属盛京医院血液科,沈阳 110022)
多发性骨髓瘤(multiple myeloma,MM)是一类起源于前B淋巴细胞的高度异质性克隆性浆细胞肿瘤。骨髓瘤细胞通常局限在骨髓微环境增殖,7%~20%的MM患者会累及髓外软组织器官(肝脏、皮肤、会阴、内分泌腺、淋巴结、胃肠道、鼻咽、喉等),而仅有1%左右的MM患者会累及中枢神经系统(central nervous system,CNS)[1-2]。为了解CNS受累的MM患者的临床特征及预后,本研究对7例CNS受累的MM患者进行了回顾性分析。
1 资料与方法
1.1 一般资料
2005年1月至2019年8月,就诊于北部战区总医院的381例MM患者中CNS受累者6例,另1例来自中国医科大学附属盛京医院。7例患者中初诊时并发CNS浸润4例,治疗过程中出现CNS浸润3例;2例就诊时行全身正电子发射型计算机断层显像(PET-CT)检查,1例存在左侧胸锁关节处髓外软组织浸润;中位发生CNS浸润时间为12(8~20)个月;男3例,女4例;初诊时中位年龄为51(45~70)岁;M蛋白分型:IgGλ型2例,IgAλ型2例,IgDλ型1例,轻链型1例(λ型),不分泌型1例;Durie-Salmon(D-S)分期:7例均为ⅢA期;国际分期体系(ISS)分期:Ⅰ期5例,Ⅱ期1例,Ⅲ期1例,见表1。本研究经本院伦理委员会审核通过,所有受试者均知情同意。
1.2 CNS浸润的定义及检查方法
CNS浸润指确诊MM同时或随后的诊治过程中出现脑膜或脑实质的侵犯,除外颅内孤立性浆细胞瘤。CNS浸润的诊断依赖于组织病理学、脑脊液细胞学,7例患者中1例术后病理、1例肿块穿刺细胞形态学证实为颅内浆细胞瘤,2例脑脊液流式细胞术证实浆细胞为单克隆性,其余3例通过磁共振成像(MRI)、CT影像学并排除其他疾病后诊断。
1.3 治疗
7例患者均接受地塞米松治疗。3例初诊未发生CNS前以硼替佐米和环磷酰胺为基础治疗,治疗中发生CNS后加入脂质体阿霉素、顺铂、来那度胺。4例初诊CNS治疗方案主要以硼替佐米、来那度胺、脂质体阿霉素为主。7例患者中,3例接受腰椎穿刺鞘内注射(氨甲蝶呤+阿糖胞苷+地塞米松)、2例接受颅脑放疗,1例接受自体造血干细胞移植。
1.4 疗效评估和随访
依据欧洲血液和骨髓移植协作组(EBMT)标准评定疗效:完全缓解(CR)、非常好的部分缓解(VGPR)、部分缓解(PR)、轻微反应(MR)、疾病稳定(SD)、疾病进展(PD)。患者确诊为MM之日开始随访,直至死亡。
2 结 果
2.1 MM患者CNS浸润发生率
北部战区总医院就诊的381例MM患者中,6例发生CNS浸润,MM患者CNS浸润发生率为1.57%。本组7例患者中,4例累及脑实质,2例累及软脑膜,1例既累及脑实质又累及软脑膜,见表1。
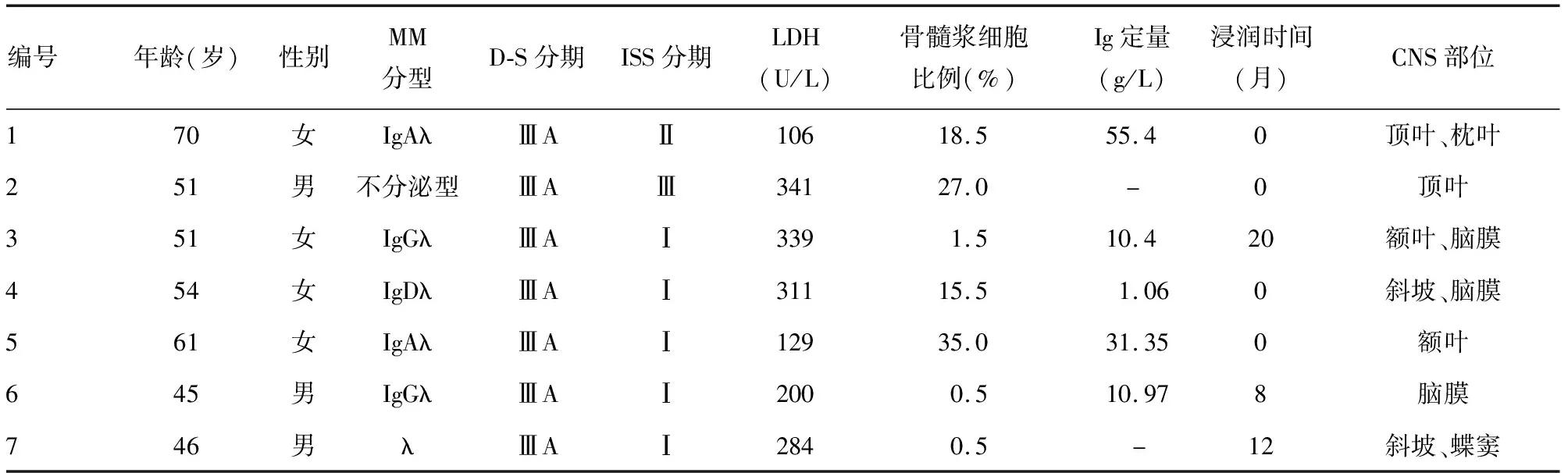
表1 CNS浸润MM患者的临床特征
2.2 主要临床表现
7例患者均存在CNS症状,5例表现为头痛、头晕伴恶心等颅内压增高症状,4例眼睑下垂、复视、外展受限,1例影响运动神经出现肢体活动功能障碍。
2.3 实验室检查
乳酸脱氢酶(LDH)水平升高者(>235 U/L)4例,LDH水平正常者(≤235 U/L)3例,其中1例MM诊治过程中出现CNS浸润者,在MM诊断时LDH为1 271 U/L,而在CNS浸润时LDH为200 U/L;中位血红蛋白水平为131(76~158)g/L;肌酐及血小板均正常;2例M蛋白均为IgG的患者在发生CNS浸润时,IgG水平正常,骨髓浆细胞比例不高,另1例λ型MM患者也是如此,而初诊CNS浸润MM患者骨髓浆细胞比例均较高(15.5%~35.0%,表1),而且浆细胞中原幼浆细胞比例较高(58%~100%);脑脊液蛋白水平增高者3例,脑脊液蛋白水平中位数为1.05(0.53~1.63)g/L;3例行骨髓或脑脊液流式细胞术检测的患者中2例CD56缺失;4例行荧光原位杂交(FISH)检测[1q21、17p13、t(4;14)、t(14;16)、t(14;20)、13q]的患者中2例1q21+、2例17p13-、1例t(4;14)、1例13q-。见表2。
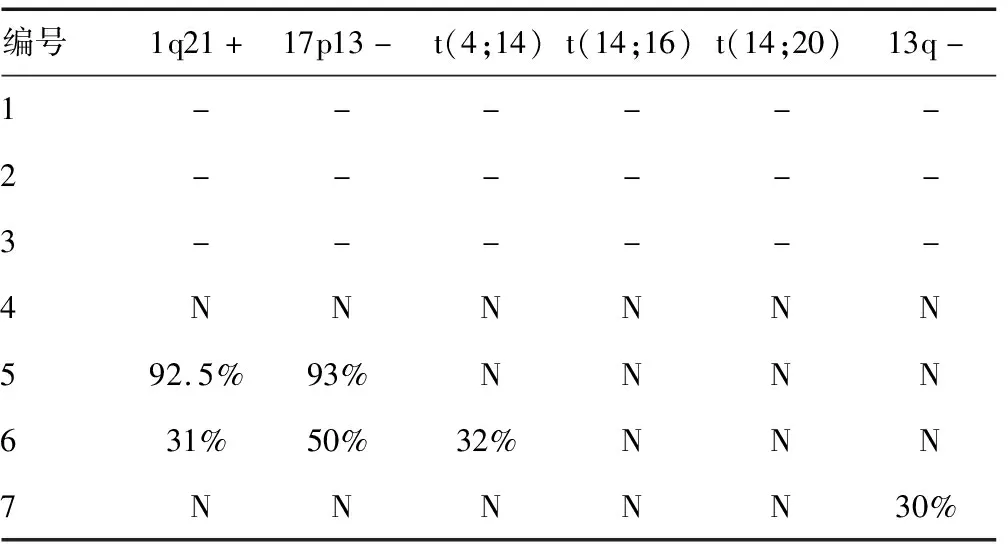
表2 CNS浸润MM患者的细胞遗传学及流式特征
2.4 治疗效果
4例起病即伴CNS浸润的患者中,仅1例达CR后行自体造血干细胞移植,移植后11个月仍为CR;其余3例生存时间分别为4、5、11个月。3例病程中并发CNS浸润的患者生存时间分别为3、4、8个月。
3 讨 论
MM患者CNS浸润表现的神经系统症状应与MM的并发症及药物引起的神经系统症状相鉴别,如肾功能不全、高钙血症引起的嗜睡、定向障碍等。硼替佐米通常引起周围神经炎,而沙利度胺可引起感觉运动神经病及其易导致血栓形成的特点可引起脑血管事件。所以,MM浸润CNS的诊断需基于影像学、病理活检及脑脊液分析同时结合临床特征[2]。
MM浸润CNS的发生机制目前尚不清楚。CD56作为免疫细胞的黏附分子,在骨髓瘤细胞表面的表达率为80%左右,CD56的缺失被认为与髓外浸润有关,在MM伴CNS浸润的患者中CD56常表现为阴性[2]。在疾病晚期如进展为浆细胞白血病时常伴随CD56表达的缺失。本组3例进行骨髓或脑脊液流式细胞术检测的患者中,2例CD56表达缺失,与CHANG等[3]报道的8例CNS浸润MM患者中5例CD56表达缺失相一致。
本组7例MM浸润CNS患者表现为明显的λ轻链受限,与LEE等[4]报道的64.7%(11/17)的患者λ轻链受限相一致。3例在MM病程中并发CNS浸润的患者均表现为M蛋白水平正常,骨髓浆细胞比例不高,是否发生轻链逃逸尚不明确。在LEE等[4]报道的17例MM浸润CNS患者中,仅1例发生了轻链逃逸。在接下来的临床工作中,应密切监测这部分患者血清游离轻链,以排除轻链逃逸的可能。
17p13缺失为MM疾病进展过程中继发的细胞遗传学改变,多伴随髓外的浸润,预示着预后不良。本组4例MM浸润CNS患者进行骨髓浆细胞FISH检测,其中2例17p13-。LIU等[5]报道,非CNS浸润MM患者17p13缺失的发生率仅为13.5%;而CHANG等[6]研究中9例MM浸润CNS患者8例17p13缺失。本组1例患者13q-,CHANG等[7]研究中检测13q-均存在,而NIEUWENHUIZEN等[8]研究认为MM伴CNS浸润和13q-之间并没有关联。FASSAS等[9]研究显示,患者细胞遗传学分析中均有染色体易位。本组4例患者中有1例t(4;14),为高危细胞遗传学病例,预示预后不良。
CNS浸润MM患者总体预后差,从诊断CNS浸润到死亡的总生存时间(OS)为2~6个月[8,10-12],接受自体造血干细胞移植患者的OS为10~67个月[12]。本组患者无论发病时CNS浸润还是治疗后CNS浸润,其生存时间都较短。目前存在CNS浸润的MM尚无标准的治疗方案。近年来,CNS浸润MM的发生率上升,而确诊MM发展到CNS浸润的时间也在延长,这可能与大剂量的化疗及新药的出现相关[13],新药导致MM患者生存期延长,从而增加了髓外浸润的可能性。
蛋白酶体抑制剂硼替佐米不能通过血脑屏障,而免疫调节剂沙利度胺及来那度胺通过率也是有限的[12]。本组7例患者中,4例采用硼替佐米的基础化疗,效果不佳,但在采用来那度胺为基础治疗的4例患者中1例取得显着疗效。MUSSETTI等[14]报道1例MM浸润CNS患者在接受硼替佐米、来那度胺为基础的治疗失败后,采用泊马度胺为基础的治疗,取得较好的疗效。DIMOPOULOS等[15]报道,硼替佐米与来那度胺联用虽能克服13p-和t(4;14)等高危细胞遗传学,但在17p13-上并没有体现出优势。而另一项研究显示,泊马度胺对于高危细胞遗传学17p13-有更好的CNS渗透性[16]。腰椎穿刺鞘内注射(氨甲蝶呤、阿糖胞苷、地塞米松)为常用治疗手段,LEE等[4]报道17例MM浸润CNS患者中11例存在脑膜浸润,在不考虑是否存在脑膜浸润的前提下,8例接受腰椎穿刺鞘内注射的患者OS(20个月)明显长于9例未接受腰椎穿刺鞘内注射者(2个月)。此外,头颅/脊柱放疗也是常用治疗手段。任何单一治疗手段都不是好的治疗选择,以免疫调节剂为基础的系统化疗+腰椎穿刺鞘内注射+头颅/脊柱放疗综合治疗才是最佳的治疗策略[17]。
综上所述,MM浸润CNS临床少见,诊断复杂,患者生存时间较短,预后不良,目前主要的治疗方式为化疗、放疗、鞘内注射。



