杨新宇,李苗苗 综述,潘 东,李少一△ 审校
(1.中国医科大学附属盛京医院神经外科,沈阳 110004;2.辽宁省鞍山市中心医院神经外科 114001)
人参是一种历史悠久的药材,在古时候就被认为具有十分珍贵的药理作用。多种研究发现,人参在人类抗癌、抗炎、抗衰老中效果明显,具有十分强大的生物学效应[1]。研究者利用现代化的提取技术,从人参中提取了多种活性物质,包括Rh2、Rg3等生物活性因子,其中Rh2在抑制肿瘤生长,促进肿瘤细胞凋亡,抑制肿瘤细胞侵袭性等方面具有重要作用[2]。人多形性胶质母细胞瘤是脑内最常见的原发恶性肿瘤,病理学上分为原发和继发两种类型,前者原发于脑实质内,后者多由间变性星形细胞瘤恶变而来。胶质母细胞瘤具有生长迅速,侵袭性强等特点,由于胶质瘤干细胞的存在,胶质瘤具备了根治率低、复发性高的特征[3]。经过研究发现,人参皂苷Rh2(GRh2)可通过多种途径发挥抑制胶质瘤的作用,综述如下。
1 抑制周期蛋白依赖性激酶(CDK)/周期蛋白(Cyclin)蛋白表达水平
细胞周期蛋白是一类随着真核细胞周期进展而浓度规律变化的蛋白质,他们通过活化周期蛋白依赖激酶来调节周期中各时相的进程。根据LI等[4]研究,经过GRh2处理后,胶质瘤细胞的存活率明显降低,且这种抑制作用呈剂量依赖性,同时,GRh2下调了胶质瘤细胞中CDK4和Cyclin E及蛋白激酶B(Akt)的表达。经过深入研究发现,GRh2的处理使肿瘤细胞周期停滞于G0/G1期,这种效应在多种癌型中均被验证,并明显促进了凋亡调节因子(Bcl2)相关X凋亡调节因子(Bax)和天冬氨酸蛋白水解酶(caspase-3)的表达,同时下调了Cyclin D1的表达[5]。此外,GRh2被发现能够下调细胞黏附蛋白N-cadherin和整联蛋白(Integrin-β1)的表达,同时抑制黏着斑激酶的磷酸化[6]。上述结果表明GRh2不但可以抑制细胞周期蛋白基因的表达,而且可以阻止其激活相应CDK分子,从而抑制细胞增殖分裂。关于其是与细胞周期蛋白基因结合以抑制转录,还是结合其mRNA以抑制表达,或与miRNA相关,目前仍不十分清楚,有待进一步探索。
2 抑制表皮生长因子受体(EGFR)/磷脂酰肌醇激酶(PI3K)/蛋白激酶B(Akt)/哺乳动物雷帕霉素靶蛋白(mTor)信号通路
EGFR广泛分布于哺乳动物上皮细胞、胶质细胞、成纤维细胞表面,大量研究证实,EGFR信号通路在细胞组织的增殖分化中发挥着重要作用[7]。该信号通路不仅调控正常细胞生长与增殖,还在肺癌、胶质瘤等肿瘤组织的恶性增殖中发挥重要作用。有研究报道,EGFR通路中的部分因子在胶质瘤细胞中存在明显的过度表达,提示其与胶质瘤细胞的繁衍过程密不可分[8]。LI等[9]研究发现,在经过GRh2处理后的小鼠胶质母细胞瘤的细胞中,EGFR的表达水平相比于对照组有明显降低,这种情况在体内和体外实验中均得到证实,若提高EGFR表达水平,则GRh2对胶质瘤的生长抑制作用明显降低。由此可得知,GRh2的抗胶质瘤活性很大程度上依赖于下调EGFR的表达水平。而针对其作用机制,目前已有研究证实,GRh2与表皮生长因子(EGF)竞争结合EGFR[10];且经过试验发现,GRh2对EGFR的亲和力要远高于EGF,而前者所形成的GRh2-EGFR复合体并不会对其下游信号因子产生明显激活效应。在另一项研究中,采用胶质瘤细胞系A-172细胞,并加入PI3K抑制剂(LY294002)和雷帕霉素以分别抑制Akt和mTor,结果发现EGF促进胶质瘤生长的作用受到明显抑制[10],证明了EGFR/PI3K/Akt/mTor级联反应在胶质瘤的生长中发挥重要作用。
3 下调血管内皮生长因子(VEGF)表达水平
血管新生及血管形成在恶性肿瘤的生长和侵袭过程发挥重要作用,而VEGF能明显促进肿瘤组织中血管的新生,此分子效应在包括胶质瘤在内的多种肿瘤模型中广泛存在[11]。据研究发现,VEGF家族中有多种分泌蛋白,可作为配体与3种特定结构域的受体结合,构成VEGF-血管内皮生长因子受体(VEGFR)循环调控多种细胞内效应[12-13]。而在癌症相关的新生血管形成的机制中,有多种细胞因子参与该过程的调控,经过大量实验,目前刺激肿瘤血管生长的可能因子有成纤维细胞生长因子、血管生成素、基质金属蛋白酶(MMP)、VEGF,其中研究最为广泛和深入的效应因子为VEGF家族蛋白[14-15]。据研究发现,相比于正常组织,在胶质瘤细胞系及胶质瘤组织中,VEGF蛋白表达水平明显升高,而替莫唑胺作为胶质瘤患者常用化疗药物之一,被发现可以明显下调U87MG细胞中的VEGF表达水平[16]。据生物信息数据库预测,肿瘤组织中VEGF的表达很可能受到 miRNA-497的调控,后者已被证实可以在多种癌组织中发挥抑癌效应,这为GRh2在胶质瘤中调控VEGF的作用机制提供了新的思路[17]。
4 调控细胞内miRNA表达水平
miRNA表达家族谱在细胞的各种生理生化活动中扮演着重要角色,它们参与细胞的增殖、分化及表型等多数正常或异常的细胞生命进程,故而在抗肿瘤及抑制异常细胞增生中具有难以估量的潜在作用[18]。越来越多的证据表明,miRNA在上皮间质转化、肿瘤干细胞发生和肿瘤代谢的过程中发挥重要作用,某些miRNA分子的异常表达成为肿瘤进展的关键点[19],这些发现不仅为包括胶质瘤在内的多种肿瘤的分子发病机制提供了新的见解,还对识别miRNA作为治疗干预的潜在靶点提示了作用。
4.1 调控miRNA-128表达
WU等[20]研究发现,通过对胶质瘤细胞系A172、T98MG及U251细胞的观察,在使用GRh2处理后,利用miRNA芯片阵列和实时荧光定量PCR测定法检测miRNA表达谱,发现14种miRNA表达水平上调、12种miRNA表达水平下调,其中最具特征性的为miRNA-128表达增加和miRNA-21表达降低。研究发现,GRh2可使得胶质瘤细胞中miRNA-128过度表达,而加入miRNA-128抑制剂后,GRh2对胶质瘤细胞系的抑制作用明显降低。此外,单独使用GRh2或GRh2 + miR-128抑制剂处理细胞后中,经比色实验结果显示,在GRh2处理的U251胶质瘤细胞中,caspase-3活性呈明显剂量和时间依赖性,再根据检测了含有E2F3a-3-UTR序列的荧光素酶报告基因的活性,发现GRh2处理后的胶质瘤细胞系相比于对照组的E2F转录因子3a(E2F3a)表达水平明显下降。既往研究证实,E2F3a过表达对肿瘤细胞增殖、生长具有促进作用[21],这表明GRh2可促进胶质瘤细胞miRNA-128过表达,从而增强caspase-3的活化作用,促进肿瘤细胞凋亡[22];同时,抑制E2F3a的表达,可抑制肿瘤增殖作用。
4.2 调控miRNA-21表达
经过研究发现,miRNA-21是一种的致癌基因表达产物,在多种恶性肿瘤中最常过度表达,且已被证明参与多种相关过程,包括细胞增殖、凋亡、侵袭和转移[23]。而miRNA-21在细胞内的作用靶点可能包括同源性磷酸酶(PTEN)[24]、原肌球蛋白1(TPM1)[25]、程序性细胞凋亡因子4(PDCD4)[26]和异质性细胞核核糖核蛋白K(HNRPK)[27]等。其中,PTEN是位于人类染色体10q23区域的抑癌基因,通过干扰多种通路诱导肿瘤细胞凋亡,其主要靶点为质膜内在蛋白(PIP3),是PI3K的直接产物,该基因的激活可阻断PI3K/Akt信号通路,抑制包括胶质瘤在内的多种癌细胞的增殖生长[28-29],在胶质瘤中,miRNA-21的下调有助于抑制胶质瘤细胞增殖侵袭及降低其耐药性,而这种小分子RNA可能作为GRh2的潜在靶点[30]。在SHI等[31]研究中,miRNA-21的表达在胶质瘤中被上调,从而降低Bax/Bcl比值、抑制caspase-3分子活性,下调胶质瘤细胞的凋亡过程。
5 调控MMP家族蛋白表达
细胞外基质是存在于正常组织细胞周围的复合物质,在肿瘤细胞的侵袭中具有一定的阻碍作用,而MMP是一种蛋白水解酶,他们几乎能降解细胞外基质中的各种蛋白组分,破坏正常细胞的组织学屏障,在肿瘤细胞侵袭转移中发挥关键作用[32]。目前为止,MMP-2、MMP-9、MMP-13都被证实在胶质瘤细胞中表达[33-34]。
5.1 调控MMP-13
GUAN等[35]研究发现,采用胶质瘤细胞系U251检测GRh2对胶质瘤细胞侵袭性的影响,使用划痕愈合试验和Transwell迁移试验,证实GRh2确实抑制了胶质瘤细胞的侵袭扩散。同时,研究人员检测了经过GRh2处理后胶质瘤细胞中3种MMP蛋白的表达情况,利用实时荧光定量PCR(RT-qPCR)和Western blot检测其蛋白水平,结果发现GRh2可明显抑制胶质瘤中MMP-13的表达水平,而对MMP-2和MMP-9的表达水平未见明显影响,同时,酶联免疫吸附法可进一步证实MMP-13的表达水平下调。已知c-Jun氨基末端激酶(JNK)、细胞外调节激酶(ERK)/丝裂原活化蛋白激酶(MAPK)和PI3K/Akt这3种信号通路均可激活MMP-13,实验中分别加入3种通路的特定抑制剂,发现只有Akt抑制剂LY294002明显抑制MMP-13的分泌。综上所述,GRh2通过抑制PI3K/Akt信号通路,降低了胶质瘤中MMP-13的分泌,减少了肿瘤组织对细胞外基质的破坏,降低了胶质瘤的侵袭性。
5.2 调控MMP-2
GONG等[36]研究发现,VEGF在胶质瘤细胞中的过表达可以增加MMP-2的含量,也就是说前者对后者起正调控作用。相反,MMP-2的含量变化却对VEGF无明显调控作用。而VEGF主要通过激活ERK/MAPK通路发挥作用来上调MMP-2的表达水平。因而GRh2可能通过下调VEGF的表达水平,抑制MMP-2的分泌,从而抑制胶质瘤组织的侵袭性。
5.3 调控MMP-9
根据QI等[37]研究,MMP-9在胶质瘤侵袭中起重要作用,而GRh2可以抑制佛波酯(PMA)诱导的人星形胶质细胞MMP-9的分泌和蛋白表达,且在这个过程中GRh2可能是通过抑制核因子-κB(NF-κB)、K-box和MADS-box转录因子家族蛋白(AP-1)信号因子来实现对MMP-9的调控。在这一过程中,笔者发现前述两种因子的DNA结合和转录活动被明显抑制,此外,GRh2抑制了由PMA诱导的p38 MAPK、ERK和JNK信号通路的活动,而这些因子正是NF-κB和AP-1的上游调控途径。
6 调节细胞内离子水平
细胞内的各种离子在生物信息转导调控过程中发挥着重要作用,细胞内离子浓度水平的高低可以直接或间接地对各种信号通路的级联分子产生影响,从而调控细胞的增殖、生长、黏附、转移和凋亡等生物学行为。当细胞内钙离子浓度过高时,钙过载将促进细胞凋亡[38]。最近的一项研究证实,GRh2可以上调U-87MG细胞内的钙离子浓度,增加U-87胶质瘤细胞的凋亡比例,文献同时指出,介于未检测到细胞器内钙离子的过量释放,GRh2可能通过影响细胞表面钙通道LTCC来调节细胞内钙离子的浓度变化[39]。随着研究的进展,有学者发现,GRh2对U-87细胞钙离子的调节还可依靠于上调胶质瘤的电压依赖性L型钙通道蛋白(Cav1.2)的表达来实现[40]。
7 调节免疫相关机制
7.1 调控NF-κB信号通路
NF-κB信号通路的激活与正常组织的癌变具有密切关系,在组织细胞遭到外界刺激和破坏时,会诱发激活包括NF-κB在内的炎症信号通路,通过作用于NF-κB激酶抑制剂(IKK)及NF-κB抑制剂(IKB)等分子,促进和加快肿瘤发展进程[41]。在一项针对胶质瘤患者病理组织的研究中,与正常脑组织相比,胶质瘤组织中的NF-κB表达水平明显升高,且与肿瘤的恶性程度具有明显正向相关性[42]。而在加用了NF-κB抑制剂后,体外胶质瘤细胞的增殖活性受到明显抑制[43]。 此外,活化的NF-κB1可以通过促进Bcl2的表达来抑制胶质瘤细胞的早期凋亡[44],这表明寻求新型药物来抑制NF-κB通路成为治疗胶质瘤的潜在靶点。在针对肝细胞癌的研究中,GRh2可以结合膜联蛋白(Annexin A2),抑制后者与NF-κB p50亚基交互作用和细胞核共定位,下调NF-κB信号通路的表达[45]。上述研究表明,GRh2可能通过NF-κB通路发挥抗胶质瘤的效应。
7.2 调节炎性因子
白细胞介素(IL)-6和IL-10等分子是免疫相关的重要炎性因子。有研究发现,在86例胶质瘤患者的病理组织切片及脑脊液和血清标本中,与未患此病的成人相比,IL-6表达水平均升高,且随着胶质瘤级别的提高,其含量也逐渐增高。同时,经外源IL-6处理后,U87和U251胶质瘤细胞的侵袭性明显升高,因此,该分子可作为治疗胶质瘤的靶点蛋白[46]。此外,利用胶质瘤细胞系T98G和U87的研究发现,IL-6可诱导蛋白多糖结合蛋白(SDCBP)及其mRNA的过度表达,从而增强胶质瘤细胞的增殖和侵袭能力,此过程可能由酪氨酸蛋白激酶家族蛋白(JAK2)/信号转导与转录激活因子(STAT3)信号通路介导[47]。而GRh2对脑组织损伤状态下IL-6的表达存在抑制效应[48],这表明炎性因子可作为人参皂苷的潜在治疗靶点,值得更加深入的研究。
7.3 与免疫系统的相互作用
免疫系统是人体抵抗外来病原体和自身异物的主要功能部分,包括巨噬细胞/小胶质细胞、白细胞分化抗原阳性(CD)细胞及自然杀伤(NK)细胞,恶性程度较高的胶质瘤普遍存在着免疫逃逸的机制,从而降低免疫系统对胶质瘤的抑制效应[49]。对巨噬细胞而言,未暴露于肿瘤衍生因子中的幼稚小胶质细胞可发挥抗肿瘤活性,刺激细胞周期阻滞[50]。但此种效应在胶质瘤微环境中出现了缺失[51],而这种现象极有可能由巨噬细胞亚型分化导致[52]。同时,最近的一项研究证实,GRh2在体外环境中可以对巨噬细胞产生调控[53],这表明GRh2可能作用于胶质瘤免疫微环境,从而抑制胶质瘤的免疫逃逸状态。
8 总 结
目前,GRh2抗胶质瘤的主要分子机制见图1。人多形性胶质母细胞瘤是中枢神经系统最严重的肿瘤之一,手术切除难度大,术后复发率极高,多数患者预后生存时间不超过1年。GRh2在大量的实验研究中被证实可通过多种机制抑制胶质瘤的生长增殖和侵袭转移,这对胶质瘤的药物治疗的开发提供了许多思路。根据目前的技术,在临床手术切除的基础上配合有效的药物治疗方案,可提高胶质瘤患者的预后生存率。
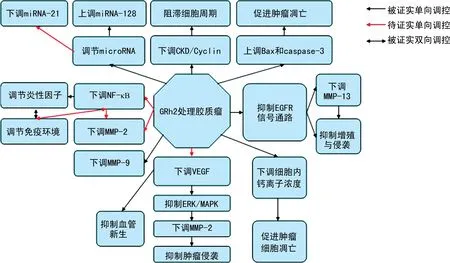
图1 GRh2抗胶质瘤分子机制



