邓穗燕,郭旭光,李 莹,夏 勇△
(1.广州医科大学附属第三医院检验科,广州 510150;2.广东省清远市清城区人民医院检验科 511500)
临床微生物实验室主要依靠手工接种的方法进行标本前处理,手工方法的局限性在于因检验人员技术水平难以统一,标本处理很难实现标准化操作,不利于尿培养的后续实验及结果解释。临床微生物检验最大的制约因素还是在质量控制和标准化方面。在国内,最早在2006年被引入使用的是意大利Diesse公司的Robobact自动接种培养系统,仅有3家医院相继使用并报道了仪器的性能[1-3]。直到近几年,全自动微生物标本处理系统以其工作高效性在国内迅速受到关注[4-7]。目前,全球微生物流水线系统只有美国BD公司和意大利Copan公司提供,梅里埃公司只有1台Isola单机版的自动化接种仪,且其已经正式宣布退出在临床微生物自动化流水线设备上的研发和投入。2015年,BD Kiestra InoqulA作为在中国的第1台全自动标本处理系统在广州医科大学附属第三医院实验室投入使用,国内尚未有关于BD Kiestra InoqulA应用的报道。为此,本研究通过观察仪器接种分离到的单个菌落数、菌种数、总的菌落计数和阳性率,并与手工方法比对,进而对BD Kiestra InoqulA性能进行评价,现报道如下。
1 资料与方法
1.1 一般资料
收集2019年10-11月广州医科大学附属第三医院各临床科室送检的“中段尿培养、菌落计数”标本810例和“需氧+厌氧培养”的血/无菌体液阳性标本120例(瓶)。所有标本按照本实验室标本采集手册要求留取。
1.2 方法
1.2.1仪器与试剂
BD Kiestra InoqulA全自动标本处理系统、BACTEC FX血培养仪、比浊仪(美国BD公司),MALDI-TOF MS质谱仪(德国Bruker公司),CO2培养箱(香港立康),加样枪(德国Eppendorf公司);真空含防腐剂尿管、血培养瓶(美国BD公司),一次性10 μL定量接种环(英国MWE公司),9 cm血琼脂平板(江门凯林贸易有限公司);α-氰基-4羟基肉桂酸(HCCA,美国Sigma-Aldrich公司),接种培养液(美国BD公司)。
1.2.2质控菌株
大肠埃希菌ATCC25922(随广东省临床检验中心室间质评标本附送)。
1.2.3尿标本接种
将当天送检的尿标本先上机接种(Z字划线),再进行手工接种。手工接种:将尿标本颠倒混匀,开盖,用10 μL定量接种环垂直浸入尿液标本表面下3~5 mm,将标本吸至环中;在血琼脂平板上划十字,再进行密集均匀涂布。
1.2.4血/无菌体液培养阳性标本接种
75%乙醇消毒阳性培养瓶瓶口,颠倒培养瓶混匀菌液,用2 mL无菌注射器抽取2 mL菌液打入BD真空尿管里,先上机接种(四区划线),再进行手工接种。手工接种:吸取标本方法同尿接种,在血琼脂平板第一区密集均匀涂布,四区划线。
1.2.5培养及结果观察
标本接种后,把血琼脂平板放入5% CO2培养箱培养18~24 h,如遇菌落生长不良的标本培养48 h,观察菌落生长情况。930例标本皆进行仪器和手工接种比对,记录平板上可计数的单个菌落数、菌落总数(换算为cfu/mL)和菌种数。
1.2.6MALDI-TOF MS菌种鉴定
对怀疑两种或以上菌落生长的标本,作质谱鉴定,以确认菌种数。用牙签挑取单个菌落,均匀点涂到靶板上;吸取1 μL 70%甲酸涂敷到标本上;吸取1 μL HCCA基质液涂敷到标本上,待干燥后上机。
1.2.7质量控制及交叉污染试验
将ATCC25922用接种培养液制备0.5麦氏浊度的细菌混悬液,用加样枪吸取10 μL加到BD真空尿管里,再加2 mL接种培养液稀释200倍作为阳性质控,放置在仪器标本架的1号位;用无菌注射器抽取2 mL接种培养液打入BD真空尿管里,制作9管,作为阴性质控,放置在仪器标本架的2~10号位。
1.3 统计学处理
2 结 果
2.1 质控及交叉污染试验结果
阳性质控经仪器接种后,培养24 h为阳性结果,质谱鉴定为大肠埃希菌。其余9个阴性质控均未培养出细菌。
2.2 两种接种方法的单个菌落分离效果比较
930例标本中20例出现两种接种方法“阴阳不符”的情况。在未能确认是操作污染、接种能力等因素所致的情况下,只选取两种接种方法均阳性的标本进行单个菌落分离效果的比较。无论是尿液还是血/无菌体液标本,经仪器接种比手工接种分离得到更多的单个菌落,差异有统计学意义(P<0.05),见表1、图1。
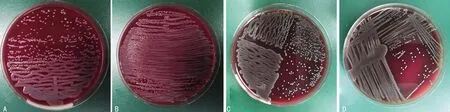
A:仪器法Z字划线(尿);B:手工法密集涂布(尿);C:仪器法四区划线(血);D:手工法四区划线(血)。
表1 两种接种方法均阳性的标本接种效果的比较个)
2.3 两种接种方法的接种阳性率比较
219例尿阳性培养标本和120例血阳性培养标本经两种接种方法接种得到一致的阳性率,均为100%。930例标本中,仪器法和手工法的接种阳性率为分别是37%和38%,两组比较差异无统计学意义(P>0.05),见表2。
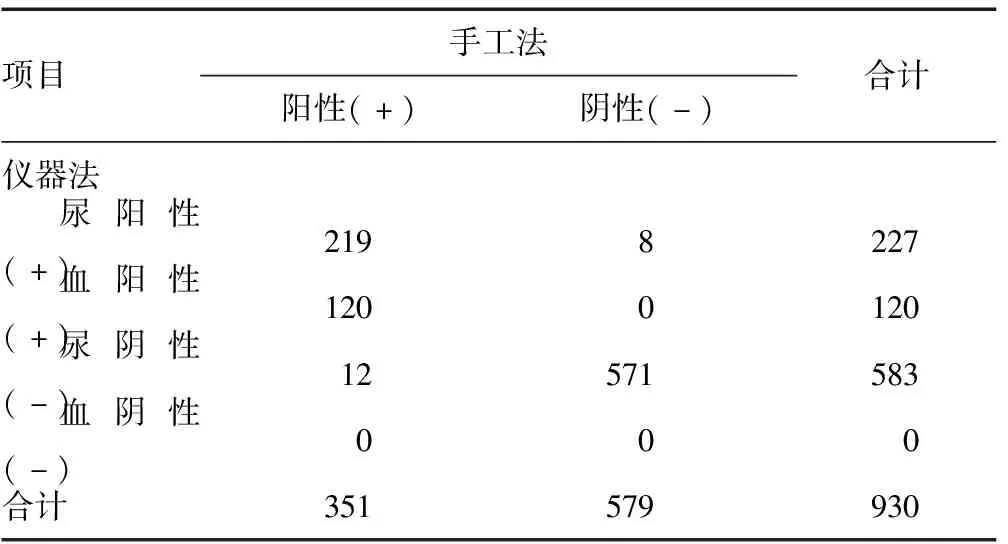
表2 930例标本两种接种方法阳性率的比较(n)
2.4 两种接种方法的尿培养结果比较
手工法接种的标本中,菌落总数大于或等于105cfu/mL和大于或等于104cfu/mL的标本都要比仪器法接种的多,菌落总数大于或等于102cfu/mL的标本却比仪器法少;从分离得到的菌种数来看,手工法接种分离到1种或大于2种菌的标本要比仪器法多,而分离到2种菌却比仪器法少,见表3。
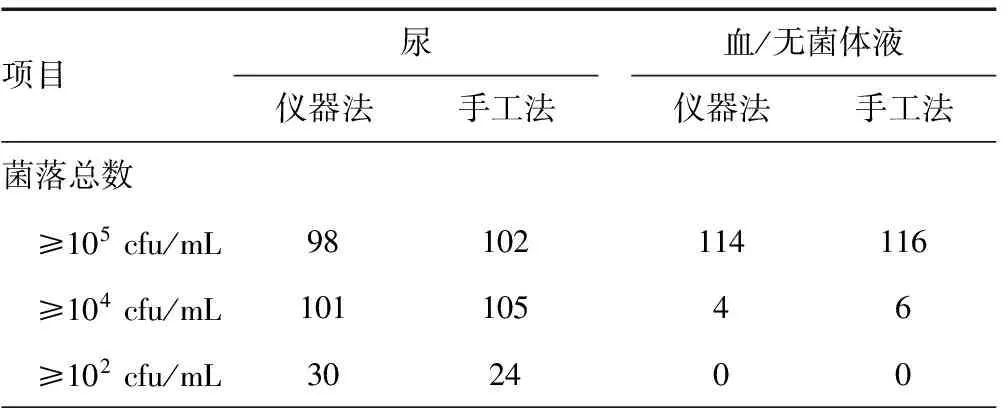
表3 两种接种方法的尿培养结果比较(n)
3 讨 论
微生物检测流程的复杂性使临床微生物实验室的自动化、智能化建设滞后于其他专业[6]。在广州医科大学附属第三医院,实习生和进修生参与了大量标本接种的工作,因人员长期轮换且水平不一,很难实现标准化的操作。接种是微生物检测流程的第一步,有无菌生长、菌落计数及菌种数直接影响检验人员对后续实验的判断。因此,确保微生物检验的质量,必须尽可能实现标准化的操作。
2015年,广州医科大学附属第三医院实验室使用我国第1台BD Kiestra InoqulA全自动标本处理系统。该仪器能通过自动识别标本类型、自动选择培养皿种类、自动贴标签、自动取样,并通过磁珠在磁场的作用下进行划线接种。近几年国内几家医院和第三方检测平台华银也陆续装上了Kiestra InoqulA,甚至包含了自动孵育系统和数字成像系统,实现了微生物检验全程自动监测。在国外,从2014年至今已有不少BD Kiestra应用的相关报道[8-10],但在国内尚无报道。FROMENT等[11]在2014年报道了BD Kiestra InoqulA在无交叉污染的情况下产生令人满意的分离效果,比手工接种分离到了更多菌种类型。MORENO等[12]研究表明BD Kiestra InoqulA比传统方法分离出更多的单个菌落。IVERSEN等[13]通过与Copan WASP对比,发现对于大于或等于105cfu/mL的尿标本,BD Kiestra有更高的分离率;在单个菌落上,后者同样拥有更出色的分离效果。CROXATTO等[14]报道BD Kiestra InoqulA对于浓度大于107cfu/mL的标本也能分离出单个菌落,且比Copan WASP和手工接种分离得到更多的菌种,同时减少了实验室的工作量与工作成本。甚至有研究发现,使用BD Kiestra InoqulA后,有更多的阴道加德纳菌和放线菌从尿标本种分离出来[15]。
本实验经仪器接种的标本所得单个菌落数远高于手工接种。图1可见无论是尿标本“Z”字型划线还是血/无菌体液四区划线,都能清晰美观地分离出不少单个菌落,避免了手工接种的参差和随意。分区划线的目的是为了分离出单个菌落,有无分出及分离的质量,直接关系后续实验的进程。本研究发现219例尿液标本经两种接种方法接种均阳性,而8例仪器法阳性而手工法阴性的标本中,6例均为菌落总数大于或等于102cfu/mL(平板上只有1个或少数几个菌落生长),对于耻骨上膀胱穿刺采集、膀胱导尿采集及经前列腺按摩后排尿采集的尿液标本,菌落总数达到大于或等于102cfu/mL需要做鉴定或(和)药敏试验[16],这或许是仪器优越性能的体现;12例仪器法阴性而手工法阳性的标本中,1例大于或等于102cfu/mL,6例大于或等于104cfu/mL,5例大于或等于105cfu/mL。不可置否的是,仪器法采用经校准的加样枪和配套带滤芯的枪头加样,和手工法的一次性定量接种环相比,其拥有更精确的加样量。加之手工加样涉及手工开关标本管、手工接种及划线分离等可能出现错误的步骤。故手工法比仪器法多出4例的阳性或许跟上述原因有关。尽管两种方法的阳性率比较,差异无统计学意义(P>0.05),但由于尿培养后续的鉴定及药敏试验跟菌落总数和菌种类别及菌种数直接相关,故保证加样量、实行标准化操作必不可少。否则,个别报告的过度药敏试验或漏报,将影响临床的诊疗决策。在分离的菌落总数和菌种数方面,其中两例标本经仪器法接种后,通过单个菌落更容易识别出有两种菌生长,挑取单个菌落质谱鉴定确认为两种菌,而手工法分不出单个菌落。对于阳性血培养来说,第一时间识别出菌种的数量和种类,方能及时把一级报告反馈给临床。假设能做到采血量准确、严格把控上机时间,那么通过标准化的标本处理得到的总菌落计数可以对血流感染的动态监测起到更准确的指导意义。
综上所述,BD Kiestra InoqulA全自动微生物标本处理系统与传统的手工接种方法相比表现出了良好的性能。同时,本实验为临床微生物实验室建立智能化管理提供了借鉴。



