王永霞,王娇娇,黄燕妮,林英姿
(海南医学院教育部热带病重点实验室,海口 571109)
单纯疱疹病毒1型(herpes simplex virus type 1,HSV-1)属于a疱疹病毒科的双链DNA病毒,人群感染普遍,是引起疱疹性口炎、咽峡炎、皮肤复发性单纯疱疹及疱疹性角膜炎的常见病原体,若累及中枢神经系统,可引起单纯疱疹病毒性脑炎(herpes simplex viral encephalitis,HSE),其是该病毒引起的最严重病变,占病毒性脑炎的2%~19%。尽管HSV-1和HSV-2均可引起HSE,但94%~96%的患者由HSV-1感染引起[1-2],未经治疗的HSE患者病死率高达80%,存活者亦可能遗留不同程度的智力障碍和肢体活动困难等后遗症[3-4]。研究发现,HSV-1颅内感染者脑组织中核因子κB(NF-κB)信号通路激活介导的炎性反应参与了脑组织病理损伤,可能是病毒包膜糖蛋白与宿主细胞Toll样受体(TLR)的结合触发了近膜端NF-κB活化的级联反应,进而激活固有免疫和适应性免疫应答,促进细胞因子、趋化因子及黏附分子的表达,加重了病毒感染后的炎性反应[5-6],因此,抑制其表达可能具有一定的抗病毒作用。
课题组前期从海南红树林中分离到一株淡紫拟青霉,其产生的胞外多糖(EPS)经体外实验证实可通过TLR调节HSV-1感染细胞的免疫功能[7],改善病毒所致的细胞病变效应,但该作用是否通过对NF-κB信号通路的调节完成有待证实。本研究拟通过颅内注射HSV-1建立小鼠感染模型,采用不同剂量的红树林淡紫拟青霉EPS经腹腔给药干预,观察其对小鼠脑组织NF-κB表达的影响。
1 材料与方法
1.1 材料
1.1.1实验动物
7周龄健康昆明种小鼠90只,体重18~22 g,SPF级,雄性,购自长沙市天勤生物技术有限公司[许可证号SCXK(湘)2014-0011]。
1.1.2主要试剂与仪器
红树林淡紫拟青霉EPS由本室制备和鉴定;HSV-1病毒液由本室保存。非洲绿猴肾细胞(Vero 细胞)购自中科院干细胞库(SCSP-520、CCL-81TM),小鼠NF-κB p65免疫组织化学试剂盒购自上海雅吉生物科技有限公司;动物组织总RNA提取试剂盒(离心柱型)购自天根生化科技(北京)有限公司;RNA保护液、逆转录试剂盒和荧光定量PCR试剂盒均购自赛默飞世尔科技(中国)有限公司。
生物安全柜(SG403A-HE)购自美国Baker公司;CO2培养箱(MCO-18AC)购自松下电器有限公司;AE2000倒置生物显微镜购自上海光学仪器厂;超声波细胞粉碎机(SCIENTZ-950E)和高通量组织研磨器均购自宁波新芝生物科技有限公司;高速冷冻离心机购自美国Beckman公司;荧光定量PCR仪购自德国Biometra GmbH公司;全自动凝胶成像分析仪(JY04S-3E)购自北京君意东方电泳设备有限公司。
1.2 方法
1.2.1病毒滴定
HSV-1于Vero 细胞中传代2次增加病毒毒力。将收获的病毒接种于已长成单层的Vero细胞中,逐日观察细胞病变情况(cytopathic effect,CPE),当CPE达“+++~++++”时收获病毒,采用Reed-Muench法滴定其半数组织感染量(50% tissue culture infective dose,TCID50)为104。本实验拟用100TCID50病毒接种小鼠。
1.2.2模型建立
将小鼠分为实验组、药物对照组、病毒对照组和阴性对照组,实验组又分为低剂量EPS组、中剂量EPS组、高剂量EPS组,每组15只。戊巴比妥钠按20 mg/kg腹腔注射,麻醉小鼠,将其固定于实验台上,微量注射器于右眼角与外耳道口连线中点处垂直进针,有突破感时停止,进针深度2~3 mm。除阴性对照组外其余组小鼠颅内分别注射100TCID50HSV-1 30 μL,阴性对照组注射DMEM 30 μL。次日低、中、高剂量实验组分别经腹腔注射红树林淡紫拟青霉EPS 6 g/kg、8 g/kg和10 g/kg,每日2次;药物对照组注射阿昔洛韦15 mg/kg,每日2次;病毒对照组和阴性对照组注射生理盐水0.2 mL,每日2次;连续注射7 d。每日观察记录小鼠进食、精神及活动状况等,对于死亡的小鼠立即开颅取其脑组织,备做免疫组织化学和RT-qPCR。
1.2.3免疫组织化学染色
EPS干预7 d后处死小鼠,无菌条件下切取左脑脑组织固定于4%多聚甲醛中,梯度乙醇脱水;二甲苯透明;石蜡包埋,制备切片。SABC法进行免疫组织化学染色,操作严格按试剂盒说明书进行。石蜡切片常规脱蜡至水,微波修复法修复抗原,3% H2O2避光孵育15 min,正常山羊血清工作液封闭20 min,NF-κB一抗用兔抗鼠NF-κB p65亚单位的多克隆抗体,稀释度1∶200,4 ℃孵育过夜,生物素标记的羊抗兔IgG室温孵育20 min,辣根过氧化物酶标记的链霉亲和素孵育20 min,DAB显色液显色1 min,苏木素复染。镜下观察细胞染色情况,阳性表达定位于细胞核,每张切片400倍下选取15个不重复的视野,Image-Pro Plus 6.0图像分析软件分析NF-κB表达情况。
1.2.4RT-qPCR检测小鼠脑组织NF-κB mRNA表达
取各组小鼠右侧枕叶脑组织20 mg,预冷PBS冲洗,立即置于RNA保护液中,脑组织匀浆制备及RNA 提取严格按照试剂盒说明书进行。提取完成后分别检测A260 和 A280,计算RNA 浓度和纯度;取各组RNA 5 μL进行琼脂糖凝胶电泳,检测RNA完整性。各组RNA按照逆转录试剂盒说明书逆转录成cDNA。 NF-κB[8]:上游引物5′-GCA TCC AAC CTG AAA ATC GTG-3′,下游引物5′-CCC CAA ATC CTT CCC AAA CTC-3′ ,由通用生物系统(安徽)有限公司合成;内参GAPDH[9]:上游引物5′-TCT TGG GCT ACA CTG AGG AC-3′,下游引物5′-TGT TGC TGT AGC CGT ATT CA -3′。反应体系:cDNA 2 μL,SYBR 10 μL,上、下游引物各0.8 μL,DEPC水6.4 μL,总共20 μL。反应条件:93 ℃ 4 min;93 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共40个循环。实验重复3次,△Ct实验组=Ct实验组目的基因-Ct实验组GAPDH,△Ct空白组=Ct空白组目的基因-Ct空白组GAPDH,△△Ct =△Ct实验组-△Ct空白组,目的基因mRNA相对表达水平以2-△△Ct表示。
1.3 统计学处理

2 结 果
2.1 各组小鼠发病及死亡情况
除阴性对照组外,接种HSV-1的小鼠次日均出现了精神萎靡、食欲减退、蜷缩、竖毛等症状,3~5 d达高峰,病毒对照组、低剂量和中剂量EPS组症状最为明显。病毒对照组小鼠死亡5只(33.3%),低剂量EPS组死亡3只(20.0%),中剂量、高剂量EPS组和药物对照组各死亡2只(13.3%),阴性对照组小鼠无死亡。病毒对照组与阴性对照组小鼠死亡率比较差异有统计学意义(P<0.05),其他组间比较差异均无统计学意义(P>0.05)。
2.2 各组小鼠脑组织免疫组织化学染色情况
低剂量EPS组、中剂量EPS组、高剂量EPS组、药物对照组、病毒对照组、阴性对照组的NF-κB表达水平分别为20.033±3.286、19.594±3.207、15.282±2.395、15.091±2.423、21.962±4.431、14.868±2.490。低剂量EPS组、中剂量EPS组、病毒对照组NF-κB表达与阴性对照组比较差异有统计学意义(P<0.05),高剂量EPS组、药物对照组与阴性对照组比较差异无统计学意义(P>0.05)。低剂量、中剂量EPS组与病毒对照组比较差异无统计学意义(P>0.05),高剂量EPS组、药物对照组与病毒对照组比较差异有统计学意义(P<0.05)。低剂量、中剂量EPS组与高剂量EPS组、药物对照组比较差异均有统计学意义(P<0.05)。低剂量与中剂量EPS组比较差异无统计学意义(P>0.05),见图1。
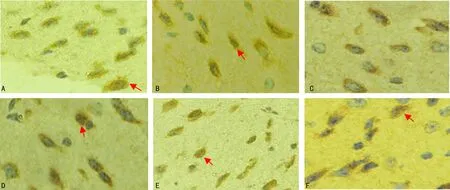
A:低剂量EPS组;B:中剂量EPS组;C:高剂量EPS组;D:药物对照组;E:病毒对照组;F:阴性对照组;红色箭头:阳性细胞染色定位于细胞核,根据染色深浅表现为棕黄至棕褐色。
2.3 RNA纯度及完整性检测
随机取3份提取的小鼠脑组织RNA,测定其A260及A280,发现其A260/A280在1.8~2.0,说明RNA纯度较高。1%琼脂糖凝胶电泳可见28 s、18 s、5 s 3条清晰条带,证明小鼠脑组织RNA完整性好,见图2。

图2 小鼠脑组织RNA完整性检测
2.4 各组小鼠脑组织NF-κB mRNA 表达
低剂量EPS组、中剂量EPS组、高剂量EPS组、药物对照组、病毒对照组、阴性对照组小鼠脑组织NF-κB mRNA表达水平分别为1.198±0.213、1.135±0.206、0.907±0.165、0.900±0.152、1.250±0.164、0.898±0.188。低剂量、中剂量EPS组、病毒对照组与阴性对照组比较差异有统计学意义(P<0.05),高剂量EPS组、药物对照组与阴性对照组比较差异无统计学意义(P>0.05)。低剂量、中剂量EPS组与病毒对照组比较差异无统计学意义(P>0.05),高剂量EPS组、药物对照组与病毒对照组比较差异有统计学意义(P<0.05)。低剂量、中剂量EPS组与高剂量EPS组、药物对照组比较差异均有统计学意义(P<0.05),低剂量组与中剂量组比较差异无统计学意义(P>0.05)。
3 讨 论
目前认为,小胶质细胞激活介导的继发性免疫损伤在HSV-1颅内感染发病中起着重要作用[10-11]。其中,NF-κB激活介导的炎性反应更为关键。HSV-1感染诱导了NF-κB激酶的活化,使NF-κB磷酸化和泛素化,活化的NF-κB游离并转位至细胞核,刺激炎性细胞因子IL-1β、TNF-α及IL-6等的分泌[12-14]。细胞因子的过度分泌介导的剧烈炎性反应参与并加重了中枢神经系统的免疫病理损伤,抑制NF-κB激活可能具有一定缓解HSV-1所致炎症损伤的作用。
本研究发现,颅内接种病毒的小鼠次日即出现倦怠、蜷缩、抽搐、毛发紊乱等症状,接种后7 d内病毒对照组小鼠死亡最多,初步表明EPS具有一定的改善病毒感染小鼠生存的作用。
免疫组织化学和RT-qPCR检测发现,各剂量EPS对NF-κB表达均有一定抑制作用,其中高剂量EPS组和药物对照组抑制作用最明显,而低剂量和中剂量EPS对其表达无明显抑制作用。以上结果表明HSV-1引起的小鼠颅内感染可导致NF-κB大量激活,红树林来源的淡紫拟青霉EPS对其激活具有一定抑制作用,且该作用呈现一定的剂量依赖性,其中高剂量EPS抑制作用明显,而低剂量和中剂量无明显抑制作用。
综上所述,红树林淡紫拟青霉EPS对小鼠HSV-1颅内感染导致的脑组织NF-κB激活表现出一定抑制作用,这可能是该EPS抗HSV-1感染的机制之一,但其作用是否通过结合TLR完成还需进一步证实。



