王丽亮,李正翔,袁恒杰
(天津医科大学总医院药剂科,天津 300052)
皮肤黑色素瘤是黑色素细胞恶变而来的肿瘤,是世界范围内致死率最高的皮肤癌[1]。据美国国家癌症研究所(National Cancer Institute,NCI)调查显示,2018年全球新发的皮肤黑色素瘤患者超过28万人,占总癌症新发病例的1.6%,这意味着每10万人中就有3例黑色素瘤患者,而全球因黑色素瘤死亡的人数超过6万,占癌症总体死亡病例的0.6%。虽然目前黑色素瘤发病率和病死率并不是特别高,但是却以6%~7%的概率逐年递增。尤其是在我国,黑色素瘤的发病率呈快速上升趋势,每年新发2万例,病死率也逐年上升[2]。尤其是晚期黑色素瘤(advanced melanoma,AM)可侵入淋巴结和其他器官,预后极差。AM(Ⅲ期或Ⅳ期)的5年生存率仅为16%,而且对于大多数标准化疗的效果很差[3]。
免疫疗法对黑色素瘤具有较强的针对性与有效性,可使患者的生存质量得到改善,与传统化疗对比具有明显治疗优势,得到了人们的广泛关注,成为黑色素瘤治疗研究的新热点[4]。免疫疗法中,细胞毒性T淋巴细胞相关抗原-4(cytotoxic T lymphocyte associated antigen-4,CTLA-4)抗体和程序性细胞死亡蛋白-1(programmed death-1,PD-1)抑制剂是现今国际上使用最多的抗黑色素瘤药物[5]。CTLA-4抗体是美国食品药品管理局(FDA)批准的第一个免疫抑制剂。CTLA-4为T淋巴细胞膜表面表达的抑制性受体,是白细胞分化抗原的一种,其可以与B7分子配体结合从而产生抑制性信号,进一步诱导T淋巴细胞无反应性,从而抑制免疫反应[6-7]。伊普利姆玛(Ipilimumab)是一种CTLA-4抗体,通过与B7分子和CTLA-4结合,增强抗肿瘤T淋巴细胞应答,从而起到治疗黑色素瘤的作用[8]。
PD-1主要在激活的T淋巴细胞和B淋巴细胞中表达,抑制细胞的进一步激活,肿瘤微环境能够引起浸润的T淋巴细胞高表达PD-1分子,肿瘤细胞还能够高表达PD-1的配体PD-L1及PD-L2,进一步导致肿瘤微环境中PD-1通路持续激活,抑制T淋巴细胞功能,使得肿瘤细胞无法被杀伤。这一通路可以被PD-1的抗体所阻断,使一部分T淋巴细胞得以恢复功能,使它们能够进一步去杀伤肿瘤细胞,从而起到治疗黑色素瘤的作用[9]。
纳武利尤单抗(Nivolumab)、帕博利珠单抗(Pembrolizumab)是PD-1抗体中的代表药物。在2015版以后的美国NCCN黑色素瘤指南中指出,PD-1抑制剂Nivolumab、Pembrolizumab均是治疗AM的第一优选药物。推荐指数优于Ipilimumab。迄今为止,在国内外的文献中,没有比较Ipilimumab与PD-1抑制剂(Nivolumab、Pembrolizumab)治疗AM的疗效与安全性的meta分析,本文从二者的有效性和安全性角度出发进行比较,以期能给临床带来更好的用药指导。
1 资料与方法
1.1 纳入与排除标准
1.1.1纳入标准
(1)研究类型:①临床上所有关于AM的随机对照试验(randomize controlled trial,RCT)的文献;②各中、英文数据库建库至2020年7月在国内外所有正式刊物己发表的文献;③以中文和英文发表的文献。(2)研究对象:经细胞学检查或病理确诊为AM的患者,患者的性别和年龄差别不计入考量范围。(3)研究的干预措施:试验组予以PD-1抑制剂(Nivolumab、Pembrolizumab)静脉注射;对照组予以Ipilimumab静脉注射。(4)结局指标:患者的总生存期(overall survival,OS)、患者的无进展生存期(progression-free survival,PFS)、药物的总体不良反应(adverse drug reaction,ADR)发生率、药物的3~5级ADR发生率。
1.1.2排除标准
(1)无法提取OS和PFS指标的文献;(2)患者同时采用PD-1抑制剂和Ipilimumab两种药物进行治疗的文献;(3)患者先后采用PD-1抑制剂和Ipilimumab进行治疗的文献;(4)文献中无明确给药时间;(5)进行动物实验的文献;(6)非RCT的文献;(7)相关病例报告、会议过程摘要、专家点评及综述:(8)重复发表的文献及质量较差的文献。
1.2 检索策略
计算机检索PubMed、EMBASE、Cochrane图书馆、维普、中国生物医学文献数据库、中国知网、万方数据等。收集比较Ipilimumab与PD-1抑制剂(Nivolumab、Pembrolizumab)治疗AM的疗效与安全性的RCT文献,检索时间为建库至2020年7月。英文的检索策略:在英文数据库中根据PICOS原则以Nivolumab、Pembrolizumab、Ipilimumab、Melanoma和randomized作为检索词进行检索。Pubmed的检索策略:Search(((((Ipilimumab) AND Melanoma) AND Pembrolizumab) AND (randomized controlled trial[Publication Type] OR randomized[Title/Abstract] OR placebo[Title/Abstract]))) OR ((((Nivolumab) AND Ipilimumab) AND Melanoma) AND (randomized controlled trial [Publication Type] OR randomized[Title/Abstract] OR placebo [Title /Abstract]))。
中文的检索策略为全部:(帕博利珠单抗)*全部:(随机和对照)*全部:(易普利姆玛)*全部:(黑色素瘤)、全部:(纳武利尤单抗)*全部:(随机和对照)*全部:(易普利姆玛)*全部:(黑色素瘤)。
1.3 文献的筛选、数据提取与质量评价
1.3.1文献的筛选
根据文献的纳入排除标准,由2位药师各自、独立地对经检索获得的文献通过中英文摘要、关键词等进行初筛,再通过全文阅读进行复筛,最终确定纳入的文献。如果出现分歧,可与第3位药师共同协商决定。
1.3.2文献的数据提取
由2位药师使用同一个提取表,各自、独立地提取相关数据,彼此核对录入的数据,所需提取的内容包括:文献的题名、第一作者、发表年份、来源、研究中的病例数、研究中的治疗方法、治疗疗程、涵盖的结局指标及基线是否可比等。对筛选过程中有分歧难以确定纳入的文献交由第3位药师决定。
1.3.3文献的质量评价
以Cochrane偏倚风险作为评估标准,由2位药师各自对已筛选纳入的文献进行分析。对Cochrane偏倚风险评估标准的6个项目进行对照,如果每一个项目均为低风险偏倚,判定该文献为低度偏倚文献;如果1~2个项目为不确定或高风险偏倚,判定该文献为中度偏倚文献;如果2个以上项目为不确定或高风险偏倚,判定该文献为高度偏倚文献。如果遇到分歧无法判定时,与第3位药师共同协商决定。
1.4 统计学处理
使用RevMan5.3软件进行数据统计分析。研究的评价指标OS和PFS采用风险比(HR)为效应分析统计量并计算其95%置信区间(95%CI);总体ADR的发生率及药物的3~5级ADR发生率为二分类变量,结果采用危险比(RR)表示效应分析统计量,并计算其95%CI。研究的异质性分析采用Chi2检验来进行,如果各研究之间无统计学上的异质性(P>0.1且I2<50%)时,使用固定效应模型进行分析;如果各研究间有统计学上的异质性(P<0.1,I2>50%),使用随机效应模型来进行分析。
2 结 果
2.1 文献筛选结果
根据检索策略,对各大数据库进行检索获得232篇相关文献,利用Endnote软件去除掉重复文献,剩余170篇文献;通过阅读文献的题目与中、英文摘要及关键词进行初筛,获得11篇文献;再通过阅读全文进行复筛,去除掉8篇文献,其中非RCT 5篇,回顾性临床研究3篇。最终将3篇文献[10-12]纳入到meta分析中,文献筛选流程见图1。
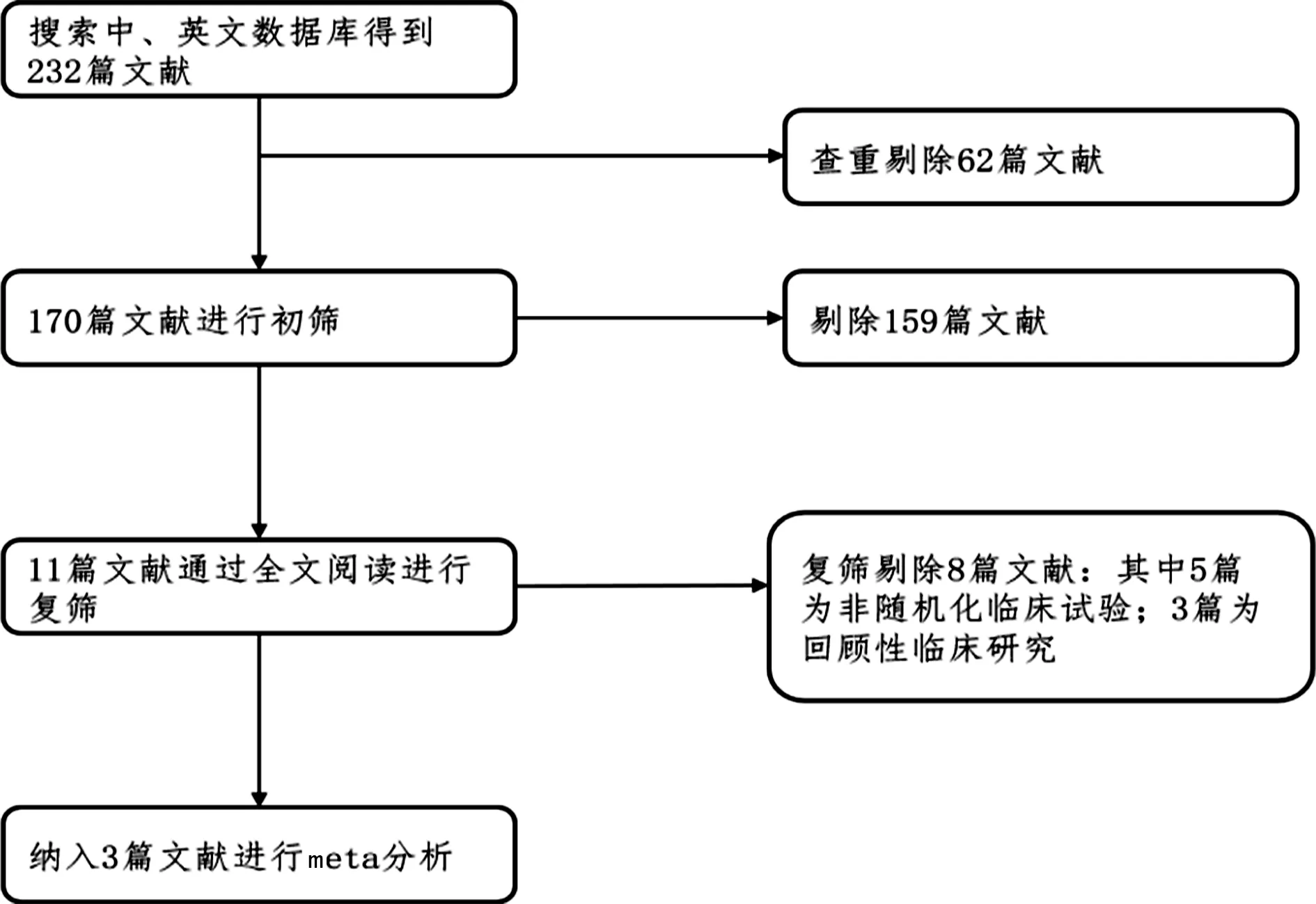
图1 文献筛选流程图
2.2 纳入文献的基本特征及方法学评价
纳入的3篇文献[10-12]均为英文文献,共2 338例AM患者,其中PD-1抑制剂治疗组1 318例、Ipilimumab治疗组1 020例,随访时间12~36个月。3篇文献由2位药师分别独立评估纳入研究的方法学质量,使用Cochrane协作工具对RCT研究进行了偏倚风险评估,见图2,所有试验均报道了2组基线资料具有可比性,详细的基本特征见表1。

图2 纳入研究偏倚风险图

表1 纳入文献的基本特征
2.3 meta分析结果
2.3.1OS
纳入的研究中2项[10-11]对AM的OS进行报道。ROBERT等[11]把555例患者分为1次/2周和1次/3周给药方式的两个亚组,并分别计算各自的OS。meta分析结果显示,PD-1抑制剂组治疗AM在提高OS上优于Ipilimumab组,差异有统计学意义[HR=0.66,95%CI(0.57,0.75),P<0.001],见表2。
2.3.2PFS
纳入的研究中2项[10-11]对AM的PFS进行报道。ROBERT等[11]把555例患者分为1次/2周和1次/3周给药方式的两个亚组,并分别计算各自的PFS。meta分析结果显示,PD-1抑制剂组治疗AM在提高PFS上优于Ipilimumab组,差异有统计学意义[HR=0.57,95%CI(0.50,0.64),P<0.001],见表2。
2.3.3总体ADR发生率
纳入的研究中3项[10-12]对总体ADR发生率进行报道。ROBERT等[11]把555例患者分为1次/2周和1次/3周给药方式的两个亚组,并分别计算各自的总体ADR发生率。meta分析结果显示,PD-1抑制剂组治疗AM总体ADR发生率与Ipilimumab组比较,差异无统计学意义[RR=1.00,95%CI(0.97,1.04),P=0.780],见表2。
2.3.43~5级ADR发生率
纳入的研究中3项[10-12]对3~5级ADR发生率进行报道。ROBERT等[11]把555例患者分为1次/2周和1次/3周给药方式的两个亚组,并分别计算各自的3~5级ADR发生率。meta分析结果显示,PD-1抑制剂组治疗AM的3~5级ADR发生率低于Ipilimumab组,差异有统计学意义[RR=0.59,95%CI(0.43,0.79),P<0.001],见表2。

表2 PD-1抑制剂治疗AM有效性和安全性的meta分析
2.3.5敏感性分析
对各指标的合并结果进行敏感性分析,逐一剔除文献后,总结果变化不大,故认为结果较稳健。
3 讨 论
免疫疗法是一类通过激活患者自身的免疫系统来杀灭肿瘤细胞的方法,是继手术、放疗、化疗等传统疗法后又一新型的肿瘤治疗手段[13]。免疫疗法自发现后,发展极为迅速。第一阶段的免疫疗法是利用缺乏靶向性的淋巴因子激活的杀伤细胞(LAK细胞)、细胞因子激活的杀伤细胞(CIK细胞)来杀灭肿瘤细胞;而第二阶段的免疫疗法是通过将树突状细胞(DC细胞)输入,从而赋予CIK细胞一定靶向性的DC-CIK来进行治疗;第三阶段则是使用基因编辑的方法来给T淋巴细胞加入能识别肿瘤细胞并激活T淋巴细胞杀死肿瘤细胞的嵌合抗体(CAR),从而起到治疗作用;随着免疫疗法精准性的进一步提升,免疫检查点抑制剂的发现预示了免疫疗法的第四阶段正式到来[14]。相较于免疫疗法的前三阶段,免疫检查点抑制剂治疗的精准性、适应性得到了临床上的广泛认可。2018年,免疫检查点抑制剂的相关研究更是获得了诺贝尔医学奖[15]。本研究选取的对照组CTLA-4抑制剂Ipilimumab与试验组PD-1抑制剂Nivolumab、Pembrolizumab均属于免疫检查点抑制剂。检索Cochrane图书馆、PubMed、Embase等各大数据库治疗AM的研究中,大多数研究是关于免疫检查点抑制剂与化疗等传统疗法之间的比较,而免疫检查点抑制剂之间的比较非常少。考虑到研究的循证证据等级,仅纳入了所有符合检索条件的RCT研究。
黑色素瘤起源于黑色素细胞,多发于皮肤表面,具有易侵袭、易转移且难以治愈的特点。虽然黑色素瘤仅占皮肤癌的4%,但黑色素瘤死亡的人数可占所有皮肤癌死亡人数的75%[16]。多数早期发现的黑色素瘤患者通过外科手术治疗是可以治愈的,但手术后有部分患者会出现复发现象,另外尚有约10%患者确诊时已经到黑色素瘤晚期,错过了外科手术最佳时机[17]。AM患者中约有1/3会发生脑转移或内脏转移,黑色素瘤转移患者对后期治疗的持续反应性大大降低[18],其中位生存期只有8~9个月,而3年生存率也仅能维持在10%~15%[19]。2011年,美国FDA批准了Ipilimumab用于治疗晚期黑色瘤,标志着黑色素瘤的免疫治疗时代正式开启。Ipilimumab对于AM患者可以产生较持久的抗肿瘤作用[20]。然而,随着Ipilimumab在临床治疗中的广泛应用,Ipilimumab耐药性的出现不可避免。随后,2014年美国FDA批准PD-1抑制剂Nivolumab与Pembrolizumab用于治疗黑色素瘤。Nivolumab可显着改善AM患者的生存质量,并且对Ipilimumab无效的患者仍有较好的反应率和安全性[21-22];Pembrolizumab可显着提高晚期黑色瘤患者的反应率,延长生存时间,并可作为Ipilimumab耐药患者替代药物[23-24]。本研究选择2种在临床上应用广泛的PD-1抑制剂,以OS和PFS为结局指标进行比较,直观评价PD-1抑制剂的有效性,为临床医生提供用药指导。本文将最能评价抗癌药物治疗效果的OS和PFS选为结局指标,是希望能够用最直观的方式评价PD-1抑制剂的有效性。
纳入的3个RCTs包括2 338例AM患者,分别对比PD-1抑制剂与Ipilimumab治疗AM的疗效与安全性。结果表明,PD-1抑制剂组在提高OS、PFS上明显优于Ipilimumab组。OS是患者随机化开始至(因任何原因)死亡的时间,提高晚期肿瘤患者的OS是临床治疗的最主要目标,也是评定某一种抗瘤药物疗效最重要的金标准。而PFS是从患者随机化开始到肿瘤发生(任何方面)进展或(因任何原因)死亡之间的时间。PFS在一定程度上可以反映晚期肿瘤患者的带瘤生存质量,也是临床治疗上高度重视的指标。证实PD-1抑制剂治疗AM比Ipilimumab更有效。PD-1抑制剂与Ipilimumab可能发生的ADR涉及人体的各大系统,包括:消化系统、血液系统、内分泌系统、呼吸系统、皮肤系统及运动系统等。2组药物治疗后患者的总体ADR发生率相似。而3~5级ADR的危害大,可能导致患者残疾、脏器衰竭,有些甚至可能先于肿瘤导致患者死亡。治疗过程中若出现这类ADR,必须暂时停药,有的甚至需要永久性停药。患者的3~5级ADR结果显示,PD-1抑制剂3~5级ADR发生率明显低于Ipilimumab组。证实PD-1抑制剂治疗AM比Ipilimumab更安全。
本研究尚存在的局限性:(1)一些文献以生存率为有效性的评价指标,由于数据无法换算而没有被录入;(2)部分文献没有描述随机方法、分配隐藏方法、盲法等,造成了一定的偏倚;(3)部分研究的随访期尚短,对结果可能会造成一定的影响;(4)PD-1抑制剂上市时间较短,相关的临床研究较少、纳入的病例数也有限。本研究结论尚需增加设计更为严格的RCT研究,加大样本量,延长随访时间加以验证。
综上所述,PD-1抑制剂治疗AM更有效、更安全。



