刘 玮,李 琳,刘佳妮,石 晶,洪 畋,陈秀娟,葛小金
(湖北省武汉市中心医院老年科 430014)
Klotho基因是KURO-O等[1]在1997年新发现的与衰老有关的基因,Klotho的基因敲除小鼠可出现类似人类衰老的各种表现,比如寿命缩短、骨质疏松、动脉硬化、皮肤萎缩等。Klotho基因位于第13号染色体上,根据基因结构的差异,可以表达分泌型Klotho及膜型Klotho两种蛋白;膜型Klotho蛋白是由全部Klotho基因编码生成的,定位于细胞膜上的一种单链跨膜蛋白,其胞外区部分可以被水解脱落从而生成分泌型Klotho蛋白。除此之外,分泌型Klotho蛋白也可由Klotho信使RNA的可变修饰来生成[2]。分泌型Klotho能与多种信号通路相互作用[3-4],参与调节机体的代谢及细胞活性等过程。研究表明,Klotho基因与动脉粥样硬化(atherosclerosis,AS)密切相关,具有一定的抗AS作用[5-9]。笔者前期的研究也发现,可溶性Klotho蛋白能够抑制THP-1泡沫细胞形成[10],但信号通路尚不明确。
激活的Wnt信号通路参与心脏发育、AS、心力衰竭、心肌肥厚和血管发育与再生等[11-12]。早在2007年国外的研究就发现,Klotho蛋白的胞外部分可结合多种Wnt配基,抑制Wnt信号通路的激活[13]。最近CHEN等[14]的研究也发现,Klotho基因可能部分通过抑制Wnt/β-catenin信号通路减少血管平滑肌细胞介导的钙化,从而发挥抗AS作用。本文探讨Wnt/β-catenin信号通路在可溶性Klotho蛋白抑制THP-1泡沫细胞过程中的作用。
1 材料与方法
1.1 材料
THP-1单核细胞株购自美国ATCC公司;佛波酯(PMA)购自美国Gene Operation公司;油红O、β-甘油磷酸二钠盐水合物购自美国Sigma公司;细胞胆固醇检测试剂盒购自南京建成生物工程研究所;TRIzol购自美国Ambion公司;β-catenin、c-myc与cyclinD1 抗体购自美国Abcam公司;β-actin 抗体购自美国CST公司;氧化低密度脂蛋白(ox-LDL)、辣根过氧化物酶(HRP)标记的羊抗兔Ⅱ抗、FITC标记的羊抗兔Ⅱ抗均购自武汉贝茵莱生物科技有限公司。
1.2 方法
1.2.1细胞培养及分组
THP-1单核细胞株按说明书进行培养和传代,加入含160 nmol/L PMA的低血清培养液,在37 ℃、5% CO2培养箱中培养48 h,观察细胞是否贴壁,确定THP-1单核细胞已诱导分化为THP-1巨噬细胞。然后加入80 mg/L ox-LDL的低血清培养液继续培养48 h,观察THP-1泡沫细胞形成[15]。将细胞分为阴性对照组(THP-1巨噬细胞组)、阳性对照组(THP-1泡沫细胞组)、Klotho蛋白组(THP-1巨噬细胞加入100 ng/L的可溶性Klotho蛋白预处理后2 h后,再按照阳性对照组程序操作)、β-甘油磷酸组(THP-1巨噬细胞经20 mmol/L的β-甘油磷酸作用24 h后,按照阳性对照组程序操作)、Klotho蛋白+β-甘油磷酸组(THP-1巨噬细胞经20 mmol/L的β-甘油磷酸作用24 h后,按照Klotho蛋白组程序操作)。
1.2.2油红O染色
各组细胞分别用4%多聚甲醛固定10~15 min,油红O染色液染色10 min后,用苏木素染液复染2~3 min,双蒸水冲洗并封片,在光学显微镜下可观察到细胞内的脂滴呈红色,而细胞核呈蓝色。
1.2.3细胞内总胆固醇(TC)、游离胆固醇(FC)和胆固醇酯(CE)水平的测定
离心法收集各组细胞,PBS漂洗3次,超声破碎细胞,采用酶荧光学法分别测定细胞内TC和FC水平。CE即为TC与FC的差值。CE与TC的比值达到50%以上的细胞可被认为已转化为泡沫细胞。
1.2.4Western blot法检测β-catenin、c-myc、cyclinD1蛋白表达
离心法收集各组细胞,加入细胞裂解液裂解细胞提取总蛋白,BCA法测定各组细胞总蛋白的浓度,9%SDS-PAGE凝胶进行电泳分离,每孔的上样量为20 μg,转膜、封闭,依次加入Ⅰ抗及HRP标记的Ⅱ抗,滴入ECL显影液进行荧光显色,将膜置于全自动化学发光分析仪中检测。实验结果采用TANON GIS软件进行分析并读取条带灰度值;将各组的β-catenin、c-myc和cyclinD1分别与相应β-actin的面积灰度值进行比较,二者的比值代表β-catenin、c-myc和cyclinD1蛋白表达水平。
1.2.5免疫荧光法检测β-catenin表达及分布
细胞爬片,多聚甲醛固定15 min,PBS充分冲洗,Triton-X 100透膜20 min,5% BSA,37 ℃封闭1 h,加Ⅰ抗稀释液,4 ℃过夜,加Ⅱ抗稀释液,37 ℃孵育1 h,4′6-二脒基-2-苯 基 吲 哚(DAPI) 孵育5 min,抗荧光淬灭剂封片。激光共聚焦显微镜观察。通过Nikon C2激光共聚焦显微镜拍照,NIS Elements AR图像系统采集分析。
1.3 统计学处理
2 结 果
2.1 各组THP-1泡沫细胞形成情况
油红O染色观察到,阴性对照组的细胞质内红色脂滴较少,而阳性对照组细胞质内可观察到较多的红色脂滴,符合泡沫细胞的形态学特征。与阳性对照组相比,Klotho蛋白组细胞质内红色脂滴数量明显减少;β-甘油磷酸组细胞内可见大量红色脂滴蓄积,细胞泡沫化程度超过阳性对照组;Klotho蛋白+β-甘油磷酸组与β-甘油磷酸组细胞相比,细胞质内红色脂滴明显减少,见图1。
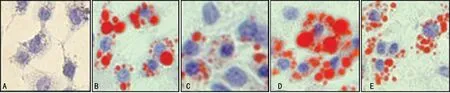
A:阴性对照组;B:阳性对照组;C: Klotho蛋白组;D:β-甘油磷酸组;E:Klotho蛋白+β-甘油磷酸组。图1 各组细胞质内脂滴的变化(×400)
2.2 各组细胞内TC、FC和CE水平
阴性对照组细胞内CE/TC<50%,而在阳性对照组中CE/TC>50%,符合泡沫细胞的生化特征。与阳性对照组相比,Klotho蛋白组细胞内TC、CE的水平均明显降低,β-甘油磷酸组细胞内TC、CE水平明显升高,差异有统计学意义(P<0.05)。与β-甘油磷酸组相比,Klotho蛋白+β-甘油磷酸组细胞内TC、CE水平明显降低(P<0.05),见表1。
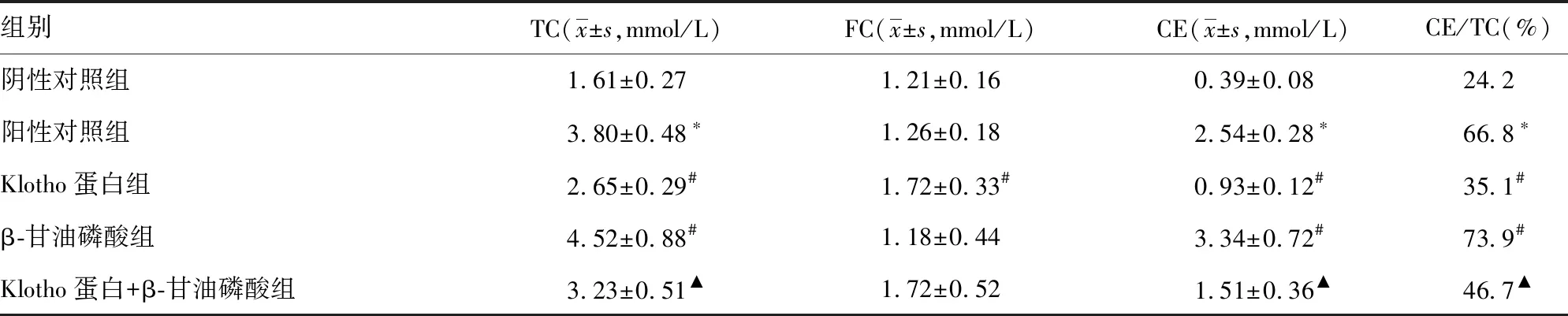
表1 各组TC、FC和CE水平
2.3 各组β-catenin、c-myc与cyclinD1蛋白表达
与阴性对照组相比,阳性对照组的β-catenin、c-myc与cyclinD1的蛋白表达水平均明显增加(P<0.05)。与阳性对照组相比,Klotho蛋白组β-catenin、c-myc与cyclinD1蛋白表达水平明显减少,β-甘油磷酸组β-catenin、c-myc与cyclinD1蛋白表达水平明显增加,差异有统计学意义(P<0.05)。Klotho蛋白+β-甘油磷酸组与β-甘油磷酸组细胞相比,β-catenin、c-myc与cyclinD1蛋白表达水平均明显减少(P<0.05),见表2、图2。
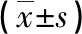
表2 各组细胞β-catenin、c-myc与cyclinD1蛋白表达
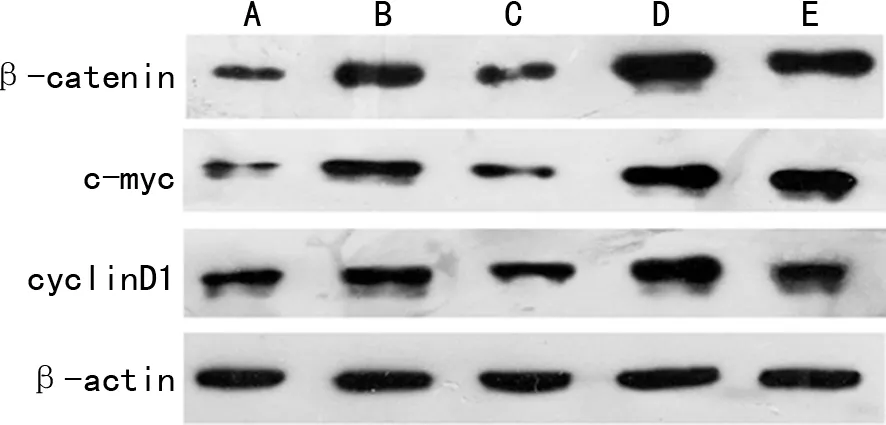
A:阴性对照组;B:阳性对照组;C: Klotho蛋白组;D:β-甘油磷酸组;E:Klotho蛋白+β-甘油磷酸组。图2 各组细胞β-catenin、c-myc与cyclinD1蛋白印迹图
2.4 各组细胞内β-catenin表达及分布情况
与阴性对照组相比,阳性对照组细胞内的β-catenin表达和分布明显增加(P<0.05)。与阳性对照组相比,Klotho蛋白组细胞内β-catenin表达和分布明显减少,β-甘油磷酸组β-catenin表达和分布明显增加,差异有统计学意义(P<0.05)。Klotho蛋白+β-甘油磷酸组与β-甘油磷酸组细胞相比,β-catenin的表达和分布明显减少(P<0.05),见图3。
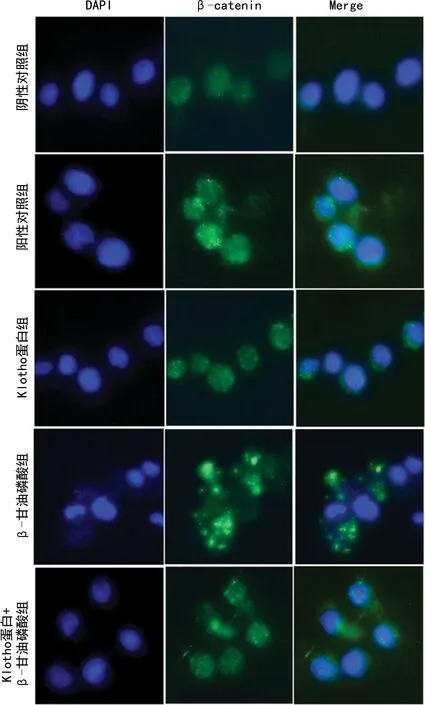
图3 各组细胞内β-catenin表达和分布(×400)
3 讨 论
近年来的研究显示,Wnt/β-catenin信号通路参与了AS的发生、发展进程。在BEDEL等[16]对人类颈动脉AS斑块的研究中发现,Wnt/β-catenin信号通路的关键分子β-catenin在破裂斑块中的表达水平明显高于稳定斑块;而在另一个颈动脉AS斑块相关的研究中发现,Wnt/β-catenin信号通路的下游靶基因产物Dickkopf相关蛋白1(DKK1)在其中的表达也是增高的[17]。证实了在人类AS病变中,Wnt/β-catenin信号通路相关分子的表达增高。而且,有研究表明DKK1是冠状动脉AS的新型生物标志物之一[18]。氧化应激在AS发生、发展过程中扮演了重要的角色,研究表明,氧化应激能激活Wnt/β-catenin信号通路,从而促进血管钙化,而阻断该通路可抑制氧化应激的产生[19]。Wnt/β-catenin信号通路还参与调节血管平滑肌细胞的增殖和迁移,其下游的转录结合因子β-catenin/TCF能抑制血管平滑肌细胞的凋亡,促进细胞增殖,引起内膜增厚,在血管重塑方面发挥重要作用[20]。上述研究表明,Wnt/β-catenin信号通路从多方面多角度深入参与了AS形成的病理生理过程。
在对衰老小鼠模型的研究中发现,Klotho基因缺失引起Wnt信号通路的激活并触发了细胞老化,说明Klotho基因对Wnt信号通路具有一定的调节作用[13]。体外实验也证实,可溶性Klotho蛋白对心肌细胞和RTC细胞的Wnt/β-catenin信号通路具有抑制作用[21-22]。在阿霉素诱导肾损伤模型中,随着肾损伤时间的延长,肾组织可溶性Klotho蛋白表达逐渐减少,而β-catenin的表达却逐渐增多,且二者呈负相关;进一步分析发现,可溶性Klotho蛋白一方面能与免疫标记的Wnt1、Wnt4或Wnt7a等结合形成复合物;另一方面Klotho基因也直接抑制了β-catenin的核内移位[23],说明Klotho基因可能通过干扰Wnt和β-catenin的作用使经典的Wnt/β-catenin信号通路失活。
笔者前期的研究表明,外源性可溶性Klotho蛋白可能通过调控THP-1巨噬细胞内ACAT1及ABCA1的表达,减少细胞内CE的蓄积,增加胆固醇的流出,从而抑制THP-1泡沫细胞形成[10],但其中的信号通路并不清楚。本研究显示:可溶性Klotho蛋白能下调Wnt/β-catenin信号通路关键分子β-catenin、c-myc与cyclinD1蛋白表达,而Wnt/β-catenin信号特异性激动剂β-甘油磷酸能阻断或部分阻断可溶性Klotho蛋白对THP-1泡沫细胞形成的抑制。而且,细胞免疫荧光染色观察到,可溶性Klotho蛋白能抑制THP-1泡沫细胞内β-catenin的分布和表达。说明可溶性Klotho蛋白能抑制泡沫细胞形成过程中Wnt/β-catenin信号通路的活化。
综上所述,可溶性Klotho蛋白可能通过抑制Wnt/β-catenin信号通路的激活,减少细胞内CE的蓄积,从而抑制泡沫细胞的形成。



