潘海霞,冼佩宜,张春仁,林 菡,何晓莹,唐慧珍,赖毛华△
(1.广州医科大学附属第一医院中西医结合临床妇科,广州 510120;2.广州中医药大学第三附属医院中医妇科,广州 510120)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是一种常见的妇科内分泌代谢紊乱性疾病,据报道,育龄妇女中PCOS的患病率为6%~10%[1],具有高度异质性、发病多因性、表现多态性的特点。临床主要表现为闭经、多毛、肥胖、高胰岛素血症、高雄激素血症、不孕,超声显示多囊卵巢等[1]。文献报道,75%的PCOS患者表现为无排卵性不孕[2],卵泡发育障碍是导致PCOS不孕的主要原因。因此,探究PCOS卵泡发育障碍的机制对提高PCOS患者的生育力具有重要意义。
水通道蛋白(aquaporins,AQPs)是一组存在于细胞膜上的小分子蛋白家族,可使细胞膜对水的通透性增加,对维持细胞内外的水平衡意义重大。目前在哺乳动物中鉴定出13种AQPs(AQP0~12)亚型。AQP0、1、2、4、5、6和8对水的通过具有高度的选择性,而AQP3、7、9和10不仅运输水,还运输中性溶质,包括甘油、尿素和其他小的非电解质[3]。WAWRZKIEWICZ等[4]认为AQPs可能参与了PCOS的发生,其表达的变化可能影响PCOS的卵泡发育和卵泡闭锁。QU等[5]发现PCOS患者颗粒细胞的细胞核、细胞质和细胞膜中存在 AQP9,PCOS组的AQP9表达水平明显低于正常组,AQP9与卵泡液的雄激素水平有明显的相关性。SONG等[6]发现PCOS患者颗粒细胞AQP9基因和蛋白表达水平较低,AQP9的表达水平与胰岛素调节呈负相关,胰岛素可能通过改变AQP9的表达影响PCOS卵泡的成熟。因此,推测AQP9可能参与了PCOS的卵泡发育障碍的发生,但确切的机制尚不清楚。
本研究主要通过来曲唑灌胃建立PCOS大鼠模型,采用免疫组织化学和Western blot观察AQP9在卵巢组织中的定位及蛋白的表达,为进一步探讨AQP9与PCOS卵泡发育的关系提供理想的动物模型,现报道如下。
1 材料与方法
1.1 材料
SD雌性大鼠12只,6周龄,超级清洁(SPF)级,体重(155±10)g,购自广东省动物实验动物中心。自由摄取食物和水,温度20~22 ℃,湿度60%~65%,控制12 h光照、12 h黑暗环境循环,喂食标准饲料。本研究获得广州医科大学动物科学学院伦理委员会批准。
1.2 方法
1.2.1PCOS模型的建立
12只SD雌性大鼠,分为正常组与模型组,每组6只。模型组参考文献[7]的造模方法,每天予来曲唑(1 mg/kg)溶于0.5%羧甲基纤维素(CMC,2 mL/kg)灌胃,构建PCOS模型;正常组每天灌胃0.5% CMC(2 mL/kg),连续21 d。
1.2.2标本处理
最后1次灌胃后,称重,两组大鼠晚8时开始禁食,次日晨8时尾静脉采血,用葡萄糖氧化酶法测空腹血糖(罗氏血糖仪),然后异氟烷气体麻醉后进行心脏采血,3 000 r/min离心15 min,-80 ℃冻存用于进一步测试,最后断颈处死大鼠,摘取双侧卵巢,去除表面脂肪组织观察两组大鼠卵巢大体解剖情况,称重并记录后,一侧浸泡在4%的多聚甲醛中进行固定以便后续的组织病理分析,一侧卵巢放在冻存管中,以便后续的蛋白和基因的检测分析。
1.2.3观察指标
1.2.3.1大鼠体重、阴道涂片及卵巢质量
每天灌胃之前对大鼠进行称重,且记录数据。灌胃第10天开始对模型组大鼠进行阴道涂片,阴道涂片两个动情周期(10 d),使用瑞氏-吉萨姆进行染色,通过分析白细胞、上皮细胞和角化细胞的相对比例来监测动情周期。吸入麻醉处死大鼠后,称重双侧卵巢,左、右卵巢的质量计算卵巢质量。
1.2.3.2性激素及糖代谢检测
使用ELISA法进行血清中黄体生成素(LH)、促卵泡生成素(FSH)、雄激素、雌二醇和空腹胰岛素测定,罗氏血糖仪测空腹血糖。计算LH/FSH和胰岛素抵抗指数(HOMA-IR),HOMA-IR=(空腹胰岛素×空腹血糖)×22.5。
1.2.3.3卵巢组织学改变
在解剖镜下剥除卵巢外周脂肪,观察卵巢大体解剖情况。卵巢用4%多聚甲醛固定,进行常规石蜡包埋、切片及苏木素-伊红(HE)染色,光镜下观察其形态学改变。
1.2.3.4免疫组织化学检测
按照试剂说明书,石蜡包埋,蜡块做5 μm的切片,将玻片置于60 ℃恒温箱烤30 min,二甲苯脱蜡,梯度乙醇脱水。3%过氧化氢溶液10 min灭活内源性过氧化物酶。微波修复抗原。滴加5%牛血清,38 ℃下孵育10 min,倾去勿洗。滴加一抗兔抗大鼠AQP9(美国Santa Cruz公司),4 ℃过夜,磷酸盐缓冲液(PBS)冲洗5 min,3次。滴加对应生物素标记的二抗,37 ℃下孵育30 min,PBS冲洗。滴加SABC,37 ℃下孵育20 min,PBS冲洗。DAB显色:除去PBS,每张切片加新鲜配制的DAB溶液显色,自来水冲洗。梯度乙醇脱水、二甲苯透明,中性树胶封片。
1.2.3.5Western blot
按照试剂说明书,将100 mg的卵巢组织放入0.6 mL裂解液(RIPA∶PMSF=100∶1,v/v)中裂解,用冰冻露卡匀浆机强力粉碎。匀浆于4 ℃、1 200 r/min离心20 min。转移并收集上清液用于蛋白分析。每个样品的蛋白浓度采用BCA蛋白测定试剂盒(南京建成生物工程研究所)测定。随后,将提取的样品煮沸10 min,-80 ℃保存待分析。负载蛋白(50 g)电泳,在10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)上分离,然后转移到聚偏二氟乙烯(PVDF)膜(0.22 m,美国Pall公司)。PVDF膜在5%脱脂牛奶中室温封闭2 h,然后用不同的一抗孵育4夜,包括抗AQP9 (美国Santa Cruz公司)和抗β-actin(美国Abcam公司)。一抗一般用TBST (Tris-HCl 5 mmol/L,pH 7.6,NaCl 136 mmol/L,0.05% Tween-20) 1∶1 000稀释。洗后TBST 3次,再与辣根过氧化物(HRP)结合二抗(1∶5 000稀释TBST)孵育2 h,与一抗结合。Western blot采用增强化学发光法(ECL)。图像采用Bio-Rad进行采集,Image-J软件进行密度测定分析。
1.3 统计学处理
2 结 果
2.1 两组体重、卵巢质量和阴道涂片比较
与正常组比较,模型组体重和卵巢质量明显增加,差异有统计学意义(P<0.05),见图1、2。正常组具有规律的动情周期,模型组则几乎处于以白细胞为主的动情间期,见图3。
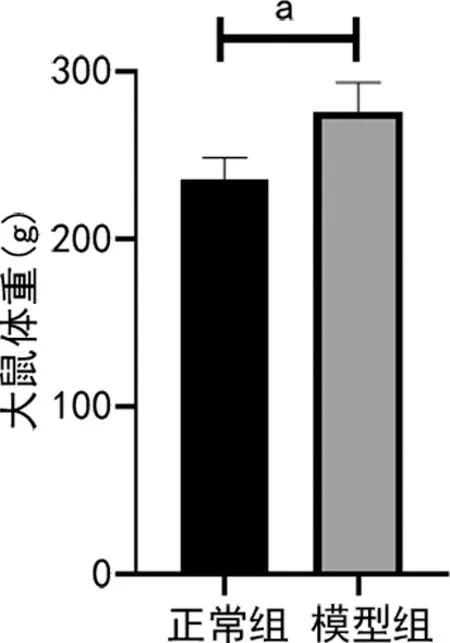
a:P<0.05。
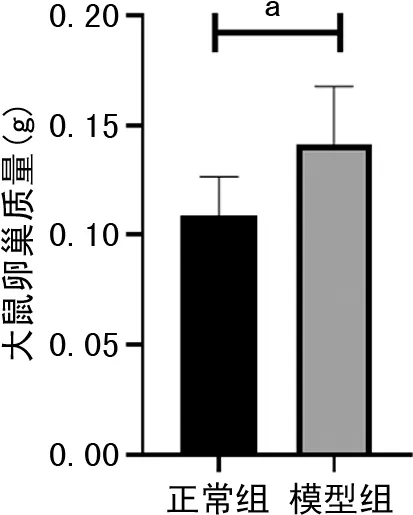
a:P<0.05。
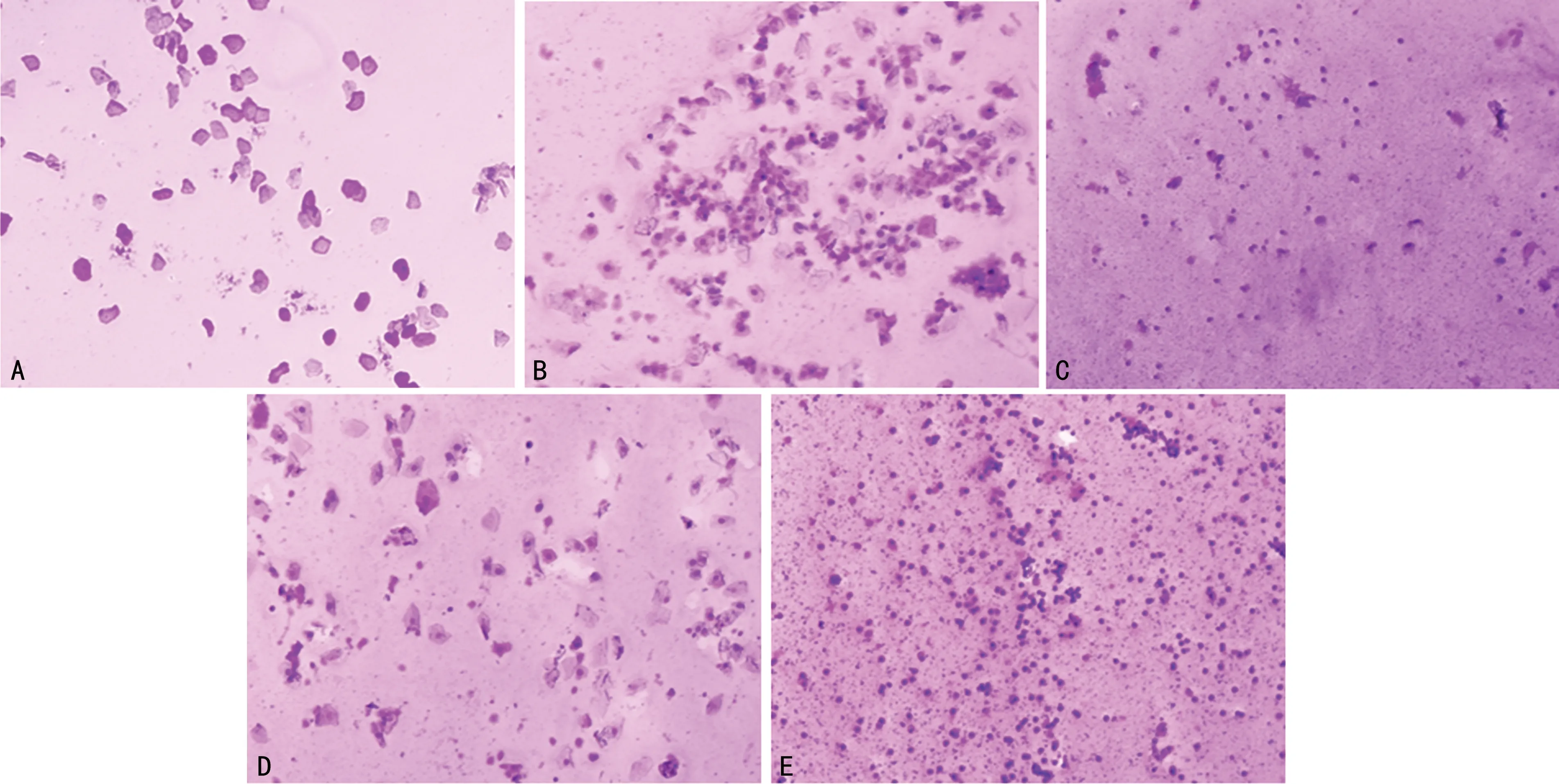
A:正常组动情期;B:正常组动情前期;C:正常组动情间期;D:正常组动情后期;E:模型组动情间期。
2.2 两组血清性激素及糖代谢指标比较
与正常组比较,模型组LH、LH/FSH、雄激素、空腹胰岛素和HOMA-IR水平升高,FSH和雌二醇水平降低,差异有统计学意义(P<0.05),见表1。

表1 两组血清性激素及糖代谢指标比较
2.3 卵巢组织学改变
正常组卵巢色泽红,表面光滑,卵巢结构清晰,可见不同发育阶段的卵泡,多个黄体,颗粒细胞呈多层,形态完整,排列整齐。模型组卵巢形态苍白,可见较多的早期发育小卵泡及闭锁卵泡,有较多扩张的囊泡,卵泡内卵母细胞消失,卵巢颗粒细胞层数减少,卵泡膜细胞增生,黄体数量明显下降,见图4。
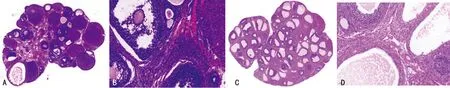
A:正常组,×20;B:正常组,×200;C:模型组,×20;D:模型组,×200。
2.4 两组卵巢AQP9蛋白免疫组织化学染色情况
两组卵巢颗粒细胞、卵泡膜细胞、黄体细胞及间质细胞均可见AQP9蛋白表达,但以颗粒细胞较明显,主要位于细胞膜和细胞质中,呈棕黄色,模型组大鼠卵巢颗粒细胞 AQP9蛋白的表达较正常组降低,见图5。
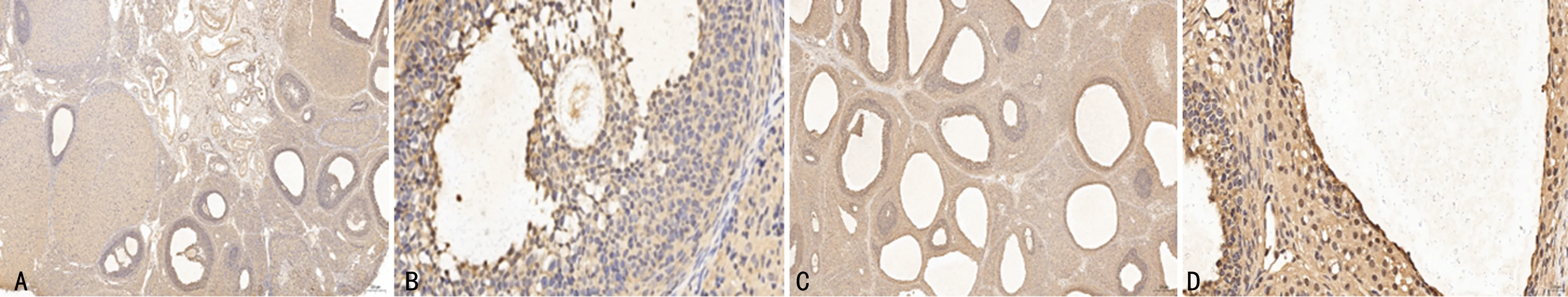
A:正常组,×50;B:正常组,×400;C:模型组,×50;D:模型组,×400。
2.5 两组卵巢 AQP9 蛋白表达情况
模型组AQP9蛋白表达水平较正常组减少,差异有统计学意义(P<0.05),见图6。
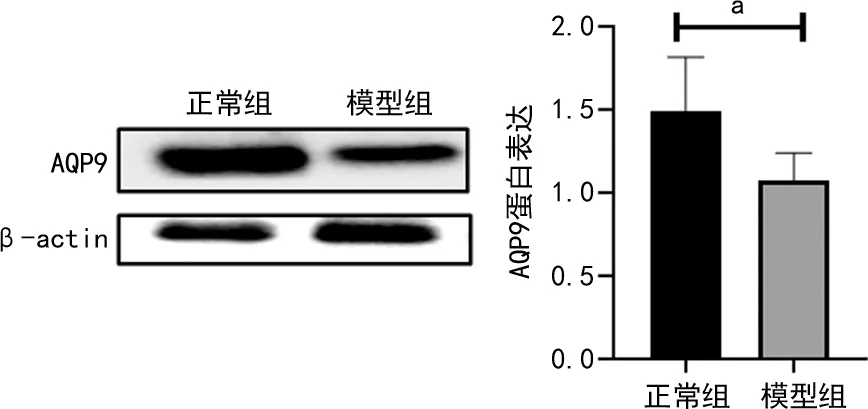
a:P<0.05。
3 讨 论
来曲唑是一种高选择性非甾体类芳香化酶抑制剂,通过抑制它的底物芳香化酶阻断雄激素向雌激素的转换,降低雌二醇浓度,升高雄激素,导致无排卵[8]。本研究PCOS大鼠模型组特征与前期研究利用来曲唑灌胃法成功构建 PCOS 大鼠模型报道相似[7,9]。因此,本实验采用来曲唑诱导的大鼠模型无论是内分泌、代谢紊乱方面,还是从卵巢解剖及组织学方面均与人类PCOS特征相似,是研究PCOS机制的理想动物模型。
卵泡发育历经原始卵泡、窦前卵泡、窦卵泡,最终成为成熟卵泡这一系列过程中,卵泡液的形成及卵泡窦腔的扩大有着极其重要的地位[10]。窦卵泡主要是通过颗粒细胞上的水通道实现水的转运,在卵泡发育过程中形成卵泡液,最终成为成熟卵泡[11]。在卵泡发育过程中,AQP9主要表达于窦状卵泡的颗粒细胞中[11],其参与了颗粒细胞的水转运,可能与卵泡发育有关[12]。SALES等[13]研究认为 AQP9在卵泡的发育中起着重要的作用。RIBEIRO等[12]对小鼠进行超促排探究卵泡发育,过程中发现AQP9在卵泡快速发育阶段表达明显增加,且对AQP9进行抑制发现卵泡体积明显变小、排卵数减少,推测AQP9在卵泡腔迅速形成过程中促进了水和其他物质的大量纳入,为卵泡的进一步发育和成熟提供了环境和物质基础。
在PCOS患者卵巢内存在大量的窦前卵泡、少数窦状卵泡、众多的闭锁卵泡、滤泡囊肿和变性的囊肿。这些卵泡缺乏足够多的成熟颗粒细胞,不能产生大量的雌激素,最终导致排卵障碍。另一方面,卵巢间质和卵泡膜组织增生持续产生雄激素[14-15]。有研究报道,PCOS患者卵巢组织AQP9 mRNA表达明显降低[2]。AQP9的表达可能是受雄激素调控[16]。一项临床研究发现PCOS患者颗粒细胞中AQP9表达水平降低,这一改变可能与卵泡液中高雄激素有关,雄激素可降低颗粒细胞中AQP9基因和蛋白表达[5]。另一项研究也支持这个观点,通过在母猪的卵巢进行免疫组织化学定位发现,AQP9主要在正发育的颗粒细胞中表达,研究结果提示颗粒细胞中雄激素转换为雌激素可能需要通过AQP9转运的物质来实现[17]。此外,SONG等[6]发现AQP9广泛分布在PCOS卵巢组织,PCOS壁层颗粒细胞和卵丘颗粒细胞中均有AQP9基因及蛋白质,PCOS患者卵巢颗粒细胞AQP9的表达水平明显下降。胰岛素可能通过改变AQP9基因的表达,PCOS 卵巢局部高雄激素和高胰岛素可使颗粒细胞增殖能力下降,从而导致其卵巢内形成较多的初级卵泡,引起卵泡发育障碍[18-19]。推测过高的胰岛素水平和雄激素可能会损害颗粒细胞的增殖功能,导致AQP9的低表达,从而引起卵泡发育障碍,这为探讨PCOS患者的发病机制提供了一个潜在的新思路和治疗的新靶点。本研究表明PCOS大鼠模型卵巢AQP9主要表达在卵巢颗粒细胞,定位在细胞膜和细胞质,AQP9蛋白表达水平较正常组降低,这些特征符合PCOS患者在卵巢的表达特征。
综上所述,来曲唑诱导的 PCOS 大鼠模型是符合 PCOS 病理生理机制的理想动物模型。本实验通过免疫组织化学和Western blot测定了PCOS大鼠卵巢AQP9的定位和蛋白的表达特点,但AQP9影响PCOS卵泡发育及卵母细胞成熟的机制仍需进一步研究。



