徐 杨,王纬臻,周亚峰,3△
(1.苏州大学附属第一医院心血管内科 310006;2.同济大学附属上海市第四人民医院药剂科 200434;3.苏州大学附属独墅湖医院 215000)
高脂血症(hyperlipidemia,HLP)是一种临床常见病,主要由体内脂质代谢紊乱或者运转异常导致,以血浆总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)和低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)其中一种或多种高于正常水平为主要特征。近年来,随着人们饮食结构的改变,HLP发病率明显上升,且青少年高TG血症发病率也明显上升[1]。HLP与心脑血管类疾病关系密切,如何调节脂质代谢异常成为预防与治疗HLP及其慢性并发症的重要环节。临床治疗HLP多采用他汀类药物,但他汀类药物只能降低20%~35%的LDL-C,且存在增加患者不耐受的风险[2],所以寻找安全可靠的降脂药物迫在眉睫。藤茶是我国特有的药用植物,富含二氢杨梅素等黄酮类物质,具有降糖降脂、保肝护肝、抗菌、抗氧化、抗肿瘤等作用,对于调节血脂水平有良好效果[3-4]。临床上藤茶常用来治疗炎症、脂肪肝、肿瘤、糖尿病等疾病,但其调节血脂的作用机制报道较少。本研究通过建立HLP大鼠模型,观察藤茶黄酮对大鼠血脂的影响,旨在为藤茶降血脂药物的开发和应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1实验动物
SD雄性大鼠60只,超级清洁(SPF)级,7周龄,体重(250±20)g,购自北京维通利华实验动物技术有限公司,生产许可证号:SCXK(京)2016-0006,使用许可证号:SYXK(京)2017-0022。动物实验获得动物伦理委员会的批准(IACUC号:201801260019),符合3R原则。大鼠购入后自由饮食、饮水,保持温度22~24 ℃,湿度65%~80%,适应性饲养7 d。
1.1.2药物、试剂和仪器
藤茶黄酮提取物(88.76%,其中二氢杨梅素占89.56%,杨梅素占3.31%,张家界茅岩莓有限公司),洛伐他汀片(批准文号:国药准字H37020089,20 mg,山东鲁抗医药股份有限公司),兔抗大鼠腺苷酸活化蛋白激酶α(AMP activated protein kinase,AMPKα)、磷酸化腺苷酸活化蛋白激酶α(phospho-AMP-activated protein kinase,phospho-AMPKα)、肝激酶B1(liver kinaseB1,LKB1)、磷酸化肝激酶B1(phospho-liver kinase B1,phospho-LKB1)多抗(英国Abcam公司),辣根过氧化物酶标记的山羊抗兔IgG抗体(美国Cell Signaling Technology公司),TC、TG、LDL-C和高密度脂蛋白胆固醇(high densitylipoprotein-cholesterol,HDL-C)试剂盒(中生北控生物科技股份有限公司),超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测试盒(南京建成生物工程研究所),7100全自动生化分析仪(日本Hitachi公司),5804R大容量冷冻离心机(德国Eppendorf公司),Spectra Max190酶标仪(美国Molecular Device公司),电泳仪(美国Bio-Rad公司),高脂饲料(北京科奥协力饲料有限公司)。
1.2 方法
1.2.1HLP大鼠模型的建立
60只大鼠取10只作为正常对照组,饲喂普通饲料。参照文献[5],其余50只大鼠建立HLP模型,建模大鼠给予高脂饲料,饲喂前尾静脉取血检测TC、TG、LDL-C、HDL-C水平,连续喂养30 d后,建模大鼠禁食12 h,第2天尾静脉取血检测TC、TG、LDL-C、HDL-C水平,与饲喂高脂饲料前比较,TC、TG、LDL-C至少一种升高50%,提示模型成立。建模成功大鼠(47只,剔除升高不达标大鼠3只)分为模型组10只、TC-L组10只、TC-M组9只、TC-H组9只、阳性对照组9只。整个实验过程所有大鼠均给予正常饮食、饮水。
1.2.2给药方法
建模成功24 h后,尾静脉取血检测各组大鼠TC、TG、LDL-C和HDL-C水平。之后进行药物干预,大鼠给药用量根据文献[6],藤茶黄酮用80%甲醇超声溶解后分别配成10、20、40 mg/mL的混悬液备用;洛伐他汀片用生理盐水配制成终浓度2 mg/mL的溶液备用;TC-L组、TC-M组、TC-H组分别按照对应浓度按10 mL/kg灌胃藤茶黄酮混悬液,阳性对照组按10 mL/kg灌胃洛伐他丁溶液,正常对照组及模型组按10 mL/kg灌胃生理盐水,每天1次,连续4周。
1.2.3血脂四项检测
末次给药后禁食12 h,腹腔注射质量分数1%戊巴比妥钠进行麻醉,心脏采血,3 500 r/min离心10 min,分离血清备用。取血清20 μL采用酶法用全自动生化分析仪测定TC、TG、LDL-C和HDL-C水平。
1.2.4血清MDA、SOD和GSH-Px检测
取血清20 μL,检测MDA、SOD和GSH-Px水平,其中MDA采用硫代巴比妥酸法,SOD采用连苯三酚自氧法,GSH-Px采用NADPH耦联法,操作步骤严格按照试剂盒说明书。
1.2.5肝组织AMPKα和LKB1 mRNA表达检测
采血完毕后,处死各组大鼠,取右肝液氮保存备用。取液氮保存的肝组织80 mg,采用Trizol法提取肝组织总RNA,测定总RNA的浓度和纯度。用逆转录试剂盒逆转录cDNA。反应体系:2 μL目的基因引物,2 μL cDNA模板,10 μL Taq DNA聚合酶,加双蒸水至总体积20 μL。反应条件:95 ℃预变性5 min,95 ℃变性10 s,65 ℃退火10 s,70 ℃延伸5 s,共40个循环。以β-actin为内参基因,最终读取CT值,按照公式2-ΔΔCT计算目的基因的相对表达水平。引物序列见表1。
1.2.6肝组织AMPKα、phospho-AMPKα、LKB1和phospho-LKB1蛋白表达检测
取液氮保存的肝组织100 mg,加入组织蛋白抽提液匀浆处理,冰上孵育20 min,离心取上清液;BCA法检测蛋白浓度。蛋白变性上样进行聚丙烯酰胺凝胶电泳,电转至PVDF膜;洗膜,5%脱脂牛奶摇床孵育2 h,加入一抗AMPKα(1∶1 000)、phospho-AMPKα(1∶1 000)、LKB1(1∶1 000)、phospho-LKB1(1∶1 000)、β-actin(1∶4 000)4 ℃封闭过夜;洗膜,加入辣根过氧化物酶标记的二抗,室温下摇床孵育1 h,洗膜,采用ECL试剂进行显色反应,暗室下曝光成像。通过Image J软件分析图像,以内参β-actin蛋白条带为对照,以目的条带与β-actin条带灰度的比值作为目的蛋白的相对表达水平。

表1 引物序列
1.3 统计学处理
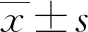
2 结 果
2.1 血清TC、TG、LDL-C、HDL-C水平比较
与正常对照组比较,模型组TC、TG、LDL-C水平升高,HDL-C水平降低,差异有统计学意义(P<0.05);与模型组比较,TC-L组、TC-M组、TC-H组及阳性对照组TC、TG、LDL-C水平降低,HDL-C水平升高,差异有统计学意义(P<0.05);藤茶黄酮各组TC、TG、LDL-C、HDL-C水平变化呈剂量依赖性(P<0.05),见表2。
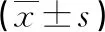
表2 各组大鼠血清TC、TG、LDL-C、HDL-C水平比较
2.2 血清MDA、SOD、GSH-Px水平比较
与正常对照组比较,模型组MDA水平升高,SOD、GSH-Px水平降低,差异有统计学意义(P<0.05);与模型组比较,TC-L组、TC-M组、TC-H组及阳性对照组MDA水平降低,SOD、GSH-Px水平升高,差异有统计学意义(P<0.05);藤茶黄酮各组MDA、SOD、GSH-Px水平变化呈剂量依赖性(P<0.05),见表3。
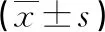
表3 各组大鼠血清MDA、SOD、GSH-Px水平比较
2.3 肝组织AMPKα、LKB1 mRNA表达比较
各组肝组织AMPKα、LKB1 mRNA表达比较,差异无统计学意义(P>0.05),见表4。
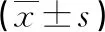
表4 各组大鼠肝组织AMPKα、LKB1 mRNA表达比较
2.4 肝组织AMPKα、phospho-AMPKα、LKB1及phospho-LKB1蛋白水平比较
与正常对照组比较,模型组phospho-AMPKα、phospho-LKB1蛋白表达降低,差异有统计学意义(P<0.05);与模型组比较,TC-L组、TC-M组、TC-H组及阳性对照组phospho-AMPKα、phospho-LKB1蛋白表达升高,差异有统计学意义(P<0.05);藤茶黄酮各组phospho-AMPKα、phospho-LKB1蛋白表达变化呈剂量依赖性(P<0.05)。AMPKα、LKB1蛋白表达组间比较,差异无统计学意义(P>0.05),见表5、图1。
表5 各组大鼠肝组织AMPKα、phospho-AMPKα、LKB1、phospho-LKB1蛋白表达比较
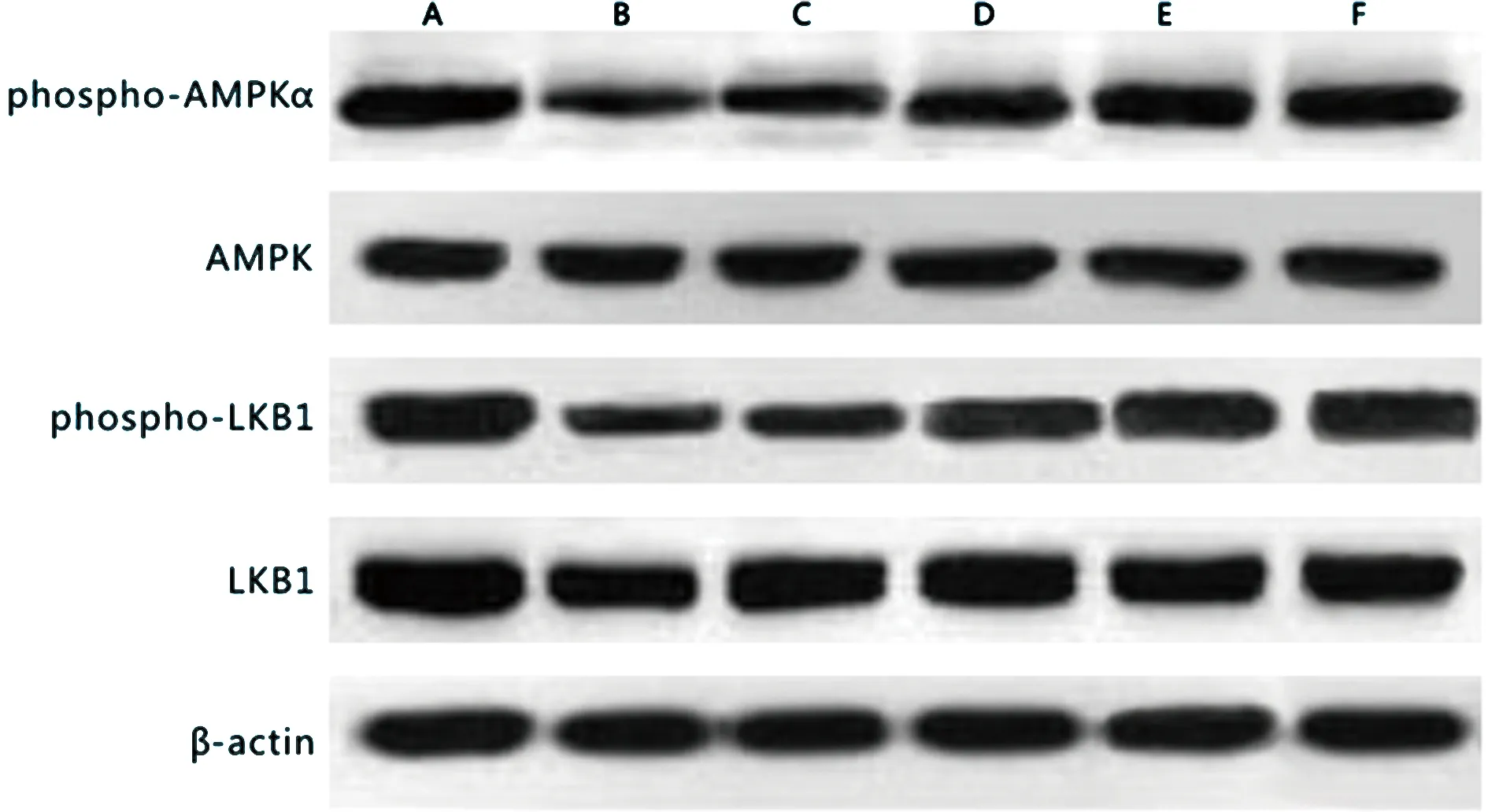
A:正常对照组;B:模型组;C:TC-L组;D:TC-M组;E:TC-H组;F:阳性对照组。
3 讨 论
HLP可引发多种疾病,TG和LDL-C升高在动脉粥样硬化性心血管病(atherosclerotic cardiovascular disease,ASCVD)的发生、发展过程中起着关键作用,与心脑血管疾病关系密切[7-8]。血脂沉积,巨噬细胞吞噬脂质形成泡沫细胞,逐渐发展为斑块,堵塞血管,影响血液循环,促进内皮细胞自由基释放,引起动脉壁抗氧化功能下降,导致ASCVD发生,故血脂异常患者进行调脂治疗对于降低和减少ASCVD发生、发展,维持心血管健康及延长寿命有着积极的意义[9-10]。中药黄酮类化合物具有显着的降血脂和抗氧化作用,且安全性可靠。藤茶的黄酮含量在目前被研究的植物中居首位,还含有维生素、氨基酸、蛋白质和矿物质等多种营养成分,在我国民间有着非常悠久的使用历史,常用来预防和治疗感冒发热、高血压、高血糖、心脑血管疾病[11]。
动物实验研究表明,藤茶可降低血清TC水平,减少脂质蓄积,有效预防和改善HLP及高血糖症等代谢性疾病[12]。另有研究发现,藤茶黄酮能显着降低小鼠血脂水平,维持体内糖脂代谢平衡[13]。本研究经过高脂饲料诱导后,造模大鼠血清TC、TG和LDL-C水平显着升高,建立了典型混合型HLP模型;干预后,藤茶黄酮各剂量组血清TC、TG、LDL-C水平降低,HDL-C水平升高,各剂量组高脂血症均有不同程度的改善,且以TC-H组改善最显着,提示藤茶黄酮能有效改善HLP模型大鼠血脂水平,对HLP的脂质代谢紊乱有调节作用,有显着降血脂作用。
MDA、SOD和GSH-Px能够反映机体抗氧化酶体系功能状态,MDA作为脂质过氧化物的产物,反映脂质过氧化程度;SOD可减轻过氧化物引起的氧化损伤,提高机体抗氧化能力;GSH-Px通过催化谷胱甘肽还原体内有害的过氧化物来保护细胞。本研究中,藤茶黄酮各剂量组能够显着降低MDA水平,提高SOD、GSH-Px水平,且以高剂量组作用最显着,提示藤茶黄酮可以降低脂质过氧化,提高机体抗氧化能力。YE等[14]研究显示,藤茶提取物及其主要成分二氢杨梅素在豆油和牛肉中具有明显的抗氧化活性。ZHANG等[15]发现藤茶提取物可以抑制猪肉中脂质和蛋白质氧化,具有明显的自由基清除活性。本研究得出相似结果,提示藤茶黄酮可以有效降低脂质过氧化,减少氧化损伤,提高机体抗氧化能力。
AMPK是一种丝氨酸/苏氨酸蛋白激酶,参与调节机体能量代谢,维持能量平衡,与HLP、肥胖症、糖尿病等多种由能量代谢异常引起的疾病相关。AMPK包含α催化亚基和β、γ调节亚基,LKB1是AMPK的主要上游激酶,通过phoshpo-AMPKα上的苏氨酸残基(Thr172)而增强AMPK的磷酸化水平,从而激活AMPK,活化的AMPK可以磷酸化乙酰辅酶A羧化酶、羟甲基戊二酸单酰CoA还原酶从而抑制脂肪酸和TC的合成,还可以抑制甘油-3-磷酸酰基转移酶来抑制TG合成[16]。LKB1是磷酸化和活化AMPK的必要因素,LKB1表达降低,AMPK的磷酸化和活化随之降低[17]。LKB1/AMPK通路是肝脏中最主要的磷酸化激活AMPK的信号通路,在脂质和糖代谢过程中起着重要作用,肝脏中AMPK活化,能改善TC和葡萄糖代谢,减轻肝脏氧化应激和脂质蓄积[18]。LI等[19]研究显示,通过上调LKB1/AMPK通路可降低TC和TG水平,从而改善肝脂肪变性。XI等[20]研究表明,下丘脑LKB1过表达可以激活AMPK通路抑制肥胖症的发展。本研究藤茶黄酮各剂量组phospho-AMPKα、phospho-LKB1蛋白表达明显升高,提示藤茶黄酮通过活化AMPK信号通路,促进AMPKα、LBK1的磷酸化,调节脂质代谢,改善血脂水平。
综上所述,藤茶黄酮能够降低HLP大鼠TC、TG、LDL-C水平,提高HDL-C水平,降低脂质过氧化,提高机体抗氧化能力,其机制可能是通过激活AMPK信号通路促进AMPKα、LBK1的磷酸化从而发挥调控作用,为临床应用藤茶黄酮治疗HLP提供一定的理论依据。



