王龙毅,汪晓茜,何海珍,李仁良,陈育梅
(温州市人民医院妇产科,浙江温州 325099)
国内外研究已证实高危型人乳头瘤病毒(HPV)感染是导致宫颈癌及癌前病变的主要病因[1]。然而,HPV感染过程通常分为潜伏感染期、亚临床感染期、临床症状期和HPV相关的肿瘤期[2]。从HPV感染发展至浸润性宫颈癌的平均时间需要25~30年,这是一个由量变到质变、渐变到突变的漫长过程[3]。宫颈癌的发生也有一系列的前驱病变过程,即宫颈鳞状上皮内病变,依病变的严重程度又分为宫颈低级别鳞状上皮内病变(LSIL)和宫颈高级别鳞状上皮内病变(HSIL)。宫颈病变过程有渐变性特征,HPV感染并不意味着一定会发生宫颈癌,大部分的HPV感染会在2年内消退,仅少数会发展成HPV持续感染并引起宫颈上皮内瘤变(CIN)[4]。据统计,80%的妇女在一生中曾感染过HPV,但只有5%~10%发展为持续性感染,仅2%~3%的HPV感染最终发展为宫颈癌[5]。因此,HPV感染是引起宫颈癌及癌前病变发生、发展的必要因素,但不是导致癌变的充分条件,需要同时存在其他可能增加宫颈癌风险的协同因素[6],这些协同因素可能通过促进HPV感染、或促进HPV持续性感染、或HPV感染后加快宫颈病变的自然进程等,从而促进宫颈癌的发生、发展[7]。因此,有必要对HPV感染及宫颈病变进展的影响因素进行调查。本研究收集阴道镜活检患者的临床资料,分析高危型HPV感染及宫颈病变进展的相关影响因素,现报道如下。
1 资料与方法
1.1 一般资料
收集2018年1月至2020年10月在本院妇产科就诊行阴道镜活检的2 959例患者的临床资料。纳入标准:(1)有性生活史,在本院就诊行阴道镜活检;(2)无子宫切除史及恶性肿瘤手术史;(3)无盆腔放射治疗及化疗病史。排除标准:(1)否认性生活者;(2)月经期、生殖道急性炎症或无法配合检查的患者;(3)有子宫切除史、恶性肿瘤手术史者;(4)有盆腔放射治疗及化疗史者;(5)宫颈缺失、宫颈暴露困难者;(6)临床信息不完整者。本研究经本院伦理委员会审核同意(伦审KY-2023-025号)。
1.2 方法
收集患者的临床资料、生活方式(包括患者及性伴侣是否吸烟等)、婚育史(包括妊娠次数、分娩次数、流产次数)、避孕方式(是否使用避孕套避孕)、HPV感染情况、宫颈病理学诊断等方面信息,采用单因素分析及多因素非条件logistic回归模型分析高危型HPV感染及宫颈病变进展的影响因素。
1.3 统计学处理
使用Excel2019及SPSS23.0软件进行数据处理及统计分析。计数资料用例数或百分比表示,比较采用χ2检验;多因素分析采用多因素非条件logistic回归分析,OR>1为危险因素,OR<1为保护因素。以P<0.05为差异有统计学意义。
2 结 果
2.1 宫颈高危型HPV感染的影响因素分析
2.1.1单因素分析
本研究共收集2 959例患者临床资料,年龄18~60岁,平均(39.13±9.56)岁。高危型HPV阳性2 649例,其中<30岁507例(19.1%),30~<40岁922例(34.8%),40~<50岁778例(29.4%),≥50岁442例(16.7%);高危型HPV阴性310例,其中<30岁33例(10.6%),30~<40岁99例(31.9%),40~<50岁134例(43.2%),≥50岁44例(14.2%),高危型HPV阳性和阴性患者年龄构成比较,差异有统计学意义(χ2=29.972,P=0.001)。单因素分析结果显示:年龄、性伴侣吸烟对高危型HPV感染有影响 (P<0.05),见表1。
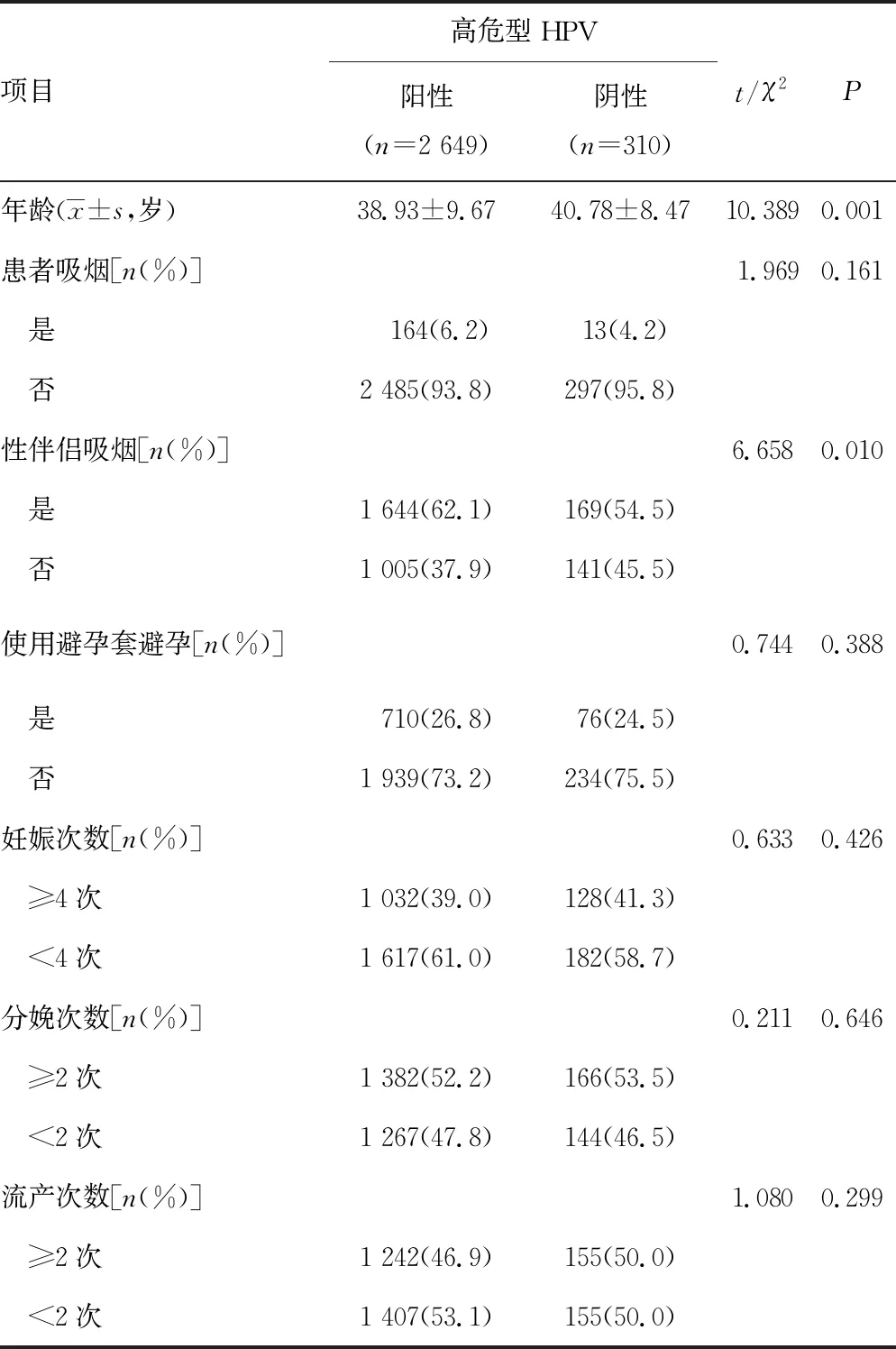
表1 高危型HPV感染影响因素的单因素分析
2.1.2多因素非条件logistic回归分析
以年龄、性伴侣吸烟(赋值:是=1,否=0)作为自变量,以是否发生高危型HPV感染作为因变量,多因素非条件logistic回归分析结果显示:性伴侣吸烟增加高危型HPV感染风险(OR=15.533,95%CI:1.050~1.689,P<0.05)、年龄增加高危型HPV感染风险降低(OR=0.981,95%CI:0.969~0.993,P<0.05),见表2。
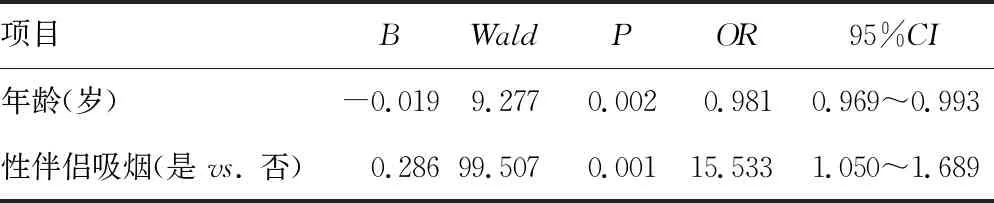
表2 高危型HPV感染影响因素的多因素非条件logistic回归分析
2.2 宫颈组织病变进展的影响因素分析
2.2.1单因素分析
本研究中宫颈LSIL及以下患者2 352例,其中<30岁446例(19.0%),30~<40岁803例(34.1%),40~<50岁727例(30.9%),≥50岁376例(16.0%);HSIL及以上607例,其中<30岁94例(15.5%),30~<40岁218例(35.9%),40~<50岁185例(30.5%),≥50岁110例(18.1%),LSIL及以下和HSIL及以上患者年龄构成比较,差异无统计学意义(χ2=5.004,P=0.172)。单因素分析结果显示:性伴侣吸烟、使用避孕套避孕、分娩次数对宫颈组织病变进展有影响 (P<0.05),见表3。
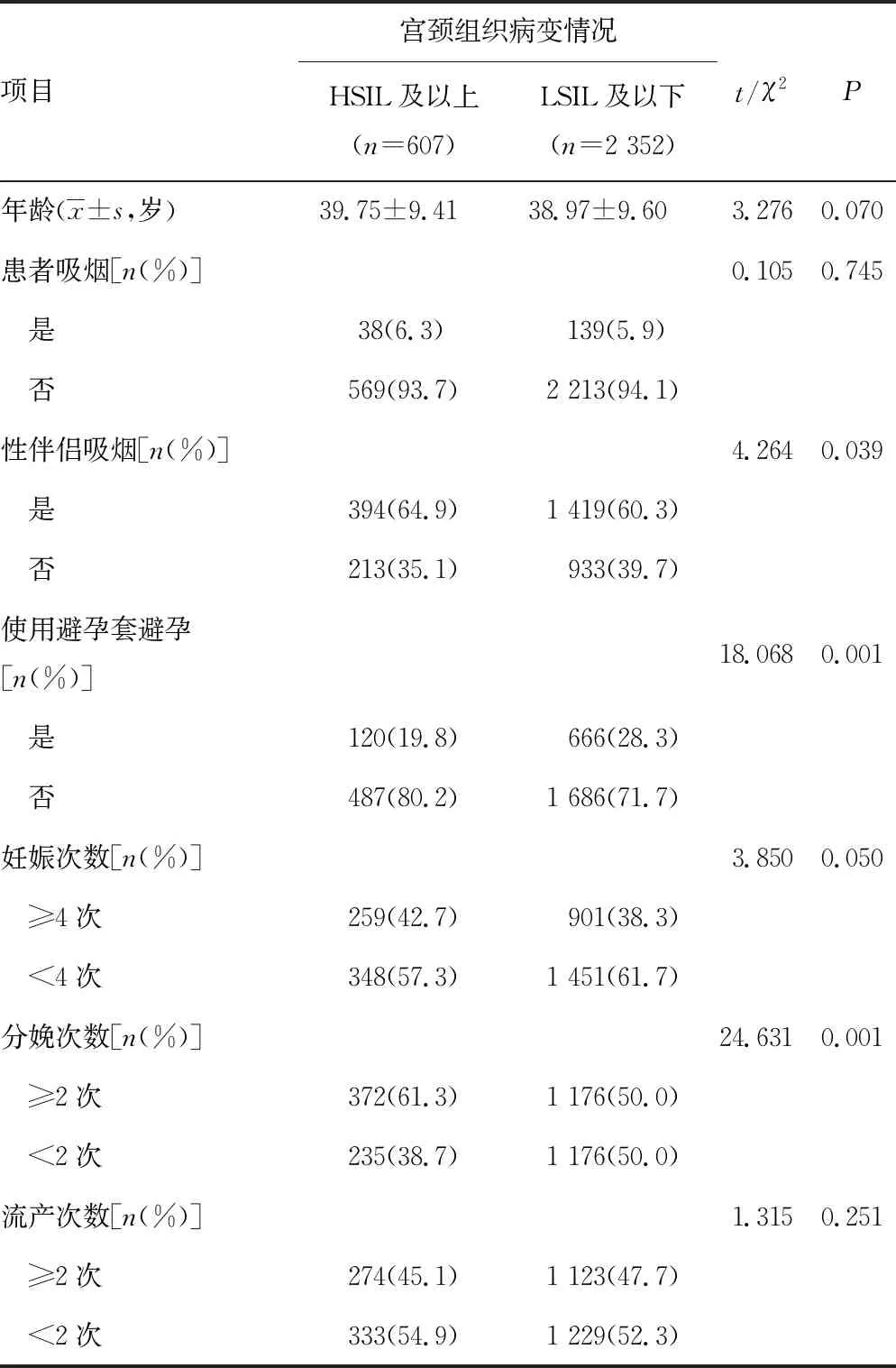
表3 宫颈组织病变进展影响因素的单因素分析
2.2.2多因素非条件logistic回归分析
以使用避孕套避孕(赋值:是=1,否=0)、性伴侣吸烟(赋值:是=1,否=0)、分娩次数(赋值:≥2次=1,<2次=0)作为自变量,以是否发生宫颈组织病变进展(HSIL及以上)作为因变量,多因素非条件logistic回归分析结果显示:使用避孕套避孕可降低宫颈组织病变进展风险(OR=0.695,95%CI:0.554~0.870,P<0.05);性伴侣吸烟增加宫颈组织病变进展风险(OR=1.212,95%CI:1.005~1.461,P<0.05);分娩次数≥2次增加宫颈组织病变进展风险(OR=1.458,95%CI:1.200~1.772,P<0.05),见表4。
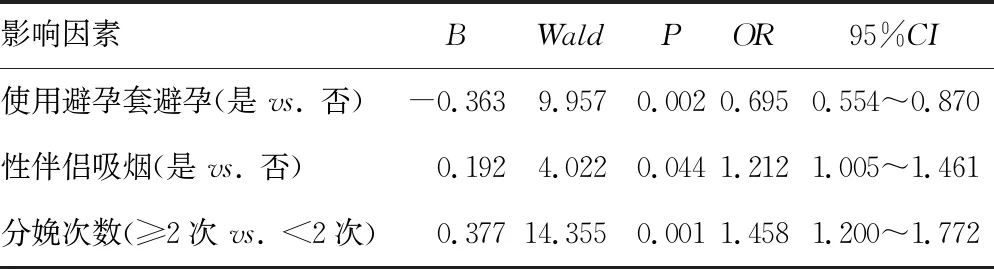
表4 宫颈组织病变进展影响因素的多因素非条件logistic回归分析
3 讨 论
虽然已知HPV感染是引起宫颈病变发生、发展的必要因素,但绝大多数患者仅为无症状的一过性感染,大部分可被机体清除[8]。相关研究指出,宫颈病变发展的程度及最终的预后转归,除了与感染HPV有关,还可能与遗传、年龄[9]、免疫状态、婚育史、生活习惯等诸多因素有关[10]。
HPV目前的主要传播途径是通过性接触传播,因此初次性生活年龄、性伴侣数目、首次妊娠年龄、首次分娩年龄、孕产次数均可能与HPV感染存在关系[11]。有研究指出,存在多个性伴侣的情况下,女性感染HPV的风险增加8.4倍,并且宫颈恶性肿瘤患者的性伴侣其HPV感染风险也明显高于非宫颈恶性肿瘤者的性伴侣[12]。若性伴侣感染HPV,容易引起反复交叉感染,从而更易导致妇女HPV持续性感染[13]。
国内外多项研究表明,避孕方式中使用避孕套避孕是HPV感染的保护因素,在1年内均全程使用避孕套避孕者HPV感染率为37.8%,而使用时间少于5%者,其HPV感染率则高达89.3%[14]。MUNK等[15]发现使用避孕套能够促进CIN的消退。在长期使用避孕套2年后,HPV总体清除率为23%,CIN消退率为53%;而未使用避孕套者,HPV清除率仅为4%,CIN消退率也只有35%。
目前吸烟与被动吸烟是否增加HPV感染风险仍然存在争议,但世界卫生组织国际癌症研究署(IARC)已将吸烟归为宫颈癌的病因。一方面,吸烟与文化程度、高危性行为等HPV感染危险因素相关,从而间接导致HPV感染和传播风险增加;另一方面,吸烟会降低宫颈上皮细胞内免疫清除功能[16],破坏局部细胞免疫功能,并且可引起宫颈组织DNA结构改变,导致细胞基因组损伤,还与烟草的某些成分抑制γ-干扰素和肿瘤坏死因子-α功能,抑制细胞凋亡有关[17],使感染HPV和发展为持续性感染的机会增加,从而导致癌变风险增加[18]。早在30多年前便有文献指出,吸烟对宫颈疾病的诱变效应发生在宫颈细胞中,其与染色体损伤频率的增加有关[19];而最近一篇报道指出,HPV的存在和其致癌活性引起宫颈病变,而吸烟或被动吸烟的有害协同效应不能完全归因于尼古丁的直接致癌作用,而应归因于免疫系统的整体损害[20]。
本研究中,根据分析结果得知,随着年龄增加高危型HPV感染风险反而降低,这与国外的研究报道相同[21],考虑可能与年轻患者宫颈上皮修复能力尚不完善及性生活活跃相关[22]。另外,分娩可增加宫颈病变进展风险,考虑分娩次数增多可使宫颈组织反复受损,减弱了宫颈的屏障作用,与此同时宫颈在修复的过程中也存在细胞的化生,导致HPV易于侵入,从而增加宫颈病变进展风险[23]。而本研究结果显示,使用避孕套避孕与HPV感染并无关联,却是宫颈病变进展的保护因素。可能因为避孕套可以起到物理屏障作用[24],一方面阻断了精液引起的免疫刺激作用,另一方面在一定程度上减少了妇科炎症的发生概率,从而降低了HPV的持续感染率[25],进而降低宫颈病变进展风险,因此,在宫颈癌防治宣传中,应考虑提倡使用避孕套避孕。另外,本研究中发现,女性吸烟并不常见,大多数为性伴侣吸烟,而性伴侣吸烟存在增加高危型HPV感染的风险,同时也增加宫颈组织病变进展的风险,这与国外的报道结论相同[26]。此外,我国的禁控烟制度并不完善,仍旧存在较大的吸烟人群,相对于主动吸烟,女性被动吸烟的概率非常大,因此,仍需加强提倡控烟戒烟,同时应尽可能减少甚至避免被动吸烟的发生。
综上所述,性伴侣吸烟可增加宫颈高危型HPV感染风险,随年龄增加高危型HPV感染风险反而降低;使用避孕套避孕可以降低宫颈组织病变进展风险,分娩次数≥2次、性伴侣吸烟可增加宫颈组织病变进展的风险。



