梁坤荣,王 慧,顾恩妍,吴振奇,石 峰,靳丽艳,张 蕊,于婷婷,王艳超,薛冰华△
(1.北京吉源生物科技有限公司技术部,北京 101300;2.北京翰洁吉源医院有限公司外科,北京 101300)
1966年,FRIEDENSTEIN等从骨髓中发现了一类具有自我更新、增殖和多向分化潜能的细胞称之为间充质干细胞[1],可来源于除骨髓外的多种组织[2]。脂肪间充质干细胞(adipose derived mesenchymal stem cells,ADMSC)来源于脂肪组织,具有来源部位多、取材容易、扩增能力强、细胞因子分泌种类多等优势[3-6]。ADMSC的优势使其在整形医学[7-10]、临床医学[11-14]、再生医学[15-18]等方面均受到了研究者的青睐,同时也成为一种主要的细胞治疗药物的种子细胞[19-20]。ADMSC有多种提取方法[21-23],包括酶消化法、组织块贴壁法、酶消化法结合组织块贴壁法、悬浮培养法及机械分离方法(涡旋离心法、吸附柱法、超声处理法)等。本研究采用酶消化法进行脂肪组织分离纯化,旨在探讨抗生素、脂肪组织保存时间和保存温度、培养基等对体外分离培养人ADMSC的影响,现报道如下。
1 材料与方法
1.1 材料
1.1.1细胞
腹部皮下脂肪组织由北京翰洁吉源医院在征得志愿者同意并签署知情同意书的情况下采集,所有志愿者健康状况良好,无系统性疾病和传染性疾病,每次采集约100 cm3。本研究已通过北京翰洁吉源医院伦理委员会,审查意见号:(2021)临伦审第(235)号。采集的脂肪组织仅用于科学研究,全部实验人员始终保持严谨、实事求是的科学态度。
1.1.2试剂与仪器
α-MEM基础培养基(C3060-0500,上海龙田生物技术有限公司),α-MEM基础培养基(C12571500BT,美国Gibco公司),5%血小板裂解液(PL-NH-500,美国Sexton公司),庆大霉素(宜昌人福药业有限责任公司),Tryple(12604-021,美国Gibco公司),胰蛋白酶(0458-25G,北京经科宏达生物技术有限公司),Ⅰ型胶原酶(V900891-1G,美国Sigma公司),CD73-PE(550257,美国BD公司),CD90-异硫氰酸荧光素(fluorescein isothiocyanate,FITC,5555985,美国eBioscience公司),CD105-PE(560839,美国eBioscience公司),CD34-PerCP(29103,美国BD公司),CD45-ECD(A07785,美国BD公司),人类白细胞抗原(human leukocyte antigen,HLA)-DR-APC(2350758,美国eBioscience公司),CD14-FITC(555397,美国BD公司),CD79a-APC(551134,美国BD公司),3-利福定-1-1甲基黄嘌呤(3-Isobuty-1-1-Methylxanthine,IBMX),地塞米松,吲哚美辛,各种细胞培养皿和孔板,流式细胞仪(AFC2,美国Thermo公司),恒温培养振荡器(ZWY-100H,上海智城分析仪器制造有限公司),细胞计数仪(CountessⅡ,美国Invitrogen公司),倒置显微镜[AE2000,麦克奥迪(厦门)医疗诊断系统有限公司]。干细胞无血清培养基:含95% α-MEM和5%血小板裂解物。脂肪组织消化液:含80%胰蛋白酶(储存浓度0.25%)和20% Ⅰ型胶原酶(储存浓度1%)。
1.2 方法
1.2.1ADMSC分离培养及传代
原代ADMSC分离培养:取不同实验条件的脂肪组织,在超净工作台中将脂肪组织与0.9%生理盐水按照1∶4的体积比混合并置于适宜容器内颠倒混匀,充分清洗含有膨胀液和血水的脂肪组织,500×g离心5 min,重复2次。脂肪组织转移至新的离心管中,加入脂肪组织消化液(脂肪组织∶脂肪组织消化液体积比为1∶1),充分混匀后置于37 ℃、230 r/min的恒温摇床振荡消化30 min。加入上一步消化液总体积3倍的干细胞无血清培养基终止消化,500×g离心8 min。弃上清液,收集底部细胞,将细胞转移至新的离心管中,加生理盐水补足最大离心体积,500×g离心5 min,此步骤重复1次,去除油脂。弃上清液,加入干细胞无血清培养基重悬,将脂肪原液按0.18 mL/cm2的密度接种于培养皿中,置于37 ℃、5% CO2培养箱中进行培养。
原代ADMSC换液培养:分离得到的原代ADMSC培养24 h后细胞开始贴壁,观察细胞状态,3~4 d后全量吸弃原代ADMSC培养液,加入等量新鲜干细胞无血清培养基,去除红细胞,在倒置显微镜下对不同实验条件下的细胞进行拍照。
原代ADMSC传代:当原代ADMSC融合度至90%时,进行细胞传代,生理盐水清洗两遍,加入0.01 mL/cm2稀释后的Tryple(生理盐水∶Tryple体积比为1∶1),并使之均匀浸润全部细胞,1 min后显微镜下观察细胞,加入3倍消化液体积的生理盐水终止消化,收集细胞至离心管内,充分混匀后取100 μL到EP管中计数并计算活率(细胞悬液∶台盼蓝体积比为1∶1),其余细胞500×g离心5 min,弃上清液,加入干细胞无血清培养基重悬,按1×104/cm2进行传代。
1.2.2脂肪组织添加抗生素对体外分离培养人ADMSC的影响
因脂肪组织在采集和运输过程中很难做到完全无菌状态,故抗生素的加入有利于抑制细菌的增殖,这为后续无菌培养奠定基础,但抗生素的添加又可能影响细胞的活性。因此本实验对比抽脂时膨胀液中加入庆大霉素(8万单位/1 L膨胀液)和不加庆大霉素对脂肪组织分离ADMSC的影响,具体操作同上。
1.2.3脂肪组织保存时间对体外分离培养人ADMSC的影响
将志愿者脂肪组织标本平均分成6份,分别保存0、1、2、3、5、7 d进行分离培养,记录传代时间及细胞收获量。
1.2.4脂肪组织保存温度对体外分离培养人ADMSC的影响
将志愿者脂肪组织标本平均分成3份,分别于2~8 ℃、室温(22 ℃)、37 ℃保存,分离培养,记录传代时间及细胞收获量。
1.2.5培养基对体外分离培养人ADMSC的影响
分离后的脂肪,分别用不含核苷和含核苷的培养基进行培养,记录传代时间及细胞收获量。
1.2.6流式细胞术分析细胞表型
收集第5代ADMSC,利用流式细胞术[24-25]检测ADMSC表面标志物CD73+、CD90+、CD105+、CD34-、CD45-、HLA-DR-、CD14-、CD79a-。流程如下:取待测单细胞悬液,离心后用磷酸盐缓冲液调整密度为1×106/100 μL;将标记抗体加入试管底部,充分混匀;室温避光孵育20 min。向管中加入1 mL生理盐水,混匀后300×g离心5 min,弃上清液,重复洗涤2次。弃上清液,用500 μL生理盐水重悬细胞,混匀后上机分析。
1.2.7定向诱导成脂分化
将生长状态良好的第5代ADMSC消化、重悬,调整细胞浓度,将1.5×105/孔细胞接入6孔板,融合度长至70%~80%时,换ADMSC成脂诱导培养基(DMEM+10%胎牛血清+IBMX 0.5 mmol/L+地塞米松1 μmol/L+吲哚美辛200 μmol/L+胰岛素10 μg/mL),2~3 d换液,对照组用干细胞无血清培养基进行培养,当诱导组培养至镜下可以看到脂滴,吸除培养基,用磷酸盐缓冲液清洗2次,4%多聚甲醛固定30 min,油红O染色10 min,磷酸盐缓冲液洗去多余染料,拍照。
1.2.8定向诱导成骨分化
将生长状态良好的第5代ADMSC消化、重悬,调整细胞浓度,将1.5×105/孔细胞接入6孔板,融合度长至70%~80%时,换ADMSC成骨诱导培养基[26],2~3 d换液,对照组用干细胞无血清培养基进行培养,当诱导组培养至镜下可以看到结节,吸除培养基,用磷酸盐缓冲液清洗2次,4%多聚甲醛固定30 min,茜素红染色10 min,磷酸盐缓冲液洗去多余染料,拍照。
2 结 果
2.1 ADMSC形态
原代ADMSC接种24 h后,镜下可见少数贴壁细胞为大而扁平的单层细胞,有的细胞细长,似成纤维细胞。48 h后大多数细胞贴壁,并开始伸展、分裂,呈梭形且有粗大突起,见图1。接种ADMSC后培养5~9 d,细胞逐渐分裂、汇合成单层,成簇分布,传代后细胞呈梭形,见图2。

图1 原代ADMSC培养48 h贴壁状态(40×)

图2 ADMSC传代后培养72 h贴壁状态(40×)
2.2 脂肪组织添加抗生素对体外分离培养人ADMSC的影响
通过对10个志愿者的数据进行统计,抽脂时膨胀液中不添加庆大霉素,分离得到的原代ADMSC初次传代时间为接种后5~6 d;添加庆大霉素后,原代ADMSC增殖明显缓慢,无典型间充质干细胞形态,初次传代时间为接种后9~10 d,见表1、图3。因此,后续实验脂肪组织膨胀液中不再添加庆大霉素。

表1 抗生素对体外分离培养人ADMSC的影响

图3 抗生素对体外分离培养人ADMSC的影响(40×)
2.3 脂肪组织保存时间对体外分离培养人ADMSC的影响
通过对10个志愿者的数据进行统计,保存0 d的脂肪组织分离得到的原代ADMSC呈梭形,初次传代时间为5 d。保存1~2 d的脂肪组织分离得到的原代ADMSC呈梭形,初次传代时间为6 d。保存3 d的脂肪组织分离得到的原代ADMSC不规则形态细胞变多,生长缓慢,初次传代时间为接种后7 d。保存5 d的脂肪组织分离得到的原代ADMSC数量明显减少,初次传代时间为接种后9 d。保存7 d的脂肪组织无法分离得到原代ADMSC,见表2、图4。

表2 保存时间对体外分离培养人ADMSC的影响

图4 脂肪组织不同保存时间分离的ADMSC培养3 d的生长状态(40×)
2.4 脂肪组织保存温度对体外分离培养人ADMSC的影响
通过对10个志愿者的数据进行统计,在2~8 ℃、室温、37 ℃保存下的ADMSC均培养到6 d进行传代,结果显示,2~8 ℃保存下的ADMSC生长状态最佳,融合度约95%,室温保存下的ADMSC融合度约90%,37 ℃保存下的ADMSC融合度约85%,见表3、图5。

表3 保存温度对体外分离培养人ADMSC的影响

图5 不同温度下保存的ADMSC传代时的融合度(40×)
2.5 培养基对体外分离培养人ADMSC的影响
通过对6个志愿者的数据进行统计,在原代ADMSC分离培养时,用含核苷的α-MEM培养基,培养3 d有少量梭形细胞爬出,培养5 d可以进行传代。用不含核苷的α-MEM培养基,培养4 d有少量梭形细胞爬出,培养7 d可以进行传代,见表4。

表4 不同培养基对体外分离培养人ADMSC的影响
2.6 流式细胞术分析细胞表型
通过对10个志愿者的数据进行统计,流式细胞术检测ADMSC表面标志物,高表达CD73[(99.5±0.1)%]、CD90[(99.7±0.2)%]、CD105[(97.8±0.3)%],低表达CD34[(0.8±0.2)%]、CD45[(0.6±0.2)%]、HLA-DR[(0.12±0.02)%]、CD14[(1.4±0.2)%]、CD79a[(0.6±0.2)%],见图6。

图6 流式细胞术分析细胞表型结果
2.7 成骨、成脂诱导分化
成脂诱导:油红O染色阳性,细胞质内可见大量脂滴被染成橘红色,而对照呈阴性结果,见图7。成骨诱导:茜素红染色阳性,提示钙结节形成,而对照呈阴性结果,见图8。
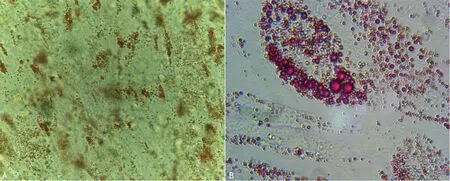
A:40×;B:100×。

图8 ADMSC成骨诱导茜素红染色(40×)
3 讨 论
张云巍等[27]通过实验发现,人ADMSC在脂肪组织中的含量与年龄的增长并无严格的相关性,且其体外扩增培养的形态学特征、生长周期也无明显差异。因此本实验对其他影响因素进行探究。
脂肪采集手术过程中向每升膨胀液中加入8万单位庆大霉素,虽然可在一定程度上防止标本污染,但脂肪组织在后期生长中,细胞贴壁时间过长且状态较差,影响细胞增殖。庆大霉素是氨基糖苷类抗生素,主要通过抑制细菌蛋白质的合成而起到抗菌作用,可能也会抑制ADMSC蛋白质合成,虽然能够在一定程度上避免污染,但会严重影响脂肪组织活性从而导致培养、增殖的速度变慢,细胞存活率降低。
本研究保存温度实验结果显示,温度升高,细胞的生长速度就减慢。从两个方面来考虑温度对脂肪活性的影响,一个是油脂的氧化速度逐渐升高,另一个是油脂中溶解的氧气含量降低,所以2~8 ℃下细胞贴壁、增殖、存活率更趋于稳定。保存时间延长,脂肪组织氧化的程度就加重,所以脂肪保存时间不宜超过72 h。
核苷具有提供能量,促进细胞生长、增强细胞活性,同时也参与DNA和RNA的合成,构成细胞基因组,所以核苷在ADMSC的原代分离、传代培养中起到重要作用。脂肪组织活性是ADMSC分离培养过程中最为关注的问题,而脂肪组织的保存时间、保存温度是影响脂肪组织活性的主要因素。
综上所述,使用抗生素、长时间、高温度保存会抑制ADMSC增殖,而核苷可促进其增殖,本实验为今后以ADMSC为目标的细胞治疗药学研究奠定了基础。



