王春雨,管明秀,兰淑海,唐淑稳,张 霞,曹一丹
(1.天津市宁河区医院心血管内科,天津 301509;2.天津市宝坻区人民医院检验科,天津 3018003.天津市宝坻区人民医院产科,天津 301800;4.天津市宝坻区人民医院心血管内科,天津 301800;5.天津医科大学公共卫生学院预防医学系,天津 300203)
妊娠期高血压疾病(hypertensive disorder complicating pregnancy,HDCP)是妊娠与高血压并存的一类疾病,发病率 5%~12%[1-2]。其中妊娠高血压和子痫前期是HDCP的主要组成部分,也是临床导致孕妇和胎儿围产期致死率升高的主要原因之一[3-5]。目前尚无法早期准确预判HDCP的高危患者,治疗方案主要以孕期病情监测和对症治疗为主,终止妊娠是唯一的治愈手段[2]。HDCP可表现为心、脑、肝等多个脏器受累,严重时合并器官缺血缺氧、水肿、坏死等症状,同时还会引起胎儿发育迟缓、胎盘早剥等并发症,尽早完成风险因素筛查对于HDCP的早期诊断及治疗至关重要[6-7]。在HDCP发生机制的研究中,免疫学与其发病的相关性受到学者肯定[5-6]。血尿酸水平升高可以使机体某些免疫因子数量发生变化,机体免疫过度应答导致HDCP发生,因此血尿酸水平可能与HDCP发生机制密切相关[6,8];其他研究还发现血管紧张素Ⅱ1型受体自身抗体(autoantibodies against angiotensin Ⅱ type 1 receptor,AT1-AA)可能在子痫前期的发生、发展中发挥重要作用[9],因此早期监测及干预这些指标对HDCP的预防及诊治可能有重要临床意义。本研究通过ELISA检测HDCP孕妇与健康妊娠孕妇外周血中AT1-AA表达水平,并采用酶比色法测定血尿酸和血尿素氮水平,并进行相关性分析,旨在探讨AT1-AA、血尿酸、血尿素氮与HDCP发病及疾病严重程度的相关性,为HDCP高危患者早期识别及诊断提供临床依据。
1 资料与方法
1.1 一般资料
选取2021年8月至2023年2月在天津市宝坻区人民医院明确诊断妊娠的孕妇180例,由两名经验丰富的产科、心血管医师根据《妊娠期高血压疾病诊治指南(2020)》[1]及患者血压、检查结果情况分为对照组(n=55)、HDCP组(n=125);将HDCP组根据病情发展程度分为妊娠高血压组(n=77)、子痫前期组(n=48)两个亚组。纳入标准:(1)在本院产科完成定期产检明确诊断正常妊娠、HDCP且未破膜、未临产;(2)有完整的病历资料、临床指标和随访资料,包括血液检测、心脏彩色多普勒超声、血压监测结果等。排除标准:(1)妊娠前及妊娠后合并严重肝功能、肾功能不全,以及凝血功能障碍者;(2)既往有明确高血压、冠心病、2型糖尿病、自身免疫性疾病、恶性肿瘤、血液系统疾病、慢性肾炎疾病史、患有其他导致血压升高的疾病;(3)合并急性卒中、急慢性感染、严重出血、严重创伤及其他妊娠合并症等情况;(4)多胎妊娠;(5)有吸烟、饮酒等不良嗜好;(6)除上述因素外患者不同意入组者。本研究获得天津市宝坻区人民医院伦理委员会审核批准(审批号:BDYYLL202008),且患者及其家属签署知情同意书。
1.2 方法
1.2.1妊娠高血压的诊断标准及方式[1-2]
(1)采用标准化流程测量血压,测量工具为台式水银柱血压计,根据患者的臂围选择合适的袖带,标准规格的袖带气囊长22~26 cm、宽12 cm,肥胖者或臂围大者(>32 cm)使用大规格气囊袖带。(2)血压测量方法:首诊时应测量双上臂血压,以血压读数较高的一侧作为测量的上臂。受试者安静休息至少5 min后开始测量坐位上臂血压,上臂应置于心脏水平。测量血压时,应间隔1~2 min重复测量,取2次读数的平均值记录。如果收缩压或舒张压的两次读数相差值>5 mmHg,应再次测量,取3次读数的平均值记录。(3)高血压定义:血压≥140/90 mmHg。(4)对白大衣性高血压(诊室血压高,而家庭自测血压不高)、隐蔽性高血压(诊室血压不高,有明确靶器官损伤)及孕中期出现一过性妊娠高血压的孕妇,行24 h动态血压监测明确诊断。
1.2.2检测方法
所有研究对象均于入院后即刻采集病史,次日晨起抽取空腹孕妇肘正中静脉血,留取外周静脉血4 mL至乙二胺四乙酸抗凝试管,于4 ℃冰箱静止4 h,以2 500 r/min离心10 min,分离上清液放入EP管中,标记后置于-80 ℃冰箱中保存备用。保存过程中如出现沉淀则再次离心。采用SpectraMax M2/M2e 酶标仪(美国Molecular Devices公司),以ELISA检测孕妇外周血中AT1-AA表达水平。采用c701生化分析检测系统(瑞士Roche公司)及原装试剂盒检测外周血载脂蛋白a、高密度脂蛋白(high density lipoprotein,HDL)、总胆固醇(total cholesterol,TC)、低密度脂蛋白(low-density lipoprotein,LDL)、甘油三酯(triglyceride,TG)、血尿酸和血尿素氮水平等指标水平。
1.3 统计学处理
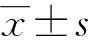
2 结 果
2.1 对照组与HDCP组一般资料比较
两组各项指标比较差异均无统计学意义(P>0.05),见表1。
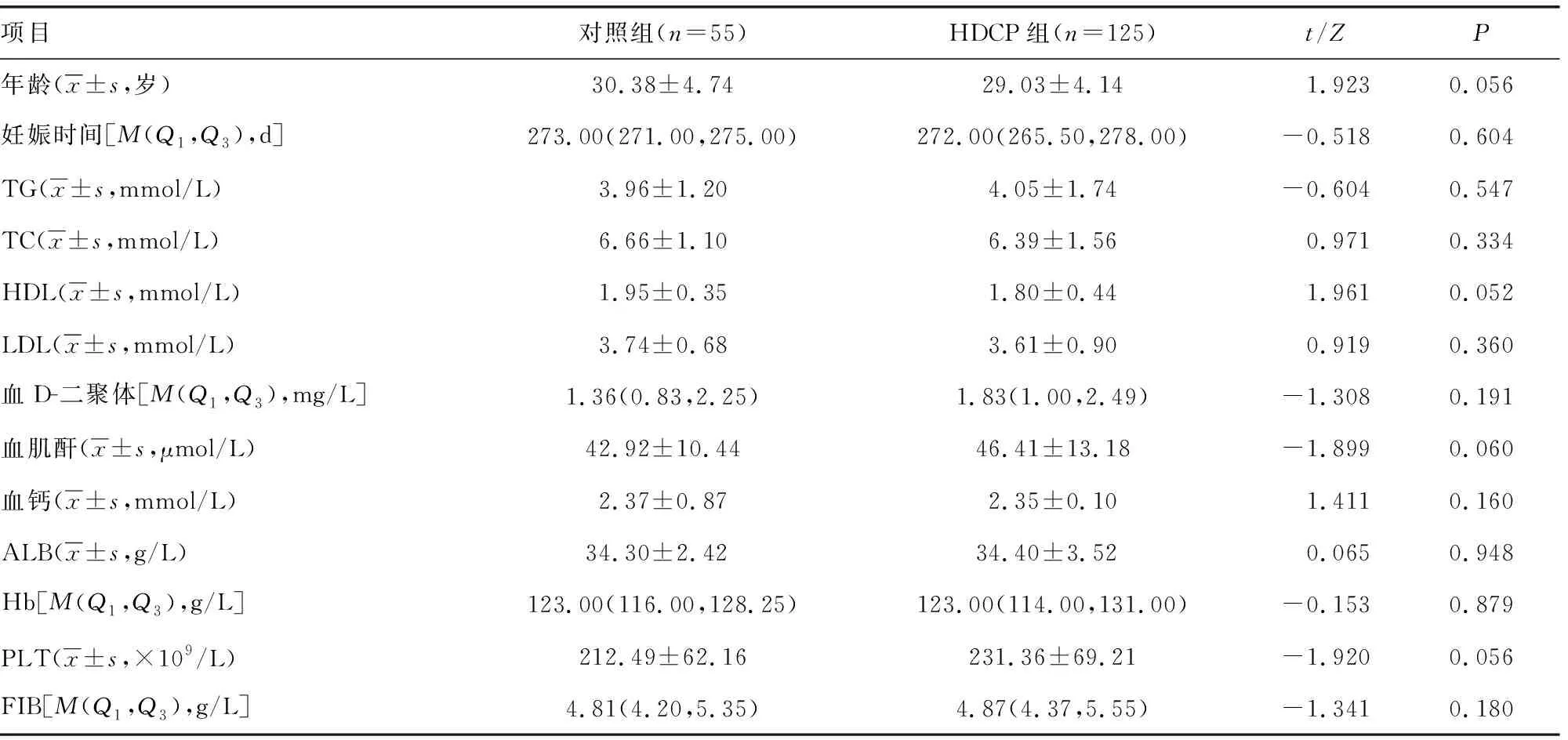
表1 对照组与HCDP组一般资料比较
2.2 对照组与HCDP组AT1-AA、血尿酸、血尿素氮水平比较
HDCP组AT1-AA、血尿酸、血尿素氮水平均高于对照组,差异有统计学意义(P<0.05),见表2。

表2 对照组与HCDP组AT1-AA、血尿酸、血尿素氮水平比较
2.3 妊娠高血压组与子痫前期组AT1-AA、血尿酸及血尿素氮水平比较
子痫前期组的AT1-AA、血尿酸及血尿素氮水平均高于妊娠高血压组,差异有统计学意义(P<0.05),见表3。

表3 妊娠高血压组与子痫前期组AT1-AA、血尿酸及血尿素氮水平比较
2.4 相关性分析
结果显示,AT1-AA、血尿酸及血尿素氮水平与HDCP严重程度呈正相关(P<0.05),见表4。
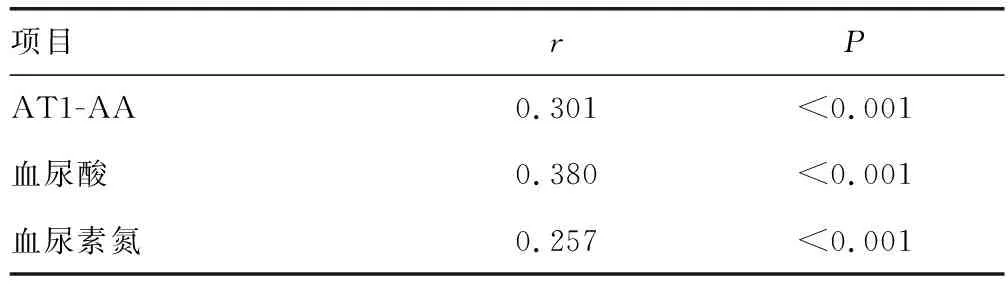
表4 AT1-AA、血尿酸及血尿素氮与HDCP严重程度相关性分析
2.5 血清AT1-AA、血尿酸及血尿素氮水平对HDCP的诊断价值
绘制妊娠高血压组与子痫前期组中血清AT1-AA、血尿酸、血尿素氮诊断HDCP的ROC曲线,AT1-AA、血尿酸、血尿素氮及联合检测诊断HDCP对应的AUC分别为0.680、0.714、0.647、0.725,其对应的Youden指数为0.368、0.380、0.306、0.439;联合检测的价值高于单独检测,见表5、图1。
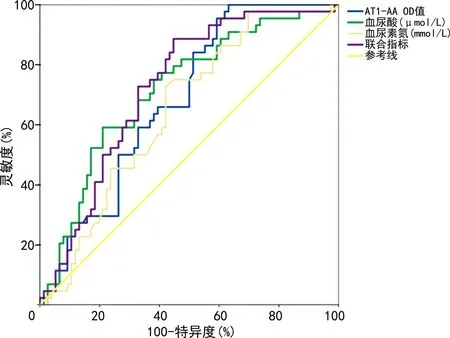
图1 ROC曲线图
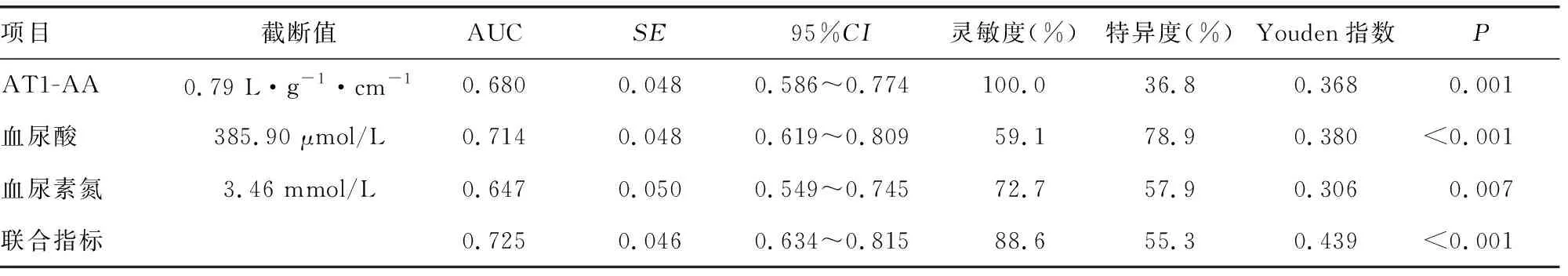
表5 血清AT1-AA、血尿酸及血尿素氮水平对HDCP的诊断价值
3 讨 论
已有研究表明,HDCP的发病病理机制复杂,是多种机制相互作用的结果,至今尚未完全明确[1-3]。温丽等[10]采用多中心、大规模、随机队列研究纳入689例汉族HDCP患者,结果显示汉族女性HDCP的发病与胎盘或滋养细胞缺血、遗传学、氧化应激等有关,孕中期平均动脉压高等因素是导致汉族女性HDCP的危险因素。研究还发现[11-12],肾素-血管紧张素系统也参与了HDCP发病和发展过程,免疫学机制和肾素-血管紧张素(angiotensin,Ang)系统与子痫前期的发展有关。
WALLUKAT等[13]首次在子痫前期孕妇的血清中发现了一种可激活AngⅡ-1型受体(angiotensin Ⅱ receptor subtype 1,AT1-R)的免疫球蛋白G(immunoglobulin G,IgG)抗体,并命名为AT1-AA。AT1-AA是胞外第二环肽自身抗体,与G蛋白耦联受体引起血压升高的免疫机制相关,其活性与时间无明显相关性,通过与位于细胞外AT1-R的第二环多肽片段相结合,发挥类似于AngⅡ的缩血管作用,是独立于AngⅡ的另一条刺激AT1受体的通路。AT1-AA升高血压的作用可以被AT1-R阻滞剂和内皮素1A型受体拮抗剂阻断,而不能被AT2-R阻滞剂和β肾上腺能受体阻滞剂阻断[14-15]。肾素-Ang系统在调节正常的肾功能和血压的生理或病理过程中均发挥重要作用,在正常妊娠和HDCP孕妇体内也同样发挥作用。正常妊娠孕妇肾素水平和活性及AngⅡ水平升高,自身血管对AngⅡ呈低反应状态。当内皮功能损伤会诱发AT1-AA产生,并在AT1-R受体介导下刺激血管平滑肌细胞分裂增殖、收缩,以及血管加压素和醛固酮分泌,损伤血管内皮功能,破坏血管舒缩平衡,从而参与并加速HDCP的发生[6,16]。
AT1-AA作为一种自身抗体,不仅与肾素-Ang系统相关,而且与免疫系统相关,是两个系统的相关因子,备受临床关注[17-18]。研究表明,AT1-AA可通过刺激活性氧(reactive oxygen species,ROS)产物增加,产生严重的氧化应激反应,也可上调炎症细胞因子的表达,进一步加重血管内皮损伤及缺血缺氧,产生更多的AT1-AA,形成炎症瀑布效应来参与HDCP过程[19]。其他研究[8,10,20]则发现子痫前期孕妇的纤溶酶原激活物抑制剂-1(plasminogen activator inhibitor 1,PAI-1)上调将会导致机体纤溶系统活性下降,加速血栓形成,提示AT1-AA还可以通过影响妊娠孕妇凝血和纤溶系统进而参与子痫前期进展。
本研究采用ELISA测定HDCP组与对照组外周血中AT1-AA水平,发现HDCP组外周血中AT1-AA水平高于对照组(P<0.05),提示AT1-AA的表达可能与HDCP的发生存在相关性。通过HDCP组两亚组组间比较,发现子痫前期组AT1-AA水平高于妊娠高血压组(P<0.05);进一步采用Spearman秩相关系数分析AT1-AA水平与HDCP严重程度,发现AT1-AA与HDCP严重程度呈正相关(P<0.05),进一步提示AT1-AA与HDCP的发生、发展相关,这与国内其他研究结论一致[15,21]。因此,在妊娠期间监测外周血中AT1-AA水平可能对HDCP的诊断及病情评估有重要的临床价值。
血尿素氮作为体内蛋白质的最终代谢产物,临床上常作为评估孕妇肾功能的指标之一,同时也是预测子痫前期的独立危险因素[22-24]。尿酸是体内嘌呤代谢的终产物,子痫前期孕妇全身小动脉收缩,胎盘缺血、缺氧,产生大量乳酸,竞争性抑制血尿酸排泄可导致血尿酸水平升高,引发炎症反应进而激活免疫系统,引起免疫系统过度应答,增加HDCP发病概率[6,25-27]。此外,自然杀伤细胞可以帮助重塑子宫螺旋动脉以供给胎盘充足的血液灌注,血尿酸水平升高会降低自然杀伤细胞比例,参与HDCP的发病机制[28]。本研究比较了HDCP组与对照组的血尿酸和血尿素氮水平,发现HDCP组外周血中血尿酸和血尿素氮水平高于对照组(P<0.05)。进一步对HDCP组两个亚组的血尿酸和血尿素氮水平进行比较,发现子痫前期组血尿素氮和血尿酸水平高于妊娠高血压组(P<0.05)。采用Spearman秩相关系数分析,发现血尿酸和血尿素氮水平与HDCP严重程度呈正相关(P<0.001),提示血尿酸和血尿素氮在HDCP诊断及疾病严重程度评估中可能具有重要临床价值,妊娠期监测血尿酸、血尿素氮水平有助于早期识别HDCP高危患者。结合已有研究结果[5-6,24],提示AT1-AA与血尿酸均可通过损伤胎盘滋养层细胞功能来诱发HDCP发生、发展,胎盘自身可能存在一个独立的肾素-Ang系统或炎性系统,在局部产生某些物质激活AT1-R受体来影响HDCP进程。本研究只进行了外周血研究,未做胎盘滋养层相关的组织学论证,这为以后进行相关组织学研究提供了一个思路。ZHAO等[29]研究指出,单一的血尿酸对HDCP具备一定的预测作用,但其灵敏度、特异度相对较低,预测作用有限。本研究分别绘制AT1-AA、血尿酸及血尿素氮对HDCP预测的ROC曲线,3项指标联合检测的AUC为0.725、对应的Youden指数为0.439,联合检测价值高于单独检测。因此,将AT1-AA、血尿酸及血尿素氮指标进行联合检测建模,对HDCP诊断及预判HDCP的发生、发展有更大的临床意义。



