梁丽金,赵睿学,王 上,李 城△
(1.天津中医药大学中医学院,天津 301617;2.北京中医药大学东直门医院,北京 100700)
结直肠癌是世界上病死率第四的肿瘤,每年致使近90万人死亡,而近年来发病率呈上升趋势,更是给全球公共卫生造成了不小的负担,目前治疗方案包括手术切除、系统治疗、局部消融治疗、靶向治疗和免疫治疗等[1-2]。其中,免疫治疗在过去的几十年里一直处于癌症治疗研究的前沿方向,并在结直肠癌领域展现了巨大的潜力。赖氨酰氧化酶(lysyl oxidase,LOX)家族由LOX和赖氨酸氧化酶样蛋白(lysyl oxidase-like,LOXL)1~4组成,它不仅在细胞外基质交联中起关键作用,还具有其他与纤维化和癌变相关的细胞内功能[3],其中LOXL2是该家族目前研究最多的成员之一。LOXL2最初被认为是一种分布在细胞外的分泌蛋白,近年来因其在癌症进展中的重要作用受到了重点关注。研究表明,LOXL2在多种肿瘤中表达异常,并与肿瘤进展及不良预后有关[4-5]。尤其在结直肠癌中,LOXL2与肿瘤淋巴结转移和远处转移相关,而敲除LOXL2可使肿瘤细胞的增殖和迁移能力降低[6]。探寻新的肿瘤免疫治疗方法是目前研究结直肠癌的重要方向,因此,本研究基于生物信息学探讨LOXL2在结直肠癌中的表达模式和预后价值,并分析LOXL2与免疫浸润水平的潜在关系,以期探索免疫治疗新靶点和新思路,现报道如下。
1 材料与方法
1.1 材料
1.1.1组织标本
本实验中使用的人结肠癌组织芯片由上海芯超生物科技有限公司提供,组织芯片批号为HColA030PG06。
1.1.2实验试剂
LOXL2抗体购自英国Abcam公司,兔二步法检测试剂盒、DAB显色试剂盒购自北京中杉金桥生物技术有限公司。
1.2 方法
1.2.1免疫组织化学染色
组织芯片脱蜡后,按抗体说明修复抗原,进行DAB显色,苏木素复染,经乙醇梯度脱水和二甲苯透明后,滴加中性树胶封片,于显微镜下观察并摄片。
1.2.2Oncomine 数据库分析
Oncomine数据库(http://www.oncomine.org)是包含了715个数据集和86 733个标本的大型癌基因芯片数据库,可利用其分析LOXL2在结直肠癌与正常结直肠组织中的差异表达水平。设置筛选条件如下:P<0.05,表达水平变化>1.5倍,基因表达差异排序为Top 10%。
1.2.3GEPIA数据库分析
GEPIA数据库(http://gepia.cancer-pku.cn/)可基于TCGA和GTEx数据快速分析LOXL2在结直肠癌中的表达水平。检索LOXL2在结直肠癌与正常结肠组织的基因表达谱,条形图中条形的高度代表LOXL2在结直肠癌或正常结肠组织的中位表达水平。
1.2.4Human Protein Atlas数据库分析
Human Protein Atlas数据库(https://www.proteinatlas.org/)提供了多种人类蛋白质的组织和细胞分布信息,检索LOXL2在人正常结肠组织中免疫组织化学染色结果,分析其表达差异。
1.2.5LOGpc数据库分析
利用LOGpc数据库(http://bioinfo.henu.edu.cn/DatabaseList.jsp)分析LOXL2表达水平与结直肠癌患者临床预后的相关性。进入结直肠癌模块,选择GSE40967(n=579)数据集,设置LOXL2对应探针为202998_s_at,以upper 25%为界限划分高表达组和低表达组,分析总生存期,绘制生存曲线,并对该数据集Ⅰ期(n=37)、Ⅱ期(n=269)、Ⅲ期(n=209)及Ⅳ期(n=60)患者的临床预后进行分析。
1.2.6TIMER数据库分析
TIMER数据库(https://cistrome.shinyapps.io/timer/)可利用高通量测序数据全面、灵活地分析肿瘤组织中免疫细胞的浸润情况并可视化。本研究通过基因模块分析LOXL2与结直肠癌免疫浸润细胞的相关性,并通过相关模块分析LOXL2与结直肠癌中免疫浸润细胞标志物基因之间的关系。
1.2.7TISIDB数据库分析
TISIDB数据库(http://cis.hku.hk/TISIDB/)记录了多种与肿瘤免疫相关的基因与高通量筛选等数据,是肿瘤-免疫系统相互作用的综合信息存储库。本研究使用该数据库的淋巴细胞版块分析LOXL2与结直肠癌免疫浸润细胞的相关性。
1.3 统计学处理
采用R4.1.0软件进行数据分析,计数资料以频数表示,两组间比较采用Wilcoxon秩和检验,多组间比较采用Kruskal-Wallis检验;生存分析采用Kaplan-Meier法,应用log-rank检验生存差异;相关性分析采用Spearman相关性分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 LOXL2在结直肠癌中的表达水平
Oncomine数据库筛选发现,与正常结直肠组织比较,有13项研究显示LOXL2在结直肠癌组织中呈高表达水平。GEPIA数据库分析结果显示,LOXL2在结肠癌(中位表达水平:肿瘤标本=19.98,正常结肠组织=15.01)和直肠癌(中位表达水平:肿瘤标本=23.51,正常直肠组织=16.66)表达上调。LOXL2在正常结肠腺细胞中呈中等强度表达,在结肠腺癌组织中为强阳性表达,见表1、图1。
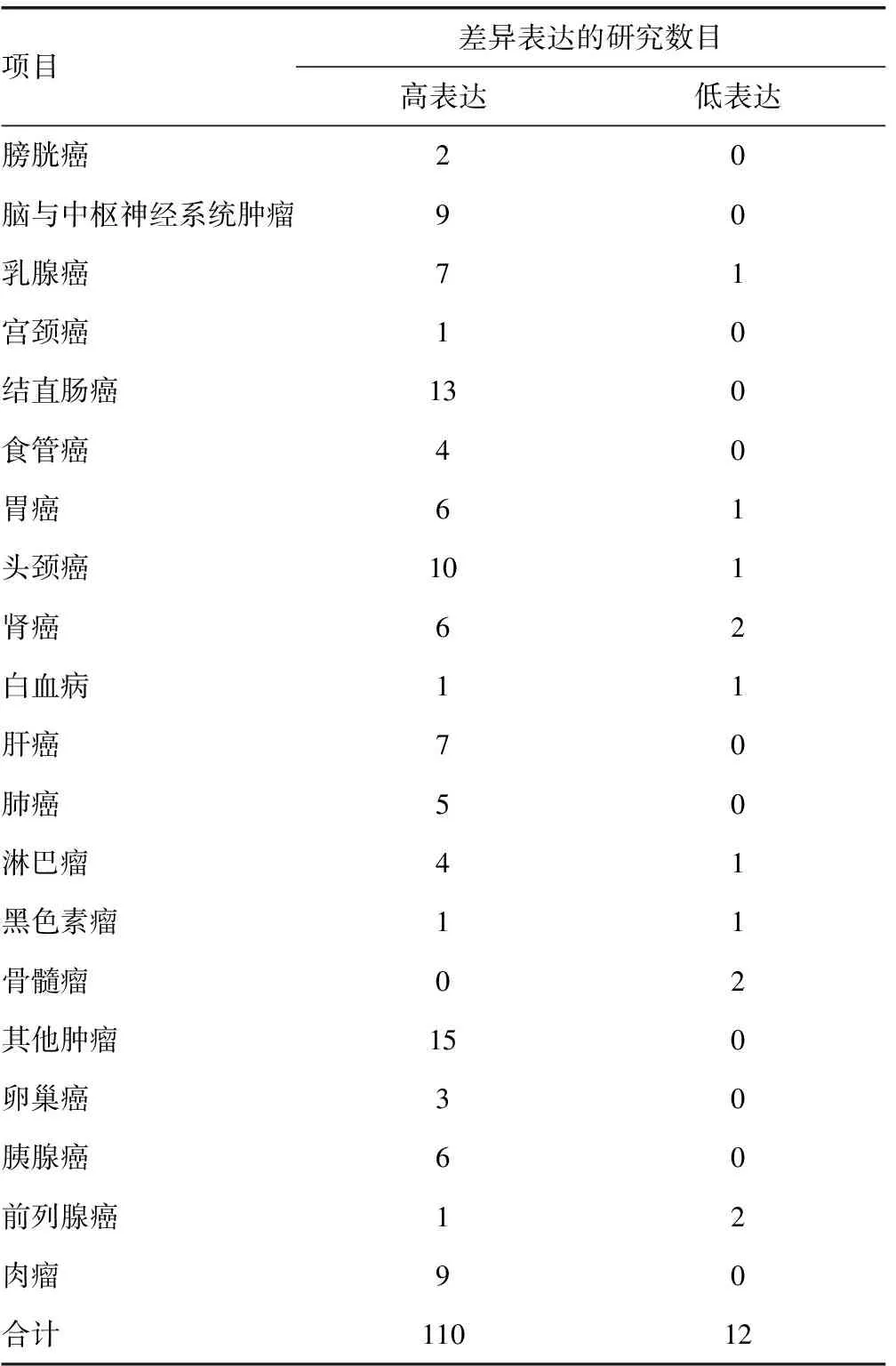
表1 LOXL2在不同肿瘤中的差异表达情况(n)
2.2 LOXL2表达水平与结直肠癌患者临床预后的相关性
LOXL2高表达组的总生存期明显低于LOXL2低表达组(P<0.05)。LOXL2高表达与Ⅰ期、Ⅳ期患者总生存期无相关性(P>0.05);与Ⅱ期患者总生存期比较,差异无统计学意义(P>0.05);与Ⅲ期患者总生存期比较,差异有统计学意义(P<0.05),见图2。

A:结直肠癌和正常结直肠组织中LOXL2表达水平比较;B:正常结肠组织中LOXL2的表达;C:结肠癌芯片中LOXL2的表达。
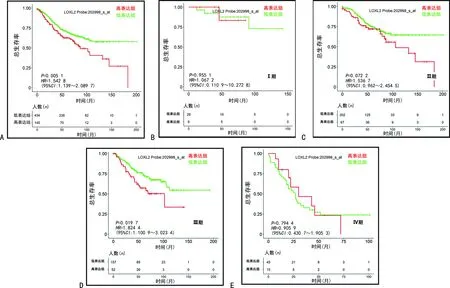
A:LOXL2不同表达水平的生存曲线;B:Ⅰ期患者的生存曲线;C:Ⅱ期患者的生存曲线;D:Ⅲ期患者的生存曲线;E:Ⅳ期患者的生存曲线。
2.3 LOXL2与结直肠癌中免疫细胞浸润水平的关系
LOXL2与结肠癌、直肠癌的肿瘤纯度呈负相关(结肠癌:r=—0.336,P<0.001;直肠癌:r=—0.269,P<0.001)。LOXL2与结直肠癌中CD8+T细胞(结肠癌:r=0.194,P<0.001;直肠癌:r=0.345,P<0.001)、树突状细胞(结肠癌:r=0.601,P<0.001;直肠癌:r=0.631,P<0.001)、巨噬细胞(结肠癌:r=0.469,P<0.001;直肠癌:r=0.401,P<0.001)和嗜中性粒细胞(结肠癌:r=0.521,P<0.001;直肠癌:r=0.583,P<0.001)的浸润水平均呈正相关。使用TISIDB数据库验证LOXL2与上述4种免疫细胞的关系,LOXL2与激活的树突状细胞(结肠癌:r=0.307,P<0.001;直肠癌:r=0.400,P<0.001)和嗜中性粒细胞(结肠癌:r=0.340,P<0.001;直肠癌:r=0.318,P<0.001)的浸润水平呈正相关,但与巨噬细胞(结肠癌:r=0.527,P<0.001;直肠癌:r=0.466,P<0.001)关系最密切,见图3。
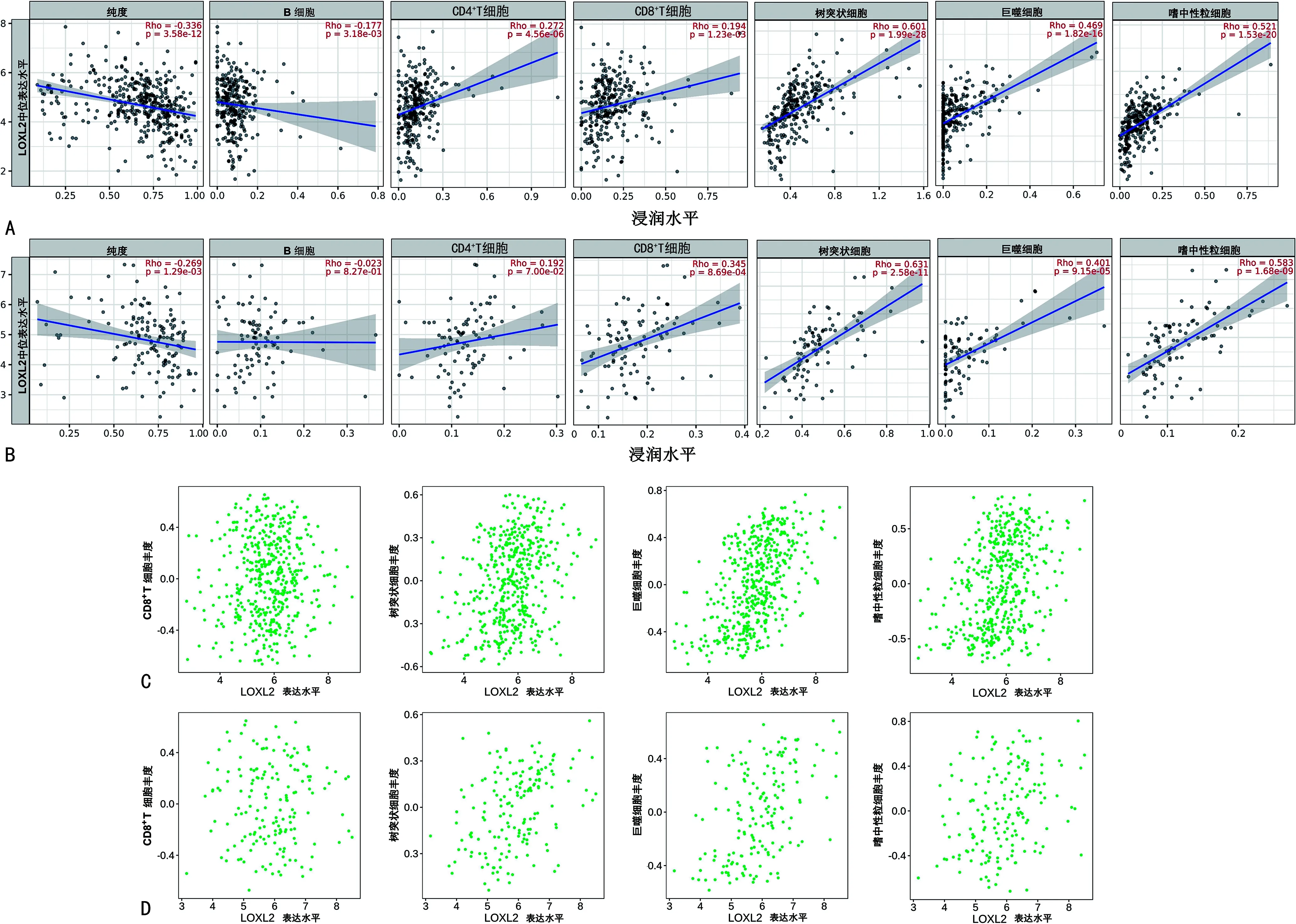
A:LOXL2与结肠癌中6种免疫细胞浸润水平的相关性;B:LOXL2与直肠癌中6种免疫细胞浸润水平的相关性;C:LOXL2与结肠癌中特定类型免疫细胞浸润水平的相关性;D:LOXL2与直肠癌中特定类型免疫细胞浸润水平的相关性。
2.4 LOXL2与结直肠癌中巨噬细胞标志物的相关性
结直肠癌中LOXL2与M1型巨噬细胞标志物干扰素调节因子(interferon regulatory factor,IRF)5、环加氧酶2(prostaglandin endoperoxide synthase 2,PTGS2)和信号转导与转录激活因子 (signal transducer and activator of transcription,STAT)1相关,与M2型巨噬细胞标志物IRF4、Toll-样受体8 (Toll-like receptors 8,TLR8)相关(P<0.05),见表2。
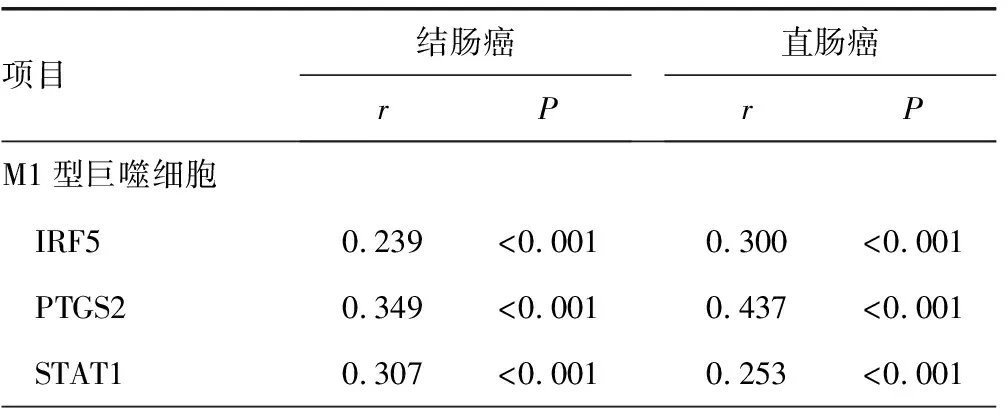
表1 LOXL2与结直肠癌中巨噬细胞标志物的关系

续表1 LOXL2与结直肠癌中巨噬细胞标志物的关系
3 讨 论
LOXL2对维持细胞外基质结构的完整性和稳定性具有重要的生理意义,并通过细胞外基质在肿瘤进展中起着极其关键的影响作用[7-8]。此外,LOXL2还可以调节肿瘤细胞上皮间质转化过程[9-10]、影响肿瘤血管生成等[11-13]。值得注意的是,LOXL2与肿瘤免疫也有着密切的关系。一方面,随着机体对肿瘤免疫应答的增强,可观察到LOXL2表达下调[14];另一方面,抑制LOXL2不仅可使肿瘤胶原沉积减少,还可提高T细胞浸润水平[15],有助于开发新的免疫治疗策略。目前LOXL2在结直肠癌领域的相关研究较少,而结直肠癌作为全球重点关注的健康问题,如何早期发现和有效治疗一直是研究重点[1]。随着对结直肠癌病理生理学认识的逐渐深入,科学家们相应提出了不少可供选择的治疗方案。近年来更有研究提出,结直肠癌是肿瘤免疫治疗的典范模型[16]。
因此,本研究提出探讨LOXL2在结直肠癌中的表达水平及临床意义,并结合免疫浸润初步探究其机制。(1)利用多种公共数据库及免疫组织化学法发现LOXL2在肿瘤组织和正常结直肠组织中的表达存在明显差异,在结直肠癌中表达上调。在预后价值方面,LOXL2高表达与结直肠癌患者较差的总生存期相关,且或许可用于对处于Ⅱ期~Ⅲ期的患者进行临床分级,并作为不良预后的分子标志物。(2)用TIMER和TISIDB两个数据库分析LOXL2与肿瘤免疫浸润的关系,发现LOXL2与结直肠癌中树突状细胞、巨噬细胞和嗜中性粒细胞的浸润水平相关。其中,本研究结果显示,LOXL2与巨噬细胞的浸润水平及其细胞标志物关系最密切。巨噬细胞是慢性炎症的重要组成部分,参与了包含肿瘤在内的多种人类疾病[17]。巨噬细胞可分为M1型巨噬细胞和M2型巨噬细胞两大类,M1型巨噬细胞可吞噬肿瘤细胞,而M2型巨噬细胞则可促进肿瘤生长和侵袭。不少研究表明,巨噬细胞分化及表型改变可促进肿瘤进展[18-19],而浸润在肿瘤微环境中的巨噬细胞一旦转变为M2型,即可募集并表达细胞因子和趋化因子,进而成为肿瘤发展的关键驱动因素[20]。尤其在结直肠癌中,M2型巨噬细胞数量比M1型多,不仅抑制抗肿瘤免疫[21],其衍生的外泌体还可诱导结直肠癌细胞侵袭与迁移[22],提示M2型巨噬细胞和结直肠癌密切相关。基于此,有人提出了靶向巨噬细胞用于肿瘤免疫治疗的策略[23]。而本研究发现结直肠癌中LOXL2与巨噬细胞之间存在很强的关系,这不仅进一步证实LOXL2对结直肠癌发生、发展有重要作用,还提示LOXL2可能参与结直肠癌中的巨噬细胞极化。
综上所述,LOXL2在结直肠癌中的高表达与患者预后不良相关,可作为结直肠癌的预后生物标志物。此外,LOXL2表达可能有助于巨噬细胞等肿瘤免疫浸润细胞的调节。尽管其具体作用机制还需深入研究,但LOXL2在结直肠癌领域扮演的重要角色是不可忽视的,或许还可作为免疫治疗的潜在靶点。



