刘钦成,刘 宁,韩晓玉,郭凌宏,王春明,廖彩仙
(南方医科大学南方医院肝胆外科,广州 510515)
在我国,感染乙型病毒性肝炎(以下简称乙肝)是导致肝硬化的主要病因。目前,肝硬化诊断的金标准为肝脏穿刺活检。《病毒性肝炎防治方案》[1]在病理诊断上将肝纤维化分为4期,而第4期则为肝硬化期。随着治疗深入,人们早已发现肝硬化存在可逆转的可能性[2-3]。为了更加准确评估肝硬化水平,故此在第4期肝硬化水平的基础上对其再分级确有必要。而Laennec肝纤维化分级系统可再将肝硬化期分为3个阶段,进一步区分了不同程度的肝硬化[4]。但鉴于肝组织活检术的有创性,需要进一步积极寻找无创性检查替代其诊断肝硬化。在形态学上,肝硬化可导致肝脏呈现全肝弥漫性小结节样改变,而且体积明显缩小,质量减轻,硬度增加。多层螺旋CT(MSCT)可帮助获取相关肝脏体积(liver volume,LV)变化方面的信息[5-6]。肝脏瞬时弹性成像(Fibroscan,FS)利用超声波对肝脏弹性硬度进行检测,可以得到肝脏弹性值(liver stiffness measurement,LSM)。虽然检测结果受多种因素的影响,但仍然可以在一定程度上反映肝脏的真实弹性硬度[7]。本研究以乙肝后肝硬化患者的Laennec组织病理学分级为标准,观察CT测量LV变化、LSM和Child-Turcotte-Pugh(CTP)评分在肝硬化程度量化诊断中的价值。
1 资料与方法
1.1一般资料 选择2009年6月至2016年5月在本院住院的乙肝后肝硬化患者32例。纳入标准:(1)血清学检查提示乙肝表面抗原(HBsAg)阳性,乙肝病毒定量阳性;(2)术前1周内行肝、胆、胰、脾增强CT和肝脏FS检查;(3)接受手术治疗患者在术中行肝组织活检术或非接受手术患者在超声引导下经皮肝穿刺活检术,且病理结果诊断为结节性肝硬化。排除标准:(1)合并丙型肝炎;(2)有长期饮酒史(时间超过5年,日均饮酒量折合乙醇大于40克)或临床诊断合并酒精性肝病;(3)术前1周影像学检查提示有肝占位性病变;(4)合并有胆道梗阻性疾病。32例患者中6例为脾切除加断流手术,患者在手术中行肝组织活检术;26例为非手术治疗患者,行超声引导下经皮肝穿刺活检术。32例患者中,男26例、女6例;年龄28~61岁,平均(40.68±10.12)岁;身高153~176 cm,平均(166.54±6.14)cm;体质量45~90 kg,平均(64.89±10.62)kg。术前48 h内的清蛋白(ALB)29.50~47.60 g/L,平均(38.32±4.34)g/L;丙氨酸转氨酶(ALT) 9.00~305.00 U/L,平均(72.93±64.41)U/L;天冬氨酸氨基转移酶(AST)10.00~426.00 U/L,平均(85.75±92.02)U/L;总胆红素(TBIL)5.50~160.20 μmol/L,平均(24.14±29.77)μmol/L;凝血酶原时间(PT)11.10~17.10 s,平均(14.12±1.41)s。无腹腔积液26例,少量腹腔积液4例,中量腹腔积液2例。CTP评分5~9分,平均(6.06±1.24)分,其中CTP评分A级有22例,B级10例。
1.2方法
1.2.1CT数据采集、测量和计算 采用64层螺旋CT成像技术和Mimics三维重建技术。术前1周内对32例患者行CT肝、胆、胰、脾增强扫描检查,然后将32例CT图像逐一导入Mimics10.01软件,并计算得到CT所测的LV。患者的标准LV(SLV)[8]、体表面积(BS)[9]、LV萎缩率[5]计算公式如下:
SLV(cm3)=613×BS(m2)+162.8
(1)
BS(m2)=0.006 1×身高(cm)+0.012 4×体质量(kg)-0.009 9
(2)
LV萎缩率=(SLV-CT所测LV)/SLV×100%
(3)
1.2.2肝脏FS检查 LSM的测定是特意由1位专业负责的医师操作FS扫描仪(产自法国EchoSenS 公司)进行检测,至少获取10 次成功测量结果,最终取其中位数为肝脏弹性值(单位为 kPa)。
1.2.3肝组织活检术及组织病理学分级 按照《肝纤维化诊断及疗效评估共识的要求》[7],肝组织标本行苏木精-伊红(HE)、网状纤维和(或)Masson 3色染色,然后依据Laennec肝纤维化分级系统[4],将肝硬化的病理结果分类轻、中、重3组。
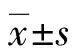
2 结 果
2.1组织学分级及患者一般情况 32例患者中有9例(28.12%)为轻度肝硬化,12例(37.50%)为中度肝硬化,11例(34.38%)为重度肝硬化。年龄分别为41.11(28~60)岁、43.83(29~61)岁、38.09(28~48)岁;3组患者中男性占比分别为88.89%、66.67%、90.91%;体质量分别为66.22(58~79)kg、62.13(45~90)kg、65.91(52~80.)kg;身高分别为167.56(161~173)cm、165.88(158~175)cm、166.18(153~176)cm。3组患者的年龄、性别、体质量、身高比较,差异无统计学意义(P>0.05)。
2.2LV萎缩率与肝硬化组织病理学分级的关系 轻、中、重3组患者SLV分别为(1 286.64±72.08)、(1 250.19±99.09)、(1 279.12±85.31) cm2,3组患者SLV组间比较差异无统计学意义(F=0.53,P=0.60);CT测量LV分别为(1 071.04±62.95)、(960.47±103.56)、(822.41±69.35) cm2,3组患者组间比较差异有统计学意义(F=22.81,P<0.01);LV萎缩率分别为(16.75±2.20)%、(23.11±6.67)%、(35.55±5.70)%,3组患者组间比较差异有统计学意义(F=31.74,P<0.01)。对LV萎缩率与肝硬化组织病理分级进行Spearman相关分析,结果显示LV萎缩率与肝硬化组织病理分级呈明显正相关(r=0.93,P<0.01)。为进一步探索LV萎缩率在肝硬化组织病理再分级中的诊断作用:(1)把阳性事件认定为中、重度肝硬化,画出ROC曲线(图1A),ROC曲线下面积(AUC)为0.90,其标准误为0.06,LV萎缩率在判断中、重度肝硬化时差异有统计学意义(P=0.001)。当选LV萎缩率为19.63%作为界值时,特异度为88.90%,灵敏度为82.60%,阴性预测值(NPV)为66.67%,阳性预测值(PPV)为95.00%,阴性似然比(NLR)为0.19,阳性似然比(PLR)为7.44。(2)把阳性事件认定为重度肝硬化,画出ROC 曲线(图1B),AUC为0.96,其标准误为0.03,LV萎缩率在判断重度肝硬化时差异有统计学意义(P<0.01)。当选取LV萎缩率为28.57%为界值时,特异度为85.70%,灵敏度为90.90%,NPV为90.00%,PPV为75.00%,NLR为0.11,PLR为6.36。

A:中、重度肝硬化;B:重度肝硬化
图1 LV萎缩率预测中、重度肝硬化的ROC曲线
2.3LSM与肝硬化组织病理学分级的关系 轻、中、重3组患者LSM分别为(14.96±3.36)、(20.21±3.07)、(37.03±16.44)kPa,3组患者组间比较差异有统计学意义(F=13.85,P<0.01)。对LSM与肝硬化组织病理分级进行Spearman相关分析,结果表明LSM与肝硬化组织病理分级呈明显正相关(r=0.74,P<0.01)。为进一步探索LSM在肝硬化病理再分级中的诊断作用:(1)把阳性事件认定为中、重度肝硬化:画出ROC 曲线(图2A),AUC为0.91,其标准误为0.05,LSM在判断中、重度肝硬化时差异有统计学意义(P<0.01)。当选取LSM为17.45 kPa为界值时,特异度为77.80%,灵敏度为87.00%,NPV为70.00%,PPV为90.91%,NLR为0.17,PLR为3.92。(2)把阳性事件认定为重度肝硬化:画出ROC曲线(图2B),AUC为0.87,其标准误为0.08,LSM在判断重度肝硬化是否存在时差异有统计学意义(P=0.001)。当选取LSM为24.85 kPa为界值时,特异度为95.20%,灵敏度为72.00%,NPV为86.96%,PPV为88.89%,NLR为0.29,PLR为15.15。
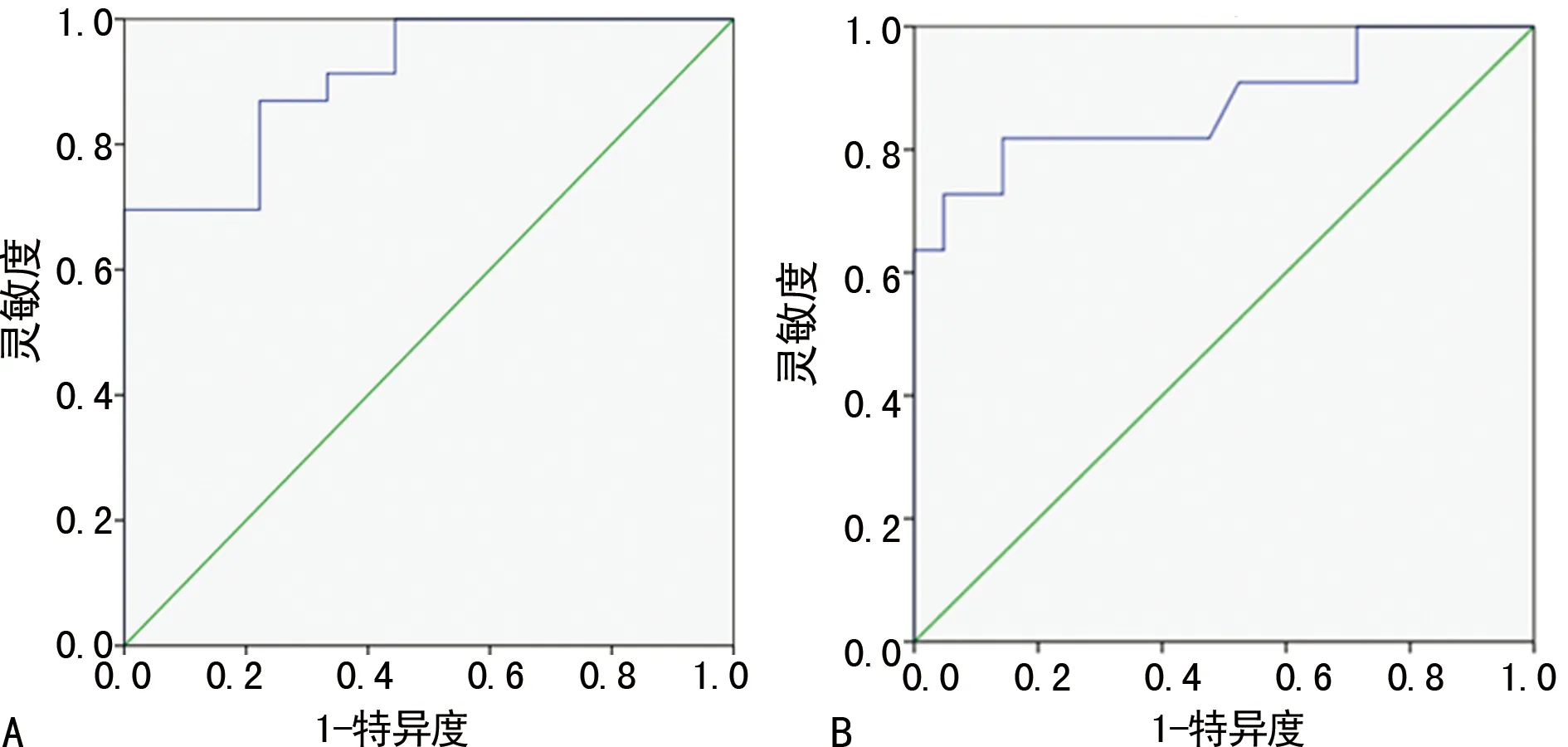
A:中、重度肝硬化;B:重度肝硬化
图2 LSM值预测中、重度肝硬化的ROC曲线
2.4CTP评分与肝硬化组织病理学分级的关系 轻、中、重3组患者CTP评分的均值分别为(5.56±1.01)、(6.08±1.08)、(6.45±1.51)分,组间比较差异无统计学意义(F=1.33,P=0.28)。对CTP评分与肝硬化组织病理学分级进行Spearman相关分析,结果显示CTP评分与肝硬化组织病理分级无明显相关(r=0.27,P=0.28)。
2.5LV萎缩率与LSM的关系 将LV萎缩率与LSM进行Spearman相关分析,结果显示LV萎缩率与LSM明显正相关(r=0.90,P<0.01)。以中、重度肝硬化为阳性事件条件下,把LV萎缩率及LSM作为平行诊断试验的联合灵敏度为97.74%,联合特异度为69.16%;以重度肝硬化为阳性事件条件下,若把LV萎缩率及LSM作为平行诊断试验的联合灵敏感度为97.45%,联合特异度为81.59%。
2.6LV萎缩率与CTP评分值的关系 将LV萎缩率与CTP评分值进行Spearman相关分析,结果显示LV萎缩率与CTP评分值呈明显正相关(r=0.91,P<0.01)。
2.7LSM与CTP评分值的关系 将LSM与CTP评分值进行Spearman相关分析,结果显示LSM与CTP评分值无明显相关(r=0.15,P=0.40)。
3 讨 论
目前,据报道我国肝硬化患者最主要的病因是感染乙肝病毒,比例高达约60%[10]。乙肝病毒反复影响肝脏,最终导致假小叶形成,LV缩小,质地变硬[11]。我国《病毒性肝炎防治方案》[1]就其病理改变,将纤维化程度分为1~4期,而肝硬化是其中第4期。Laennec肝纤维化分级系统是在METVAIR分级系统的基础上,根据镜下病理组织纤维间隔及厚度,再将肝硬化期进一步分为A、B、C 3个阶段,即细分化为轻度、中度、重度肝硬化3个等级,更好地辨别了不同程度的肝硬化。
《肝切除前肝脏储备功能评估的专家认识》提出CTP评分是最常用于判断肝脏储备功能的评分系统[12]。虽然本研究中未能得出CTP评分与Laennec组织病理学分级的相关性,可能与纳入病例数不够多,且无CTP评分C级病例有关,但是既往有学者研究表明二者之间存在较好的相关性。还有学者认为,Laennec组织病理学分级与肝硬化临床分期及门静脉压力联系紧密[4,13]。有学者认为,Laennec组织病理学分级能够预测乙肝相关的肝癌切除术后预后情况[14];而且Laennec组织病理学分级能对围术期的风险评估有作用[15]。王薇等[16]经检测肝活检组织中羟脯氨酸水平,发现了Laennec组织病理学分级系统可以一定程度地反应肝脏硬化程度、临床阶段及肝功能情况。李继业等[17]对60例肝硬化患者进行回顾性研究,发现FS检测值与Laennec肝硬化组织病理学分级系统呈正相关。以上研究均表明Laennec组织病理学分级具有重要的临床价值。
在形态学上可得知,在肝硬化过程中,LV变小,肝脏硬度增加。有研究报道,肝脏LSM测定是一种可以反应肝纤维化程度的无创性肝脏硬度定量测量方法[7]。MSCT可获得病肝的体积,通过比对SLV与CT测量LV的差值,可得到LV萎缩率。据分析,CT测量LV值与肝脏实际体积测定值接近[18],临床广泛应用CT测量LV,LV测量亦是评估肝脏储备功能的方法之一[12]。更有学者认为,肝细胞数量可由LV直接反映,在形态上直接衡量肝脏储备功能[19]。但是因为BS的不同,每个人的LV必然存在差异。因此LV萎缩率能更准确反映肝脏储备功能。黎一鸣等[5]还发现,LV萎缩率与CTP 评分存在相关性。
本研究对经肝组织活检术后并诊断为乙肝后肝硬化的患者,按照Laennec组织病理学分级将其分为轻、中、重3组,发现LSM、LV萎缩率在轻、中、重3组患者间比较差异均有统计学意义(P<0.05);LSM、LV萎缩率随着肝硬化程度的加重而增加。LSM 在判断重度肝硬化及中、重度肝硬化是否存在的AUC分别为0.87、0.91。选LSM=24.85 kPa 为诊断界点时,判断重度肝硬化的NLR为0.29,PLR为15.15;选LSM=17.45 kPa为诊断界点时,判断中、重度肝硬化的NLR为0.17,PLR为3.92。LV萎缩率在判断重度肝硬化及中、重度肝硬化是否存在的AUC分别为0.96、0.90。选LV萎缩率=28.57%为诊断界点时,判断重度肝硬化的NLR为0.11,PLR为6.36;选LV萎缩率=19.63%为诊断界点时,判断中重度肝硬化的NLR为0.19,PLR为7.44。在统计学上定义,PLR>10.0的界值可以诊断疾病,而NLR<0.1的界值可以排除疾病。故可得出结论,当LSM<17.45 kPa时,轻度肝硬化的可能性大;当LSM>24.85 kPa时,重度肝硬化的可能性大。当LV萎缩率小于19.63%时,轻度肝硬化可能性大;当LV萎缩率小于28.57%时,排除重度肝硬化可能性大。
通过研究LSM与LV萎缩率的相关性,发现二者之间的相关系数为0.90,具有高度相关性。若将LV萎缩率及FS检测值联合当做肝硬化程度平行诊断试验时(只需满足其中1项阳性结果即可)有以下推测,当LSM<17.45 kPa或LV萎缩率小于19.63%时,则轻度肝硬化可能性大,其联合灵敏度为97.74%,联合特异度为69.16%;当LSM>24.85 kPa或LV萎缩率大于28.57%时,则重度肝硬化可能性大,其联合灵敏度为97.45%,联合特异度为81.59%。
本研究结果表明,运用Laennec组织病理学分级发现LSM和LV萎缩率对肝硬化程度有一定的量化诊断价值,可以作为无创性诊断肝硬化程度的量化指标。而Laennec组织病理学分级与CTP评分无明显相关性,证明肝硬化的组织病理学变化与功能学变化可能不一致,而CTP评分可能仅反应肝脏功能学水平上的变化。以上研究提示日后可以进一步扩大纳入患者的数量,更深层研究肝硬化并发症等情况,为肝硬化组织病理分级与临床无创诊断的进一步研究作出铺垫。
[1]中华医学会传染病与寄生虫病学分会,肝病学分会.病毒性肝炎防治方案[J].中华肝脏病杂志,2000,8(6):324-329.
[2]DOLMAZASHVILI E,ABUTIDZE A,CHKHARTISHVILI N,et al.Regression of liver fibrosis over a 24-week period after completing direct-acting antiviral therapy in patients with chronic hepatitis C receiving care within the national hepatitis C elimination program in Georgia:results of hepatology clinic HEPA experience[J].Eur J Gastroenterol Hepatol,2017,29(11):1223-1230.
[3]JUNG Y K,YIM H J.Reversal of liver cirrhosis:current evidence and expectations[J].Korean J Intern Med,2017,32(2):213-228.
[4]KIM M Y,CHO M Y,BAIK S K,et al.Histological subclassification of cirrhosis using the Laennec fibrosis scoring system correlates with clinical stage and grade of portal hypertension[J].J Hepatol,2011,55(5):1004-1009.
[5]黎一鸣,吕凡,吉鸿,等.肝脏体积变化与病肝储备功能的关系研究[J].中华普通外科杂志,2003,18(2):79-81.
[6]LEE C H,KIM I H,MOON J C,et al.3-Dimensional liver volume assessment in patients with hepatitis B virus-related liver cirrhosis during long-term oral nucleos(t)ide analogues therapy[J].World J Gastroenterol,2017,23(2):297-305.
[7]肝脏硬度评估小组.瞬时弹性成像技术诊断肝纤维化专家意见[J].中华肝脏病杂志,2013,21(6):420-424.
[8]黎一鸣,吕凡,白芝兰,等.国人正常肝脏
体积计算公式的研究及意义[J].陕西医学杂志,2002,31(7):634-636.
[9]胡咏梅,武晓洛,胡志红,等.关于中国人体表面积公式的研究[J].生理学报,1999,51(1):45-48.
[10]王贵强,王福生,成军,等.慢性乙型肝炎防治指南(2015年更新版)[J].临床肝胆病杂志,2015,31(12):1941-1960.
[11]南月敏,蒋树林,姚希贤.肝硬化病理与发病机制[J].中国全科医学,2003,6(5):364-365.
[12]董家鸿,郑树森,陈孝平,等.肝切除术前肝脏储备功能评估的专家共识(2011版)[J].中华消化外科杂志,2011,10(1):20-25.
[13]RASTOGI A,MAIWALL R,BIHARIC,et al.Cirrhosis histology and Laennec staging system correlate with high portal pressure[J].Histopathology,2013,62(5):731-741.
[14]KIM S U,JUNG K S,LEE S,et al.Histological subclassification of cirrhosis can predict recurrence after curative resection of hepatocellular carcinoma[J].Liver Int,2014,34(7):1008-1017.
[15]ZHANG E L,ZHANG Z Y,WANG S P,et al.Predicting the severity of liver cirrhosis through clinical parameters[J].J Surg Res,2016,204(2):274-281.
[16]王薇,李继业,潘润华,等.Laennec组织病理学分级与HYP含量、临床分期及肝功能的关系[J].肝胆胰外科杂志,2015,27(2):89-93.
[17]李继业,王薇,潘润华,等.肝脏FibroScan测定和功能评分与肝硬化病理分级的相关性[J].山东大学学报(医学版),2014,52(12):83-88.
[18]Sakamoto S,Uemoto S,Uryuhara K,et al.Graft size assessment and analysis of donors for living donor liver transplantation using right lobe[J].Transplantation,2001,71(10):1407-1413.
[19]周鸿,吴志勇,王少华,等.功能性肝脏体积的测量及临床意义[J].外科理论与实践,2001,6(6):386-389.



