周意园,邓东阳
(贵阳中医学院第一附属医院产科,贵阳 550002)
孕期内分泌系统的变化使人绒毛膜促性腺激素(human chorionic gonadotrophin,HCG)、雌激素等分泌增加,导致孕妇甲状腺激素水平变化[1]。亚临床甲状腺功能减退症(亚临床甲减)是妊娠期常见的甲状腺疾病,占妊娠妇女的2%~3%[2-3]。亚临床甲减不仅可造成流产、早产等不良妊娠结局,而且可损伤神经系统发育,导致智力下降。使用非妊娠期甲状腺激素参考值水平可能会出现妊娠期甲状腺功能异常的误诊及漏诊[4]。且我国不同地区妇女的碘营养状况具有一定差异,采用统一的妊娠妇女甲状腺激素参考值范围显然难以适合所有的妊娠妇女。2012年中国《妊娠和产后甲状腺疾病诊治指南》推荐,各地区应建立本地区特异的妊娠期甲状腺功能参考值[5]。本研究对贵阳地区妊娠早、中、晚期孕妇的血清甲状腺激素水平进行检测,建立适合贵阳地区的妊娠期甲状腺功能特异性参考值范围,为妊娠期甲状腺疾病的临床诊治提供参考依据,现将结果报道如下。
1 资料与方法
1.1一般资料 选取2016年1-12月在本院产检的360 例单胎孕妇,作为妊娠期甲状腺激素水平参考值范围的标准人群,其中孕早期(孕1-12周末)、孕中期(孕13-27周末)、孕晚期(孕28-40周)妇女各120 例。孕早期组年龄21~39岁,平均(27.63±4.32)岁,平均孕次(1.83±0.32)次;孕中期组年龄20~37岁,平均(26.91±4.52)岁,平均孕次(1.75±0.27)次;孕晚期组年龄 22~38岁,平均(27.26±4.34)岁,平均孕次(1.72±0.24)次。另选取同时间段在本院行健康体检的非妊娠期妇女120例为参考人群(对照组),年龄23~45岁,平均(27.22±4.59)岁,平均孕次(1.71±0.26)次。4组对象的年龄、孕次等差异均无统计学意义(P>0.05)。
1.2纳入与排除标准 纳入标准:(1)年龄20~40周岁;(2)贵阳市户籍或在贵阳居住10年以上;(3)计划妊娠;(4)未服用影响甲状腺功能药物。排除标准:(1)有甲状腺疾病史、甲状腺疾病家族史者;(2)有糖尿病、高血压等其他慢性疾病者;(3)可触及甲状腺结节者;(4)抗甲状腺抗体阳性者。所有研究对象均签署知情同意书,研究获医院伦理委员会批准。
1.3方法 所有研究对象均抽取清晨空腹静脉血5 mL,以5 000 r/min离心15 min,置于-70 ℃冰箱集中保存待检,采用电化学发光法检测血清促甲状腺激素(thyroid stimulating hormone,TSH)、游离三碘甲状腺原氨酸(free triiodothyronine,FT3)、游离甲状腺素(free thyroxine,FT4)。仪器:Centaur自动化学发光免疫分析仪(西门子公司),试剂:雅培Abbott Axsym试剂盒(批号:70588Q100),按说明书操作。TSH、FT3、FT4试剂盒批内变异系数(CV)分别为1.13%~2.04%、1.23%~2.06%、2.12%~3.07%,批间变异系数(CV)分别为2.24%~3.05%、2.46%~4.70%、3.24%~5.02%。
2 结 果
2.14组血清TSH、FT3和FT4检测结果 孕早、中、晚期TSH、FT3和FT4均明显低于对照组(P<0.05),孕晚期与孕中期比较TSH差异无统计学意义(P=0.084),其余各组间比较,差异均有统计学意义(P<0.05),见表1。
表1 4组血清TSH、FT3和FT4检测结果比较
a:P<0.05,与对照组比较;b:P<0.05,与孕中期组比较;c:P<0.05,与孕早期组比较
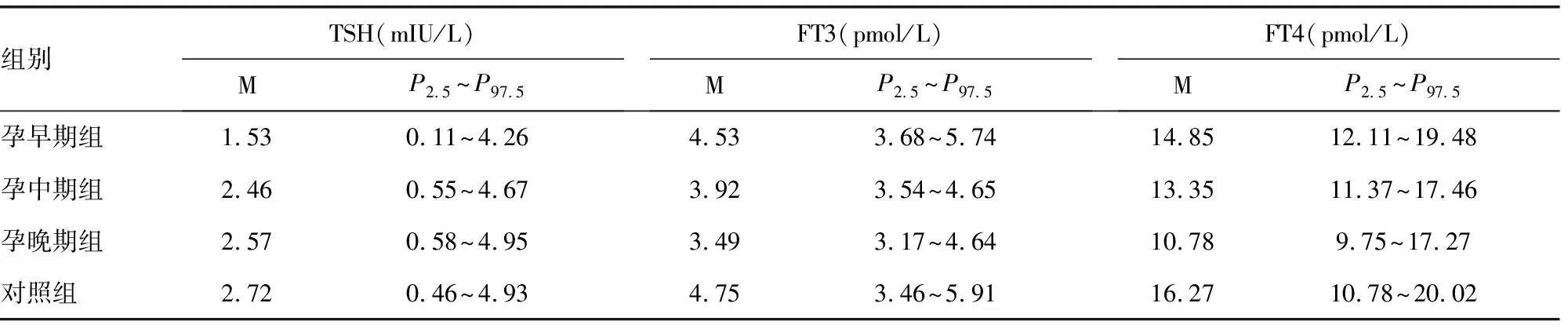
表2 4组血清TSH、FT3和FT4的参考区间
2.24组血清TSH、FT3和FT4的参考值范围 TSH在孕早期较低,随妊娠周数的增加而上升,至孕晚期达最高。而FT3和FT4在孕早期较高,此后均随妊娠周数增加而下降,至孕晚期分别降至最低水平。对照组的参考区间与本实验室原有的参考区间无区别,见表2。
2.3妊娠期各参考值范围诊断亚临床甲减结果 参照ATA 指南与本研究制订的参考值范围进行诊断,本研究参考值范围诊断早期亚临床甲减的患病率明显低于ATA标准,2种诊断标准诊断孕早、中、晚期亚临床甲减,差异有统计学意义(P<0.01),见表3。
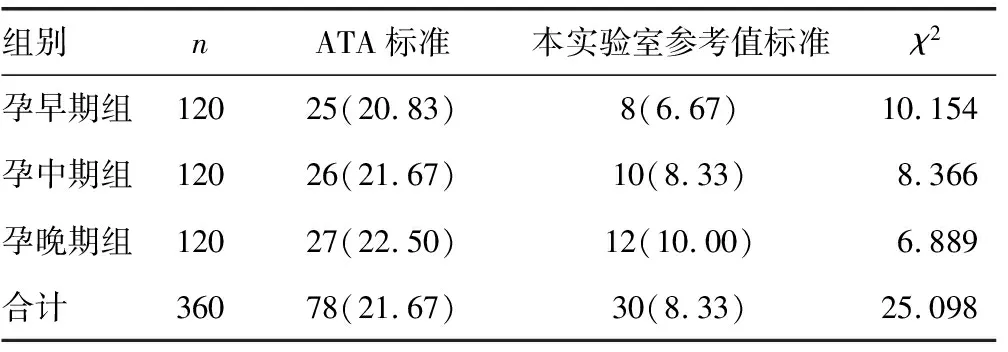
表3 2种诊断标准诊断不同孕期亚临床甲减结果[n(%)]
3 讨 论
妊娠期体内甲状腺激素受下丘脑、垂体和胎盘分泌激素的影响,会出现生理性改变,而产生与非妊娠期不同的变化。孕期甲状腺激素正常参考值因受各地区碘营养状态不同而存在一定的差异,因此建立不同地区妊娠期特异性甲状腺激素参考值对妊娠期甲状腺功能异常的诊治十分必要。孕期胎盘分泌雌激素增多,并刺激肝脏合成球蛋白,血清甲状腺与球蛋白的结合增多;胎盘大量分泌HCG 可反馈性抑制垂体分泌TSH,因此TSH在孕8~10 周时降至低水平,孕12 周后逐步向正常水平恢复[6]。FT4 通常在正常范围,妊娠早期可轻微上升,到妊娠中、晚期后可稍降低[7]。本研究对孕早、中、晚期孕妇检测甲状腺激素水平,结果与上述变化特点相符。TSH水平在孕早期较低,低于非妊娠期妇女,随妊娠的持续而逐渐升高,至孕中、晚期时TSH恢复至较高的水平。妊娠期由于血清甲状腺结合球蛋白水平增高,可导致FT4降低,而甲状腺结合球蛋白水平主要在孕早、中期增高,至孕中期时达到峰值。本研究FT4在孕早期较高,孕中期时水平降低,至孕晚期进一步降低,且差异有统计学意义(P<0.05),与其他研究基本一致[8-9]。本研究结果显示,孕早期FT3水平低于对照组,至孕中、晚期呈下降趋势,与柯文才等[10]研究一致。
美国ATA于2015年颁布的《妊娠期和产后甲状腺疾病诊断和处理指南》中推荐的TSH孕早、中及晚期参考值上限分别为2.5、3.0、3.0 mIU/L。本研究采用牙培Abbott Axsym试剂盒,以电化学发光法检测本院孕检的本地常住孕妇甲状腺激素水平,孕早、中、晚期的TSH参考值分别为0.11~4.26、0.55~4.67与0.58~4.95 mIU/L。罗军等[11]在上海采用罗氏试剂检测得到的孕早、中、晚期TSH参考值分别为0.05~5.17、0.39~5.22与0.60~6.84 mIU/L。薛海波等[12]对孕早期妇女TSH上升与幼儿智力发育的关系进行研究发现,TSH≥3.93 mIU/L的孕妇子女智力发育指数明显下降,而TSH介于2.50~3.93 mIU/L的孕妇子女智力发育指数正常。因此,如果采用ATA推荐的参考值诊断,可能过度诊断孕期亚临床甲减,导致不必要的焦虑及有限的医疗资源浪费。本研究制订的孕早、中、晚期TSH、FT3、FT4参考值范围,与ATA 指南中的相应参考值范围相比,参考值范围上限高于ATA 指南,采用本研究的参考值范围诊断孕早、中、晚期亚临床甲减的患病率均较采用ATA标准的患病率低,总患病率为8.33%,与王蕴慧等[13]报道6.78%的患病率比较接近。导致妊娠期血清TSH、FT3、FT4差异的原因可能为我国人群血清甲状腺激素的本底水平普遍偏高。因此,制订本地区妊娠期妇女甲状腺指标参考值范围十分必要,不仅能及时纠正妊娠妇女的甲状腺功能异常,还能克服孕期甲状腺疾病的过度诊断与治疗。
本研究建立了贵阳地区孕早、中、晚期孕妇甲状腺激素水平的正常参考值范围,可以为孕期甲状腺功能监测及临床诊治提供科学依据。需要指出的是,妊娠期妇女甲状腺功能变化比较复杂,不能仅根据单次检查结果就进行诊断,而需进行动态随访。今后,本研究将进一步扩大样本量,得出更为稳定的孕期甲状腺激素水平参考值范围。



