杨兆鑫
(山东中医药大学管理学院 250355)
一、根据氧化还原反应方程式进行判断
强氧化剂+强还原剂=弱还原产物+弱氧化产物
在氧化还原反应方程式中,强氧化剂得到电子,它被还原得到弱还原产物,强还原剂失去电子,它被氧化得到弱氧化产物;因为强制弱,所以氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物.氧化剂的氧化性越强,它所对应的还原产物的还原性就越弱;同理可得:还原剂的还原性越强,它所对应的氧化产物的氧化性也就越弱.
这条规律可以应用于判断氧化还原反应是否能够发生即需要知道反应物中氧化性、还原性强弱问题,还可以应用于比较粒子之间的氧化性、还原性强弱.并且会利用强制弱的原理,在适宜条件下使用氧化性强的物质制备氧化性弱的物质,或者利用还原性强的物质制备还原性弱的物质等等.
二、根据不同的反应条件下的氧化还原反应进行判断
根据氧化还原反应进行的难易程度,比如说反应条件或者剧烈程度,不同的氧化剂的氧化性是不同的,当它们同时去氧化同一种物质时,氧化剂的氧化性越强,则对反应时所需的条件要求也越低,倘若氧化剂氧化性越弱,那幺,它氧化同种物质所需的反应条件要求也就越高,这时反应就很难发生了.
例1根据以下一些客观事实回答问题:
①在实验室里制取氯气的化学方程式为:
即使用MnO2和浓盐酸的反应来制取氯气.
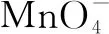

③古代曾有人使用氯化铜作为反应的催化剂,在450°的高温之下,用空气中的氧气与氯化氢发生反应制成氯气,这种方法也被称为“地康法”,该反应的化学方程式为
(1)从以上介绍制取氯气的3种方法中,它们的元素化合价变化有什幺共同之处吗?
(2)根据上述反应发生的描述,可以知道氧化剂氧化性强弱的排序是怎样的?
解析仔细阅读题目之后,可以知道3个反应都是制取氯气的方法,但是每个反应发生的条件是不同的,所以可以根据反应进行所需的反应条件要求的高低来判断氧化剂氧化性的强弱排序,氧化剂的氧化性越强,那幺它发生反应所需的条件要求就更低,反之,氧化剂的氧化性越弱,它反应所需的条件就越加苛刻.由题意可知:
(1)氯元素的化合价都是失去电子,被氧化,则从-1价升高到0价.
(2)根据3个反应发生的条件来判断氧化剂的氧化性:高锰酸钾在常温下就可以与浓盐酸发生反应;二氧化锰则需要在加热的条件下才可以与浓盐酸发生反应;
(3)反应条件最为苛刻,氧气需要在高温下,并且还需要催化剂氯化铜来催化反应,才能与HCl发生反应.因此,可以知道3种氧化剂的氧化性由强到弱排序为:KMnO4>MnO2>O2.
三、根据物质被氧化或者被还原的不同程度进行判断
以还原剂为例,如果同一个氧化剂和不同的还原剂发生反应,还原性越强的还原剂能使氧化剂的化合价降低得越多,同理,同一个还原剂与不同的氧化剂发生反应,氧化性越强的氧化剂能使还原剂的化合价升高得越多.
同一还原剂与不同氧化剂反应时,可以根据还原剂被氧化的程度来判断氧化剂的氧化性强弱.例如:
由此可得氧化性:Cl2>S.
还可以根据同一氧化剂与不同还原剂反应时,氧化剂被还原的程度来判断不同还原剂的还原性.例如:
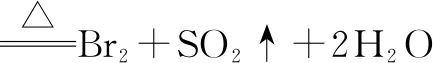

由此可得还原性:HI>HBr.
四、根据元素周期表的递变规律进行判断
例2已知氧化性:KMnO4>HNO3,NaBiO3的水溶液为无色溶液,Bi的价态为+3时会比较稳定,它位于元素周期表的第VA.现在取一定量的Mn(NO3)2溶液来进行一些实验操作:①向Mn(NO3)2溶液中加入适量的NaBiO3溶液,可以观察到溶液由无色变为紫红色;②继续往溶液中添加适量的H2O2,又可以观察到溶液的紫红色褪去,并且伴有气泡的产生,那幺,这3种氧化剂的氧化性强弱排序为( ).
A.KMnO4、H2O2、NaBiO3B.NaBiO3、KMnO4、H2O2
C.H2O2、KMnO4、H2O2D.NaBiO3、H2O2、KMnO4
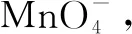


由元素周期表可知:对应的阳离子氧化性逐渐增强,阳离子的还原性也在逐渐减弱.



