吴 烨,许 柯,徐幸莲*,牛 蕾
(南京农业大学 教育部肉品加工与质量控制重点实验室,江苏 南京 210095)
低场核磁共振研究pH值对兔肌球蛋白热凝胶特性的影响
吴 烨,许 柯,徐幸莲*,牛 蕾
(南京农业大学 教育部肉品加工与质量控制重点实验室,江苏 南京 210095)
研究pH值对兔骨骼肌肌球蛋白热诱导凝胶保水性以及水分移动性的影响。运用低场核磁共振测定肌球蛋白凝胶中水的T2弛豫时间,同时测量保水性和硬度并观察凝胶超微结构。核磁共振结果拟合后发现,对应不可移动水和自由水的T22和T23弛豫时间随着pH值升高而降低,说明水分的移动性随着肌球蛋白所带负电荷数目增加而减弱;主成分分析结果发现,T22和T23弛豫时间与保水性、硬度和凝胶孔径有较强的相关性;位于等电点附近的样品在样品评分图上与其他样品有显着不同。肌球蛋白的蛋白质分子表面电荷数量和分布影响了蛋白质分子卷曲和伸展的情况,对最终凝胶保水性、硬度和网孔直径有很大影响,而T2弛豫时间则能很好的反映这种变化趋势。
肌球蛋白;凝胶;低场核磁共振;p H值;保水性
肌球蛋白约占肌原纤维蛋白质量的50%,是具有重要生物学功能的盐溶性蛋白质。其热诱导凝胶机制与肉制品的多汁性和质地有着密不可分的联系[1]。热诱导凝胶的过程是一个复杂的物理化学变化过程,其最终结果是形成了稳定的三维网络状结构,使得水分和其他食品成分填充于其中,并使产品保持固定形状。这个复杂的物理化学变化过程受pH值、离子强度、温度和时间等诸多因素影响[2],从而改变凝胶特性,特别是保水性和微观结构。为了得到最适合的加工参数和条件,需要对不同加工参数下的凝胶性质进行比较。
大量研究证明,pH值对肌球蛋白结构特征和凝胶特性,特别是保水性有较大影响。肌球蛋白的等电点为5.3左右,而典型的肉类制品pH值一般为5.5以上,所以肉类加工中肌球蛋白通常带负电荷[3]。pH值影响肌球蛋白凝胶保水性的机理是通过改变肌球蛋白表面静电荷的数量和分布,从而对肌球蛋白分子内的折叠状态和分子间的相互作用产生影响,最终影响热诱导形成的三维网络结构[4]。
保水性(water holding capacity,WHC)作为肉制品的主要品质特性,前人对其做了大量研究[5]。Grau等[6]利用滤纸吸水的方法来测定肉的保水性;Honikel[7]则通过离心去除水分来测定WHC。但是由于这些方法耗时长、重复性差且需要破坏样品本身,并不能充分说明肉制品的WHC。具有非零自旋量子数(I≠0)的任何核子放置到磁场中,都能够以电磁波的形式吸收或释放能量,发生原子核的跃迁,同时产生核磁共振信号,这种核对射频区电磁波的吸收称为核磁共振(nuclear magnetic resonance,NMR)。NMR根据频率可以分为解释化学位移的核磁共振波谱仪(又称高场核磁共振)和探测物理性质的核磁共振分析仪(又称低场核磁共振)。低场核磁共振(low field-NMR)作为一种快速无损的检测技术,可以观察水分中H质子的流动和分布,得到水的动态变化情况,进而得出肉制品WHC的相关信息[8-9]。H质子的弛豫时间往往和水分子的流动性有着紧密的联系,这种弛豫包括纵向弛豫过程和横向弛豫过程,为别称为自旋-晶格弛豫和自旋-自旋弛豫,又称T1弛豫和T2弛豫。各个系统内水分含量和分布不同,都会造成T1和T2弛豫时间的快慢变化。T2弛豫时间比T1弛豫时间对水分分布状态更加敏感,所以常常用来与肉制品的WHC进行关联[10]。通过分析T2弛豫时间的不同,较容易区分出易流动损失的水分和通过物理、化学作用紧密结合的水分[11]。
Bertram等[12]通过研究肌原纤维蛋白在不同pH值、离子强度和温度等加工参数作用下T2弛豫时间分布的差异,来描述蛋白质凝胶WHC的变化情况。本研究希望通过类似的方法,即通过低场核磁共振测定弛豫时间T2,观察在不同pH值下兔骨骼肌肌球蛋白热诱导凝胶的水分分布状态变化,与凝胶特性如硬度和微观结构等建立一定的相关性联系。
1 材料与方法
1.1 材料、试剂与仪器
3月龄的雄性新西兰白兔(1.5~2.0kg)购于江苏省农业科学院种兔场。
乙二醇二乙醚二胺四乙酸(EGTA) 美国Sigma公司;Triton X-100 美国Amersco公司;其他化学试剂最低为分析纯。
Waring高速组织捣碎机 美国思伯明设备有限公司;Avanti J-E高速冷冻离心机 美国贝克曼有限公司;TA-XT2i质构仪 英国Stable Micro System公司;MicroMR微型核磁共振成像仪 上海纽迈电子有限公司;S3000-N扫描电子显微镜 日本日立公司;UV-2450紫外分光光度计 日本岛津公司。
1.2 方法
1.2.1 肌球蛋白的制备
健康的新西兰雄性白兔,宰前充分休息,提供饮水,减少应激。头部机械致昏后,切断颈部血管放血,迅速剥皮去头、爪及内脏,自来水冲洗去除血迹,沥干淋水放入冰箱0~4℃约0.5h,剔取腰大肌。肌球蛋白提取方法参照Han[13]和Wang[14]等。纯化得到的肌球蛋白,用双缩脲法[15]测定其浓度,以牛血清蛋白作标准曲线,计算蛋白质浓度。肌球蛋白溶解在溶液(0.6mol/L KCl、20mmol/L K2HPO4-KH2PO4、pH6.5)中,贮存于0~4℃,于一周内使用。
1.2.2 肌球蛋白凝胶的制备
肌球蛋白溶液质量浓度稀释到10mg/mL,调pH值为5.5、6.0、6.5、7.0、7.5。置于水浴锅中从20℃程序升温(1℃/min)到中心温度为70℃保温20min。凝胶在0~4℃下过夜(12h)。所得的凝胶进行保水性、质构特性测试和扫描电子显微镜观察。
1.2.3 保水性测试
保水性(WHC)通过Kocher等[16]的离心法测量,肌球蛋白凝胶在0~4℃下用10000×g离心10min,记录离心前后离心管的质量,离心出液体的质量。每个处理3个重复。WHC用下面的公式进行计算:

式中:m1为离心过程中水分损失质量/g;m2为离心前凝胶的质量/g。
1.2.4 质构特性测试
利用质构仪的texture profile analysis(TPA)测定凝胶硬度,单位为g。质构分析参数设定:探头P5(直径5mm不锈钢圆柱形探头),测试前下降速度2.0mm/s,测试速度1.0mm/s,测试后探头上升速度1.0mm/s,穿刺测试距离5mm,感应力3g,用质构仪自带的软件Texture Expert English 1.22中的TPAFRAC.MAC过程进行分析,计算凝胶的硬度。每个处理3个重复。
1.2.5 扫描电子显微镜
凝胶样品切成均匀小块,用体积分数2.5%的戊二醛固定2h,然后经过体积分数50%、70%、80%、90%的乙醇溶液梯度脱水各15min,100%的乙醇脱水3次,每次30min。样品用叔丁醇置换3次,每次3min,取出后进行冷冻干燥并将其粘到样品台上,用离子溅射仪给样品镀上10nm的金膜。通过扫描电子显微镜观察,加速电压为15kV,每个样品观察8个区域。利用工具对凝胶孔径直径Image-Pro Plus (5.1.0.20)进行定量统计,每个样品统计3张图片,每张图片统计10个不同孔径。
1.2.6 NMR自旋-自旋弛豫时间(T2)测量
NMR弛豫测量在纽迈MicroMR微型核磁共振成像仪上进行。测试条件为:质子共振频率为22.6MHz,测量温度为32℃。大约2g样品放入直径15mm核磁管,而后放入分析仪中。自旋-自旋弛豫时间T2用Carr-Purcell-Mebiboom-Gill(CPMG)序列进行测量。所使用参数为:τ-值(90°脉冲和180°脉冲之间的时间)为300μs。重复扫描32次,重复间隔时间为6500ms得到16000个回波,得到的图为指数衰减图形,每个测试3个重复。NMR弛豫测量得到的图为指数衰减曲线,其数学模型为[17]:
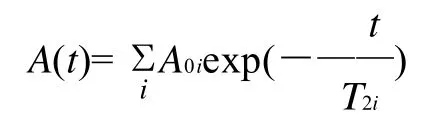
式中:A(t)为衰减到时间t时的幅值大小;t为衰减时间;A0i为第i个组分平衡时的幅值大小;T2i为第i个组分的自旋-自旋弛豫时间。
CMPG指数衰减曲线用仪器自带的MultiExp Inv Analysis 软件进行反演,得到T2值。该软件使用整体迭代修正的NMR弛豫信号多指数反演算法,结果为离散型与连续型相结合的T2谱,它在信噪比较低的情况下仍能保持弛豫谱的真实性。反演的结果为生成弛豫图和各个弛豫过程的弛豫幅值、其对应时间常数(峰值)及其所占面积分数、每个峰起始时间和结束时间等。为了分析的方便,采用弛豫图每个组分峰值对应的时间作为T2,而弛豫峰的宽度为基线上峰底的宽度。
1.3 统计分析
用SAS 8.01 (Statistics Analysis System,SAS)进行方差分析,如果方差分析效应显着,使用Duncan multiple range test进行多重比较(P<0.05)。用Statistica 8.0对WHC、硬度、凝胶孔径和NMR T2反演结果进行主成分分析(principal component analysis,PCA),从而在尽可能多的保留原始数据信息的前提下对原始数据进行降维处理。
2 结果与分析
2.1 保水性和硬度的变化
在肉以及肉制品生产加工中,蛋白质结合水的能力决定了保水性,保水性对肉的嫩度、多汁性和颜色都有较大影响,是客观评价肉以及肉制品的重要指标。肌球蛋白在热诱导凝胶过程中发生变性聚集,交联成三维网状结构,并把水分包含在其中。不同pH值下肌球蛋白加热凝胶后,保水性和硬度发生了比较明显的差异。
由图1可以看出,pH5.5时,肌球蛋白保水性较差((34.92±3.19)%),与其他pH值有显着差异(P<0.05)。随着pH值升高,保水性显着增加(P<0.05),pH6.5、7.0、7.5的保水性分别为(68.17±3.76)%、(67.37±5.72)%、(66.52±4.68)%,三者之间无显着差异(P>0.05),说明当pH值达到6.5以后,保水性趋于稳定。结果发现,靠近等电点附近的肌球蛋白凝胶保水性明显要比远离等电点的凝胶差,这与猪肉肌原纤维蛋白WHC和pH值的关系类似[18]。Liu等[19]的研究结果发现肌球蛋白凝胶在pH5.5时WHC为31.2%,最大WHC出现在pH7.0~9.0。pH值对肌球蛋白表面净电荷数量的影响决定了水分在蛋白质网络结构中的分布与含量。pH5.5时肌球蛋白分子所带电荷较少,蛋白质在天然状态下就发生了自然聚集,加热形成凝胶发生明显缩水,导致保水性较差。随着pH值的升高,肌球蛋白表面所带负电荷增加,蛋白分子之间静电排斥作用增强,为水分提供了更多的结合位点,同时增加了水化表面积。
不同pH值下的肌球蛋白凝胶硬度见图1。蛋白凝胶硬度反映了肉以及肉制品的感官特性如嫩度等。凝胶硬度与形成的三维网络结构致密度有密切关系。肌球蛋白凝胶在pH5.5时硬度明显小于其他组(P<0.05)。随着pH值逐渐增大,在pH6.5出现了最大硬度值(28.34±3.36)g,且与pH6.0的硬度值(25.56±3.56)g有显着差异(P<0.05),与pH7.0和7.5的值((26.32±3.10)g和(25.70±4.89)g)无显着差异(P>0.05)。对牛血清白蛋白(BSA)和大豆蛋白凝胶性质实验发现,蛋白质凝胶强度与蛋白质变性程度在给定条件下的展开程度有关,变性程度越高、功能基团暴露越大,凝胶强度越大[20]。pH值在接近等电点时,蛋白质分子上正负电荷数目接近,发生相互吸引,使得蛋白质分子发生无规则的卷曲和分子团聚,使得各种功能基团都被包埋在蛋白质分子内部,无法充分暴露;在pH值高于等电点时,蛋白质分子上所带负电荷数目多,静电斥力使其分子结构舒展伸张,充分暴露了巯基、疏水基团和其他共价键基团,使得热凝胶过程可能发生的交联更多,凝胶强度更大,结果测得凝胶硬度也较大。
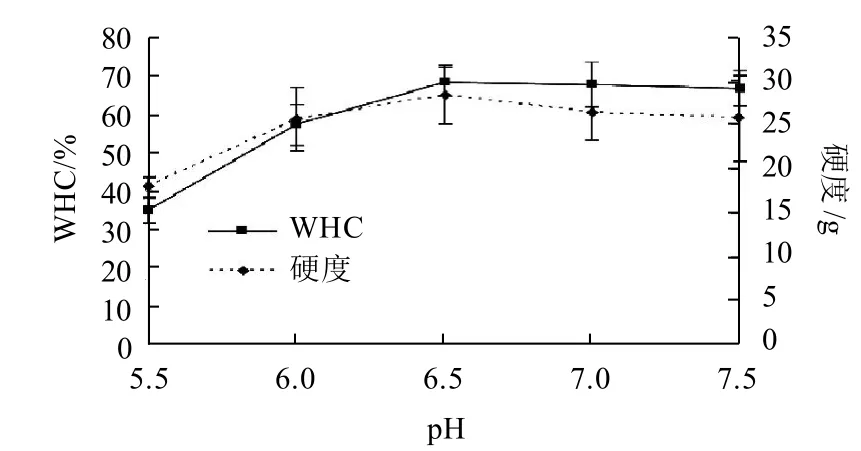
图1 pH值对肌球蛋白凝胶保水性和硬度的影响Fig.1 Effect of pH on WHC and hardness of myosin gel
2.2 扫描电镜微观结构观察
图2为不同pH值下肌球蛋白凝胶扫描电子显微镜观察结果。图2A为处于等电点附近的蛋白质,其凝胶网孔较大且网络状蛋白质丝发生明显的断裂,有明显未参与凝胶的肌球蛋白形成了团块状的蛋白聚集体。图2B中pH6.0的凝胶网络结构较pH5.5明显致密,几乎不存在团块状的蛋白聚集体,但还是有部分网孔结构出现断裂。pH6.5和7.0的凝胶其微观结构较好(图2C、图2D),网孔较小且分布均匀,出现了层叠的网孔结构,无明显断裂和团块状蛋白聚集体。图2E中pH7.5的蛋白质其凝胶微观结构稍比pH6.5和7.0差,出现了较小的团块状蛋白聚集体。

图2 pH值对肌球蛋白凝胶微观结构的影响Fig.2 Effect of pH on microstructure of myosin gel
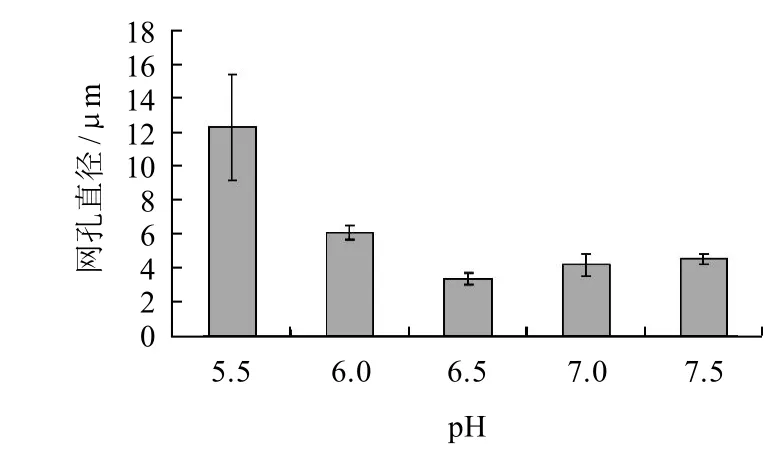
图3 pH值对肌球蛋白凝胶微观结构网孔直径的影响Fig.3 Effect of pH on mesh diameter in microstructure of myosin gel
图3为肌球蛋白凝胶网孔直径随着pH值变化而变化的情况。凝胶网孔直径在pH5.5的时候为(12.27±3.10)μm,明显要大于其他各组,这与之前的保水性结果相互印证。网络孔径大,其水分流动就较容易,同时蛋白质与水分子的相对接触面积就较小,导致水化表面积较小,而较为松散的网络结构和断裂的网孔蛋白质丝都是造成硬度较差的原因之一。pH6.5的蛋白质凝胶网孔直径最小,其对应的保水性和硬度值也是最高的,说明在该pH值下形成了良好结构的凝胶,而且还印证了肌球蛋白凝胶孔径大小与保水性和质构特性之间的关系。pH6.5、7.0、7.5的孔径大小分别为(3.33±0.34)、(4.15±0.64)、(4.52±0.32)μm,它们之间无显着差异(P>0.05),说明随着pH值逐渐远离等电点,肌球蛋白分子表面所带电荷数量接近饱和,形成的凝胶结构趋于稳定,不随pH值发生明显变化,保水性和硬度的变化也证实了这种观点。
2.3 低场NMR T2弛豫时间的变化
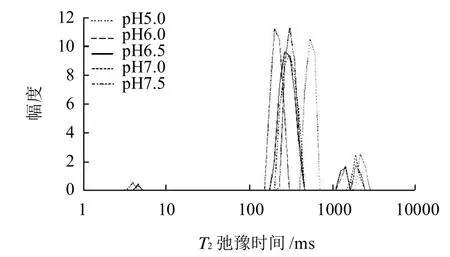
图4 pH值对肌球蛋白凝胶横向弛豫时间(T2)的影响Fig.4 Effect of pH on transverse relaxation times (T2) of myosin gel
从图4可以看出,对CPMG脉冲序列得到的衰减曲线进行多指数拟合后,发现T2在1~10000ms的弛豫时间分布上出现了3个峰,这与用NMR测量乳清蛋白与卵白蛋白中得到的结果相类似[21]。分别对这3个峰进行统计得出图5和图6。图5为pH值对肌球蛋白凝胶T2弛豫时间的影响,图6为pH值对各个T2组分峰面积百分数的影响。
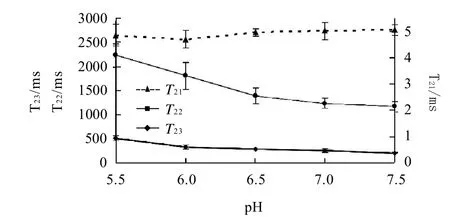
图5 pH值对肌球蛋白凝胶T21、T22和T23弛豫时间的影响Fig.5 Effect of pH on T21、T22 and T23 relaxation time of myosin gel
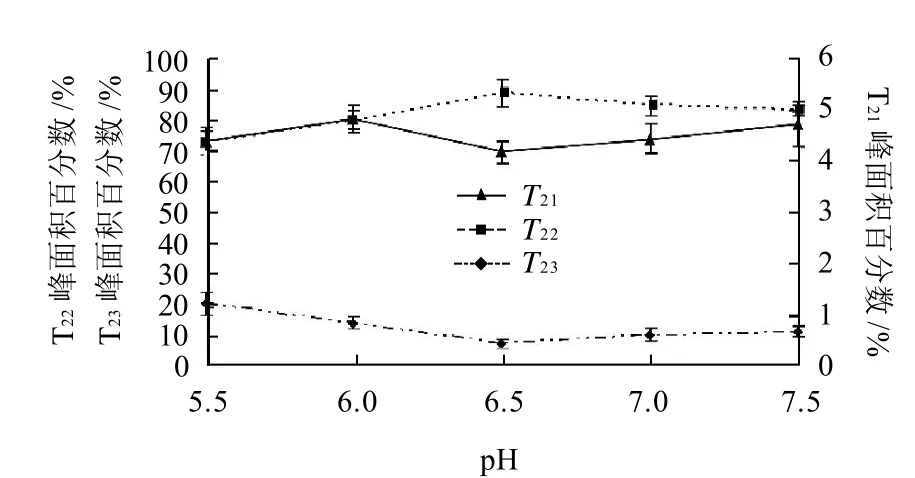
图6 pH值对肌球蛋白凝胶T21、T22和T23峰面积百分数的影响Fig.6 Effect of pH on peak areas of T21、T22 and T23 of myosin gel
从图5分析得出,这3个峰对应时间为T21:1.15~8.11ms;T22:132.19~705.48ms;T23:1072.27~3274.55ms。这3个峰可能分别对应于结合水(T21)、不易移动水(T22)和自由水(T23)[13]。图6的结果表明,在肌球蛋白凝胶中,结合水比例很小,低于5%;自由水约占10%~20%;不易移动水占绝大多数,比例超过了7 0%~80%。
T21弛豫时间和所占峰面积百分数都不随pH值变化而发生显着变化(P>0.05),说明结合水在不同pH值变化过程中都稳定的存在,且不随肌球蛋白分子所带电荷变化而变化。T22在pH值变化过程中发生比较明显的变化,其趋势为随着pH值升高T22弛豫时间显着降低(P<0.05)。T22弛豫时间的降低,说明这部分水分的流动性逐渐变差,趋于一个不易流动的状态。同时由于T22弛豫时间在整个肌球蛋白凝胶水分分布中约占80%以上,而且随着pH值增加,这部分水所占百分比也在增加,这说明T22弛豫时间变缓的趋势代表了凝胶中主要比例水分变化的趋势。T23弛豫时间普遍大于1000ms,所对应的比例随pH值变化无显着变化(P>0.05),其弛豫时间变化趋势与T22类似,随着pH值升高而显着降低(P<0.05),说明这部分水的流动性也受到了限制。T22和T23弛豫时间变化的原因可能与pH值影响蛋白质分子表面电荷数量和分布有关[22]。
保水性、硬度和微观结构网孔直径的变化与蛋白凝胶T22和T23时间变化可能有一定内在联系。T22对应凝胶中的不易移动水,其对应弛豫时间变缓,可能是因为凝胶结构逐渐致密,导致了填充在凝胶孔径中的水分与蛋白接触面积更大,蛋白质表面基团与水分子相互作用导致了水分移动性下降。T23对应凝胶中的自由水,自由水移动性下降的原因可能是因为凝胶孔径变小,水分在凝胶网络中自由流动的空间减少。Bertram等[23]通过研究得出猪肉WHC和T2弛豫时间分布的关系,也得出了两者有较强的相关性。
图6结果表明,随着pH值升高,T21峰面积百分数基本保持不变,T23峰面积百分数逐渐变小,而T22峰面积百分数逐渐变大。这说明了随着蛋白质表面电荷数增多和形成凝胶网络结构致密度增加,一部分自由水转变为不易移动水。这种水分状态转化说了水分的流动性逐渐降低,与随着pH值升高保水性逐渐增加的趋势相一致。
2.4 保水性、硬度、网孔直径和T2弛豫时间的主成分分析
pH值影响下保水性、硬度、网孔直径和T2弛豫时间各参数之间可能存在线性相关性,因此在尽量多的保留原始信息情况下,对原始数据进行主成分分析。
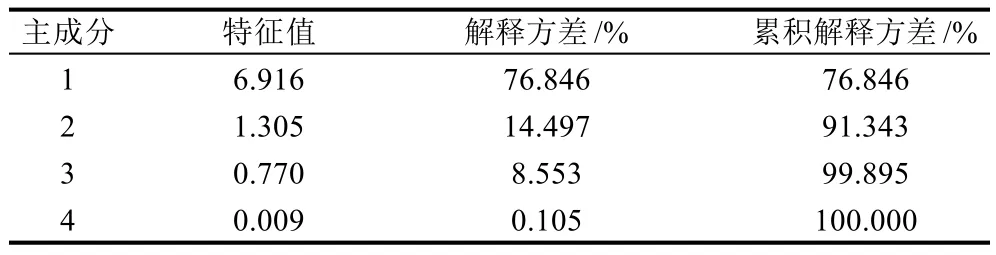
表1 pH值影响下变量的主成分分析Table 1 Principal component analysis of variables at various pH levels
表1显示了不同p H值处理样品前3个主成分(principal component,PC)对总体方差的解释情况,第一个主成分能解释总体方差变异的76.846%,说明了原始数据之间存在着较强相关性。前两主成分对总方差的累计贡献达到91.343%,基本可解释原有所有指标包含的全部信息,且特征值都大于1,所以选取第1和第2个主成分作为评价pH值变化过程中保水性、硬度、网孔直径和T2弛豫时间各参数的综合指标。表2为第1和第2个主成分中各变量的特征向量,其绝对值表示了各个变量对主成分的贡献大小。
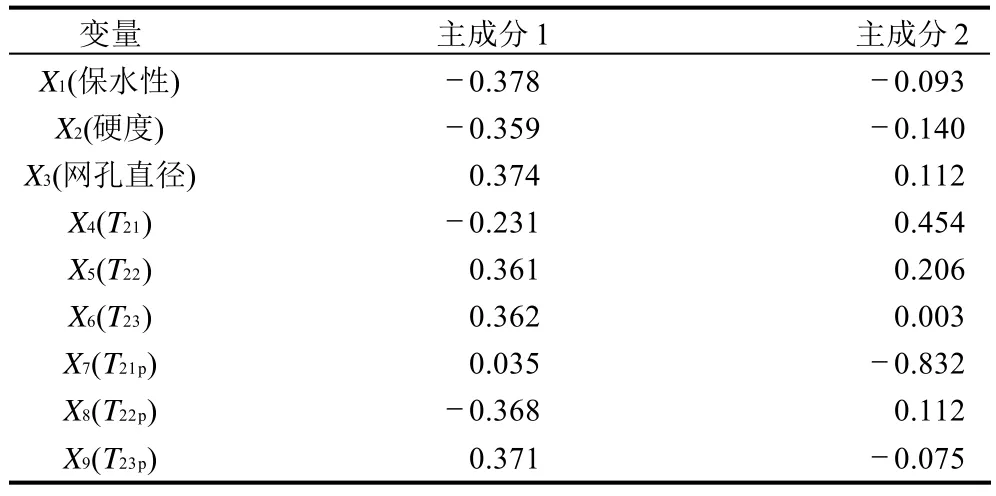
表2 主成分1和主成分2的特征向量Table 2 Characteristic eigenvectors of principal component 1 and 2
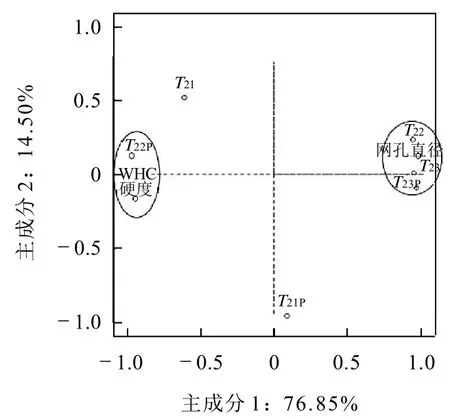
图7 不同pH值处理变量在第1、2主成分评分图Fig.7 Scores of principal components 1,2 after variables treated at various pH conditions
从表2可以分析得到,第1个主成分其特征向量中X1、X2、X3、X5、X6、X8和 X9的系数绝对值相差不大,说明了第一个主成分综合了pH值变化过程中保水性、硬度、网孔直径和T22与T23弛豫时间参数的主要变化。第2个主成分的解释方差为14.50%,其特征向量中X4和X7的系数绝对值最大,其他系相对较低,说明这两者对第2主成分贡献较大。
图7为不同pH值处理变量在第1、2主成分平面的得分散点图。第1主成分主要与T22、T23、T23p和网孔直径显正相关,与保水性、硬度和T22p显负相关。第2主成分主要与T21显正相关,与T21p显负相关。图8为不同pH值处理样品在第1、2主成分评分。
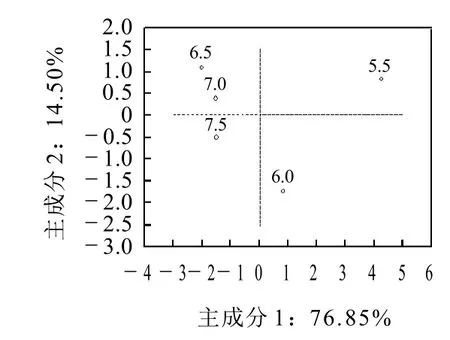
图8 不同pH值处理样品在第1、第2主成分评分Fig.8 Scores of principal components 1,2 after samples treated at various pH conditions
由图8分析得出,接近等电点的样品(pH5.5)位于第一象限,其特征为低保水性、低硬度、较长的T2弛豫时间和网孔直径大。远离等电点样品(pH6.5、7.0、7.5)集中在第二、三象限,相互接近,共同特征为高保水性、高硬度、较短的T2弛豫时间和网孔直径小。接近和远离等电点的样品分别的位于第1主成分的左右两端,说明了这种差异主要是保水性、硬度、网孔直径和T22、T23弛豫时间的不同造成的。
3 结 论
pH值的变化引起兔骨骼肌肌球蛋白的凝胶特性和微观结构特征都发生显着变化。随着pH值逐渐远离等电点,保水性、硬度和T22峰面积百分数等都增加;网孔直径、T22弛豫时间、T23弛豫时间和T22峰面积百分数逐渐降低;主成分分析得出低场核磁共振T2弛豫时间与肌球蛋白凝胶保水性等凝胶特性有很强的相关性,同时也能解释微观结构变化;肌球蛋白蛋白分子表面电荷数量和分布影响了蛋白分子卷曲和伸展的情况,对最终凝胶保水性、硬度和网孔直径有很大影响。目前研究发现,虽然T2与保水性等存在较强的相关性,但多种因素对T2弛豫时间的影响并不都是线性的,还没得出很好的回归方程来定量分析两者之间的关系,因此,需要深入的研究。
[1] SIEGLE D G, CHURCH K E, SCHMIDT G R. Gel structure of nonmeat proteins as related to their ability to bind meat pieces[J]. Journal of Food Science, 1979, 44(5): 1276-1279.
[2] 李继红, 彭增起. 温度、盐浓度和pH对盐溶蛋白热诱导凝胶影响的研究[J]. 肉类工业, 2004(4): 39-41.
[3] DAMODARAN S P A. Food protein and their application[M]. New York: Marcel Dekker Inc, 1997.
[4] 曾宪明, 徐幸莲, 白云, 等. 兔肌球蛋白热诱导凝胶过程中的物理化学变化[J]. 食品科学, 2008, 29(4): 149-153.
[5] XIONG Youling. Role of myofibrillar proteins in water-binding in brineenhanced meats[J]. Food Research International, 2005, 38(3): 281-287.
[6] GRAU R, HAMM R, BAUMANN A. Water-binding capacity of dead mammal muscle. I. Effect of pH value on water-binding capacity of crushed cattle muscle[J]. Biochemische Zeitschrift, 1953, 325(1): 1-11.
[7] HONIKEL K O. Reference methods for the assessment of physical characteristics of meat[J]. Meat Science, 1998, 49(4): 447-457.
[8] BERTRAM H C, ANDERSEN H J. NMR and the water-holding issue of pork[J]. Journal of Animal Breeding and Genetics, 2007, 124(Suppl1):35-42.
[9] BERTRAM H C, KOHLER A, BOCKER U, et al. Heat-Induced changes in myofibrillar protein structures and myowater of two pork qualities. A combined FT-IR spectroscopy and low-field NMR relaxometry study[J].Journal of Agricultural and Food Chemistry, 2006, 54(5): 1740-1746.
[10] TROUT G R. Techniques for measuring water-binding capacity in muscle foods: a review of methodology[J]. Meat Science, 1988, 23(4): 235-252.
[11] HINRICHS R, GOTZ J, NOLL M, et al. Characterisation of the waterholding capacity of fresh cheese samples by means of low resolution nuclear magnetic resonance[J]. Food Research International, 2004, 37(7): 667-676.
[12] BERTRAM H C, KRISTENSEN M, ANDERSEN H J. Functionality of myofibrillar proteins as affected by pH, ionic strength and heat treatment:a low-field NMR study[J]. Meat Science, 2004, 68(2): 249-256.
[13] HAN Minyi, ZHANG Yingjun, FEI Ying, et al. Effect of microbial transglutaminase on NMR relaxometry and microstructure of pork myofibrillar protein gel[J]. European Food Research and Technology, 2009,228(4): 665-670.
[14] WANG Shufang, SMITH D M. Heat-induced denaturation and rheological properties of chicken breast myosin and factin in the presence and absence of pyrophosphate[J]. Journal of Agricultural and Food Chemistry,1994, 42(12): 2665-2670.
[15] GORNALL A G, BARDAWILL C J, DAVID M M. Determination of serum proteins by means of the biuret reaction[J]. Journal of Biological Chemistry, 1949, 177(2): 751-766.
[16] KOCHER P N, FOEGEDING E A. Microcentrifuge-based method for measuring water-holding of protein gels[J]. Journal of Food Science,1993, 58(5): 1040-1046.
[17] 王忠东, 肖立志, 刘堂宴. 核磁共振弛豫信号多指数反演新方法及其应用[J]. 中国科学(G辑), 2003, 33(4): 323-332.
[18] 韩敏义, 费英, 徐幸莲, 等. 低场NMR研究pH对肌原纤维蛋白热诱导凝胶的影响[J]. 中国农业科学, 2009, 42(6): 2098-2104.
[19] LIU Ru, ZHAO Siming, XIONG Shanbai, et al. Role of secondary structures in the gelation of porcine myosin at different pH values[J].Meat Science, 2008, 80(3): 632-639 .[20] WANG Chenghsin, DAMODARA N S. Thermal gelation of globular proteins: influence of protein conformation on gel strength[J]. Journal of Agricultural and Food Chemistry, 1991, 39(3): 433-438.
[22] BERTRAM H C, WHITTAKER A K, ANDERSEN H J, et al. pH dependence of the progression in NMR T2relaxation times in postmortem muscle[J]. Journal of Agricultural and Food Chemistry, 2003,51(14): 4072-4078.
[23] BERTRAM H C, ENGELSEN S B, BUSK H, et al. Water properties during cooking of pork studied by low-field NMR relaxation: effects of curing and the RN-gene[J]. Meat Science, 2004, 66(2): 437-446.
Effect of pH on Gelation Properties of Rabbit Myosin
WU Ye,XU Ke,XU Xing-lian*,NIU Lei
(Key Laboratory of Meat Processing and Quality Control, Ministry of Education,Nanjing Agricultural University, Nanjing 210095, China)
In order to investigate the effect of pH on water-holding capacity and water mobility of heat-induced gelation from rabbit myosin, gelation properties of rabbit myosin were characterized through determining relaxation time (T2) of water using low-field nuclear magnetic resonance (NMR), and water-holding capacity (WHC), hardness and ultra microstructure of the gel.NMR results indicated that relaxation time for immobile water (T22) and relaxation time for free water (T23) exhibited a decrease as the increase of pH, which suggested that the slow water mobility resulted from the increased number of negative charge in myosin. Principal component analysis results revealed that T22 and T23 relaxation time had strong correlation with WHC, hardness and diameter of the gel. A significant difference was observed between samples near pI points and other samples. Moreover, the number and distribution of surface charge exhibited an effect on curling and stretching of myosin molecules, and finally affected WHC, hardness and mesh diameter of the gel, while T2 relaxation time could reflect this tendency well.
myosin;gel;low-field NMR;pH value;water-holding capacity
TS201.21
A
1002-6630(2010)09-0006-06
2009-10-28
国家自然科学基金项目(30771526)
吴烨(1986—),男,硕士研究生,研究方向为肉品质量控制。E-mail:njwy418@126.com
徐幸莲(1962—),女,教授,博士,研究方向为畜产品加工与质量控制。E-mail:xlxu@njau.edu.cn



