陆晓峰,李曙光
结直肠癌化疗对肾上腺皮质功能影响的研究
陆晓峰,李曙光
目的 探讨结直肠癌化疗对肾上腺皮质功能的影响。方法 选取结直肠癌患者27例,检测化疗前后血清皮质醇、醛固酮水平,对比检测结果。结果 化疗后血清皮质醇、醛固酮水平较化疗前均显著降低,差异有统计学意义 (P<0.05)。Folfox4方案化疗组与mFolfox6化疗方案组皮质醇与醛固酮差值比较,差异均无统计学意义 (P>0.05)。男性与女性皮质醇与醛固酮差值比较,差异均无统计学意义 (P>0.05)。结论 化疗使结直肠癌患者血清皮质醇、醛固酮水平下降,能抑制肾上腺皮质功能。
结直肠肿瘤;抗肿瘤联合化疗方案;皮质醇;醛固酮
化疗药物尤其是联合化疗可引起患者恶心呕吐等消化道不良反应,有研究表明,含顺铂的化疗方案能使卵巢癌、非小细胞肺癌患者血清皮质醇水平下降[1],尿皮质醇水平可作为预测呕吐的指标[2]。但这些研究所选择的研究对象为多种肿瘤患者,化疗方案也不统一,这些在一定程度上影响了其所得结论的可靠性。Folfox系列化疗方案是结直肠癌术后辅助化疗常用的一线方案,本研究以术后辅助化疗的结直肠癌患者为对象,比较化疗前后血清皮质醇、醛固酮的水平,探讨结直肠癌化疗对肾上腺皮质功能的影响,并进一步研究不同化疗方案、不同性别对肾上腺皮质功能影响的差异,现报道如下。
1 资料与方法
1.1 临床资料 连续收集2009年5月—2010年11月我科收治的结直肠癌术后辅助化疗患者27例,其中男16例,女11例;年龄51~66岁,中位年龄62岁。均经病理证实为结直肠癌,体力状况 (KPS)评分≥70分,均无重要器官功能严重损害,不存在肾上腺皮质相关疾病;治疗过程中均未采用皮质激素治疗。
27例患者随机分为Folfox4方案化疗组和改良Folfox6(mFolfox6)方案化疗组。Folfox4组12例,其中男6例,女6例;年龄51~66岁,中位年龄60岁;KPS评分80~100分;TNM分期为Ⅱ期6例,Ⅲ期6例。mFolfox6组15例,其中男10例,女5例;年龄53~66岁,中位年龄62岁;KPS评分70~100分;TNM分期为Ⅱ期11例,Ⅲ期4例。两组患者一般资料间具有均衡性。
1.2 化疗方案 化疗药物:奥沙利铂 (江苏恒瑞医药股份有限公司,规格50 mg,批号:09040211),甲酰四氢叶酸钙(江苏恒瑞医药股份有限公司,规格10 ml/0.1 g,批号:09030932),氟尿嘧啶 (天津金耀氨基酸有限公司,规格10 ml/0.25 g,批 号:0905131)。Folfox4方 案:奥 沙 利 铂85 mg/m2静脉滴注2 h,第1天;氟尿嘧啶400 mg/m2静脉推注,第1、2天;甲酰四氢叶酸钙200 mg/m2静脉滴注2 h,第1、2天;氟尿嘧啶600 mg/m2微泵22 h维持,第1、2天。
mFolfox6方案:奥沙利铂85 mg/m2静脉滴注2 h,第1天;氟尿嘧啶400 mg/m2静脉推注,第1天;甲酰四氢叶酸钙400 mg/m2静脉滴注2 h,第1天;氟尿嘧啶2 400 mg/m2微泵46 h维持。
1.3 皮质醇、醛固酮检测方法 分别于化疗前和结束后第1天,早晨6:00~8:00安静状态下,抽取5 ml外周血标本进行皮质醇、醛固酮测定。采用放疫法检测化疗前后皮质醇、醛固酮水平,碘[125I]皮质醇放射免疫分析药盒、碘[125I]醛固酮放射免疫分析药盒购自天津九鼎医学生物工程有限公司。
1.4 统计学方法 采用SPSS 15.0统计软件包进行统计学分析,计量资料采用(±s)表示,采用t检验,以P<0.05为有差异有统计学意义。
2 结果
2.1 化疗前后皮质醇、醛固酮水平比较 化疗后血清皮质醇、醛固酮水平较化疗前均显著降低,差异有统计学意义 (P<0.05,见表1)。
2.2 不同化疗方案治疗前后皮质醇、醛固酮差值比较 Folfox4方案化疗组与mFolfox6化疗方案组皮质醇与醛固酮差值比较,差异均无统计学意义 (P>0.05,见表2)。
2.3 不同性别治疗前后皮质醇、醛固酮差值比较 男性与女性皮质醇差值及醛固酮差值比较,差异均无统计学意义 (P>0.05,见表3)。
表1 化疗前后皮质醇、醛固酮水平比较(±s,ng/L)Table 1 Comparison respectively for cortisol and aldosteronebe in prechemotherapy and post-chemotherapy

表1 化疗前后皮质醇、醛固酮水平比较(±s,ng/L)Table 1 Comparison respectively for cortisol and aldosteronebe in prechemotherapy and post-chemotherapy
皮质醇 醛固酮化疗前12.49±0.43 131.91±3.24化疗后 10.12±0.36 96.87±2.23 t 10.026 20.425 P值值0.000 0.000
表2 不同化疗方案治疗前后皮质醇、醛固酮差值比较(±s,ng/L)Table 2 Comparison respectively for cortisol and aldosteronebe in different chemotherapy protocols
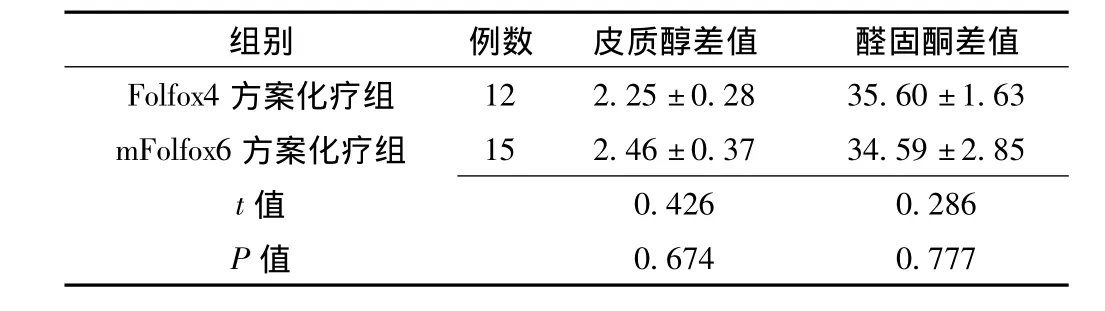
表2 不同化疗方案治疗前后皮质醇、醛固酮差值比较(±s,ng/L)Table 2 Comparison respectively for cortisol and aldosteronebe in different chemotherapy protocols
12 2.25±0.28 35.60±1.63 mFolfox6方案化疗组 15 2.46±0.37 34.59±2.85 t组别 例数 皮质醇差值 醛固酮差值Folfox4方案化疗组0.426 0.286 P值值0.674 0.777
表3 不同性别治疗前后皮质醇、醛固酮差值比较(±s,ng/L)Table 3 Comparison respectively for cortisol and aldosteronebe in different sex
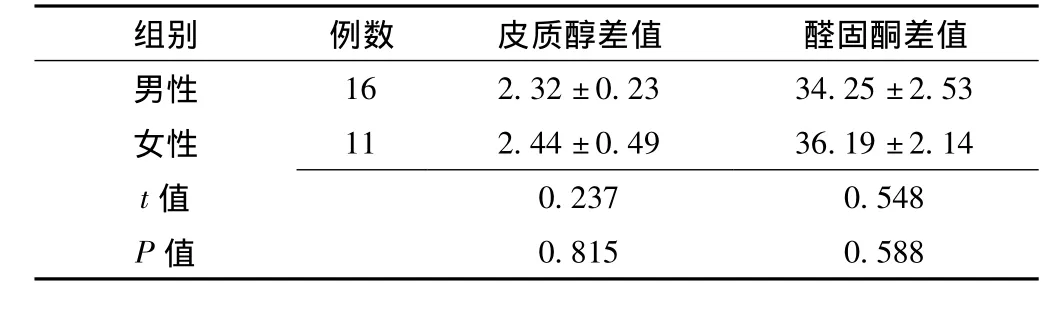
表3 不同性别治疗前后皮质醇、醛固酮差值比较(±s,ng/L)Table 3 Comparison respectively for cortisol and aldosteronebe in different sex
组别 例数 皮质醇差值 醛固酮差值男性16 2.32±0.23 34.25±2.53女性 11 2.44±0.49 36.19±2.14 t 0.237 0.548 P值值0.815 0.588
3 讨论
在正常情况下,肾上腺皮质每天都分泌一定的糖皮质激素(皮质醇)和盐皮质激素 (醛固酮),对维持机体的正常代谢起着重要作用,当肾上腺皮质功能低下时,患者出现色素沉着,早期可出现食欲减退,较重时有恶心、呕吐、腹胀、腹泻、体质量减轻等临床表现[3]。在肿瘤化疗期间,患者常出现上述症状和体征,很可能其中的部分症状和体征与化疗导致的肾上腺皮质分泌功能受抑有关。既往关于化疗对肾上腺皮质功能影响的研究包括的研究对象有多种肿瘤情况,化疗方案也不尽相同,有一些研究设计不合理,混杂因素较多,所得出的结论可靠性受到一定影响。本研究对象仅限于术后辅助化疗的结直肠癌患者,采用的化疗方案相对固定,所得的结论也较为可靠。
本研究结果显示,化疗后的血清皮质醇及醛固酮水平较化疗前显著下降,提示经过化疗后,患者肾上腺皮质功能受到抑制,这与既往的一些研究结论一致[4],证实了化疗毒副作用与肾上腺皮质功能受抑制的相关性。本研究Folfox4方案化疗组和mFolfox6方案化疗组间皮质醇差值、醛固酮差值无显著性差异,表明这两种方案在抑制肾上腺皮质功能方面没有差异。一般认为男性患者的忍耐力较女性患者强,表现出来的化疗毒副作用较女性轻[5]。既往的研究未涉及性别对化疗患者毒副作用的影响[6],本研究对这方面进行了初步探索,结果显示,男性与女性患者在接受化疗后,皮质醇和醛固酮水平下降无显著性差异,提示性别不是影响化疗相关肾上腺皮质功能抑制的因素,所以尽管男性患者在化疗后可能表现出来的毒副作用没有女性患者剧烈,但其实际上受到肾上腺皮质功能抑制影响是没有差别的。目前,皮质激素对肿瘤的作用意见不一,但它能减轻化疗的某些不良反应,尤其是消化道的毒副作用,意见基本一致,而且是比较适用的。化疗药物能显著抑制肾上腺皮质的分泌功能,减少内源性的皮质激素水平,因此加用皮质激素类药物是补其不足,从而为化疗合用皮质激素类药物的合理性提供了依据。
本研究样本量偏小,仅是对化疗相关的肾上腺皮质功能抑制做初步探索,相关的结论有待于大样本量研究进一步证实。另外,本研究对象仅限于术后辅助化疗的结直肠癌患者,化疗方案仅限于结直肠癌化疗的常用的Folfox4和mFolfox6方案,未包括其他肿瘤及其他化疗方案,因此,在推广应用相关结论时受到一定限制。在以后的工作中,可以将研究范围扩大至其他肿瘤领域,并且可以在化疗相关毒副作用 (如恶心、呕吐)的严重程度与肾上腺皮质激素水平相关性等方面开展研究工作。
1 Lissoni P,Messina G,Balestra A,et al.Efficacy of cancer chemotherapy in relation to synchronization of cortisol rhythm,immune status and psychospiritual profile in metastatic non-small cell lung cancer[J].In Vivo,2008,22(2):257-262.
2 Du Bois A,Vach W,Wechsel U,et al.5-Hydroxyindoleacetic acid(5-HIAA)and cortical excretion as predictors of chemotherapy-induced emesis[J].Br J Cancer,1996,74(7):1137-1140.
3 陈灏珠,林果.实用内科学 [M].13版.北京:人民卫生出版社,2009:1199-1200.
4 王娜.鸦胆子油注射液联合FOLFOX-4方案治疗晚期结直肠癌28例分析[J].中国误诊学杂志,2010,10(3):686.
5 付相建,杨光华.FOLFOX4方案治疗晚期大肠癌28例分析[J].中国误诊学杂志,2010,10(31):7755.
6 韩娜,王健,张中冕.FOLFOX4方案治疗晚期结肠癌67例分析[J].中国误诊学杂志,2009,9(22):5462.
The Influence of Chemotherapy on Adrenal Cortex of Colorectal Cancer Patients
LU Xiao-feng,LI Shu-guang.Jinhua Central Hospital,Jinhua 321000,China
ObjectiveTo investigate the influence of chemotherapy on adrenal cortex among colorectal cancer patients.Methods27 patients were involved into the study.Levels of serous cortisol and aldosterone were detected and compared before and after chemotherapy.ResultsThere was significant decrease in serous cortisol and aldosterone after chemotherapy(P<0.05).There was no significant decrease in serous cortisol and aldosterone between Folfox4 chemotherapy group and mFolfox6 chemotherapy group(P>0.05).There was no significant decrease in serous cortisol and aldosterone between male group and female group(P>0.05).ConclusionChemotherapy can reduce the level of serous cortisol and aldosterone in colorectal cancer patients,and can inhibit the function of adrenal cortex.
Colorectal neoplasms;Antineoplastic combined chemotherapy protocols;Cortisol;Aldosterone
R 735.3
A
1007-9572(2011)12-4131-02
321000浙江省金华市中心医院
陆晓峰,321000浙江省金华市中心医院;
E-mail:luogden99@163.com
2011-05-10;
2011-11-09)
(本文编辑:陈素芳)



