丁群力,吕 丹,王碧炯,张巧丽,虞亦鸣,邓在春
机化性肺炎可以继发于药物、放射性损伤、吸入有害气体等,也可无明确病因,后者称为隐源性机化性肺炎(cryptogenic organizing pneumonia,COP)。COP是一种炎性疾病,主要累及肺泡、肺泡管、小气道,也可能累及肺间质。糖皮质激素通常对COP有很好的疗效,但是存在治疗时间长、不良反应多、病情易复发等不利因素,近年来有报道显示小剂量大环内酯类药物单独或辅助治疗COP有明显疗效,可能成为治疗COP的一个替代治疗方案,但文献均为个案报道或病例报道,无大规模对照研究。本文报道1例我院以阿奇霉素辅助激素治疗COP患者,并回顾分析公开发表的大环内酯类药物治疗COP的国内外文献资料,评价大环内酯类药物在COP治疗中的疗效和不良反应。
1 病例简介
患者,女,58岁,因“反复咳嗽、低热、乏力9个月余,再发半个月”于2012-05-05入住我院。患者9个多月来反复出现咳嗽、咳少量白痰,并有间歇性低热,体温37.5~38.0 ℃,每次约持续半个月,曾3次在外院住院,以“头孢类、喹诺酮类、大环内酯类”治疗好转出院,偶感左上胸部隐痛,无腹痛、腹泻,无关节红肿、疼痛,无皮疹等。半个月前患者再次出现咳嗽、咳痰,偶感左上胸部隐痛,乏力明显,遂收住我院。既往有高血压10余年,近来服用硝苯地平缓释片治疗,血压控制可,无吸烟史,无粉尘、有害气体吸入史。体格检查:体温37.2 ℃,血氧饱和度(SpO2)98%,营养中等,全身皮肤、巩膜无黄染,颈部、锁骨上淋巴结未触及肿大。呼吸平稳,双肺呼吸音清,未闻及干湿性啰音。心率114次/min,律齐,各瓣膜听诊区未闻及病理性杂音。腹软,无压痛及反跳痛,肝、脾肋下未及。双下肢无水肿及皮疹。行胸部CT检查示右侧肺部多发斑片状、结节状高密度灶,胸膜增厚,见图1。实验室检查:白细胞计数8.3×109/L,中性粒细胞分数0.63,嗜酸粒细胞分数0.007,红细胞计数4.46×1012/L,血红蛋白116 g/L,血小板计数369×109/L,红细胞沉降率112 mm/h,支原体抗体1∶80,肝肾功能均正常,超敏C反应蛋白9.1 mg/L,D-D二聚体136 μg/L,IgE总量41.58 KU/L,肺吸虫抗体阴性;风湿、免疫全套均正常,核周型抗中性粒细胞胞质抗体(P-ANCA)、胞质型抗中性粒细胞胞质抗体(C-ANCA)均阴性;肿瘤标志物CA19-9、CA125、癌胚抗原(CEA)、神经元烯醇化蛋白、CYFA21-1均正常;血气分析示:pH 7.41,动脉二氧化碳分压(PaCO2)39 mm Hg(1 mm Hg=0.133 kPa),动脉血氧分压(PaO2)96 mm Hg,动脉血氧饱和度(SaO2)98%,痰细菌及真菌培养3次阴性,痰找抗酸杆菌3次阴性;肺功能检查示小气道功能障碍。5月11日行支气管镜检查示气管黏膜无充血水肿,各管腔内未见新生物,支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)找脱落细胞阴性,BALF细胞分类:中性粒细胞2.4%,巨噬细胞82.3%,淋巴细胞15.3%,经支气管针吸活检(TBNA)涂片未找到癌细胞。诊断:(1)双肺病变:社区获得性肺炎?(2)高血压?
给予莫西沙星针0.4 g静脉滴注,1次/d,治疗1周后改为莫西沙星片0.4 g口服,1次/d,治疗3 d,复查胸部CT示,右上肺病灶稍吸收,但左下肺新发结节影及斑片状磨玻璃影(见图2)。5月16日给予经皮肺穿刺左下肺组织活检,病理结果示,在肺泡腔内可见由成纤维细胞组成的疏松纤维息肉样组织,伴有机化(肉质变),经肺泡间孔达相邻肺泡腔,背景内见慢性炎性细胞浸润,并见少量散在的巨细胞(见图3、4),明确诊断为COP。嘱患者口服泼尼松0.75 mg·kg-1·d-1,遂出院。2周后门诊复诊,诉咳嗽、气促、乏力等症状消失,复查胸部CT示病灶基本吸收(见图5)。再2周后门诊复诊,诉全身肌肉酸痛明显,胃肠道不适,考虑为泼尼松不良反应,予加用阿奇霉素片500 mg/d,并逐渐减少泼尼松剂量(20 mg/d,1个月;10 mg/d,1个月;5 mg/d,1个月),3个月后停用泼尼松,继续口服阿奇霉素片500 mg/d,6个月后停用,随诊1年无复发。
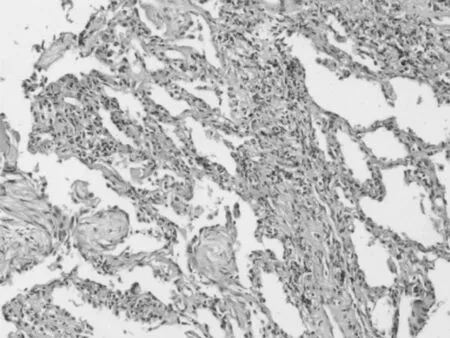
图3 经皮肺穿刺肺组织活检(HE,×10)Figure 3 Lung biopsy of percutaneous lung puncture
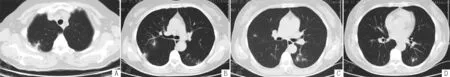
注:A:右上肺病灶稍吸收;B:支气管分支层面见右肺病灶较入院时明显吸收,左肺背段见新发点片状渗出影;C:右肺中叶病灶较入院时明显吸收,左下肺见新发小结节影,周围渗出影;D:左下肺新发结节影及斑片状磨玻璃影
图2 治疗后复查胸部CT
Figure 2 The chest CT imaging after treatment
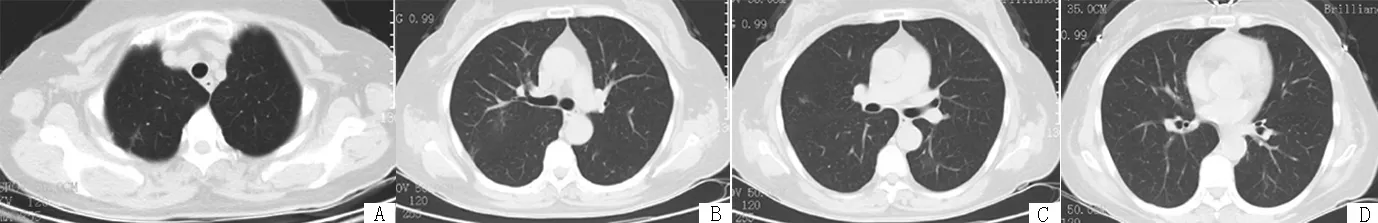
注:A:右上肺病灶少许纤维条索影;B:气管分支层面见右肺少许纤维条索影,左下肺病灶已吸收;C:右肺中叶及左下肺少许渗出影;D:左下肺病灶已基本吸收
图5 出院2周后复诊胸部CT
Figure 5 The chest CT imaging after two weeks discharge
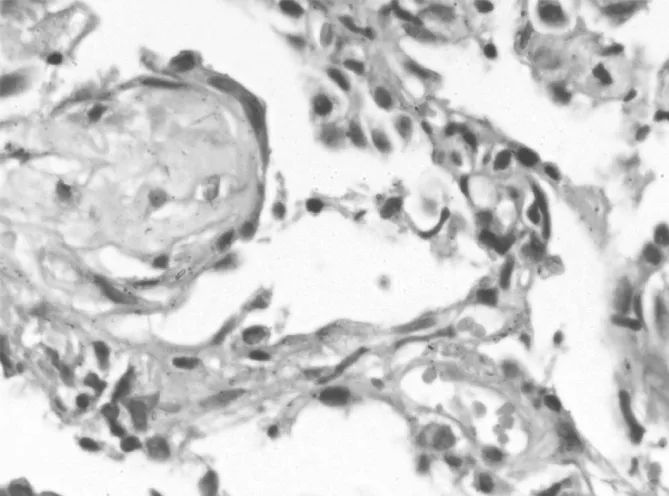
图4 经皮肺穿刺肺组织活检(HE,×40)Figure 4 Lung biopsy of percutaneous lung puncture
2 文献复习
2.1 资料来源 以“(大环内酯类or红霉素or罗红霉素or阿奇霉素or克拉霉素)AND(隐源性机化性肺炎or闭塞性细支气管炎并机化性肺炎)”为检索词检索万方数据库,未发现符合条件文献;以“〔(macrolides)or(Azithromycin)or(erythromycin)or(roxithromycin)or(clarithromycin)”AND“(Cryptogenic organizing pneumonitis)or(Bronchiolitis obliterans organizing pneumonia)〕”为检索词检索PubMed数据库,检索时间截至2012年12月,共检索出35篇文献,经阅读摘要后剔除与本研究目的无关以及重复发表的文献,最后有8篇文献入选,连同本文报道的1例患者,共有35例大环内酯类药物单独或联合治疗COP的患者被报道。
3 讨论
3.2 治疗 糖皮质激素是COP的传统初始治疗药物,85%~90%患者数天内治疗反应良好[10],仍有10%~15%的患者因激素抵抗而使病情进展迅速,另有13%~58%的患者在激素减量过程中或停药后疾病复发[11]。大环内酯类药物作为一种免疫调节剂已广泛使用于支气管哮喘、支气管扩张、弥漫性泛细支气管炎等疾病,近年来有研究报道,大环内酯类药物治疗COP也显示出显著的疗效[1-6,12-13]。本研究总结发现,35例以大环内酯类药物治疗COP的患者中有20例初始即单独使用大环内酯类药物治疗,16例治愈,在重症COP及反复发作患者联合使用亦表现出好转作用,表明大环内酯类药物对COP具有良好疗效。对于大环内酯类药物治疗COP的机制,目前并不十分明确。COP是一种肺部炎性疾病,已有多项研究表明大环内酯类药物具用抗炎作用[14-15],并已广泛应用于各种急慢性呼吸道疾病,并取得良好疗效。Kudoh[16]证实,红霉素治疗弥漫性泛细支气管可显著提高患者生存率;Itkin等[17]证实,在哮喘患者中应用大环内酯类药物可降低气道高反应性并减少糖皮质激素用量;刘积锋等[18]报道,长期口服小剂量罗红霉素联合盐酸氨溴索可改善稳定期支气管扩张症患者支气管扩张及其周围病变占肺叶面积、扩张支气管管壁增厚积分。因此推断,大环内酯类药物治疗COP的机制主要是发挥其抗炎作用而非抗感染作用。大环内酯类药物的抗炎作用不仅依赖于用药时间,也依赖于药物分子结构。14元环和15元环大环内酯类药物如红霉素、克拉霉素、阿奇霉素被认为具有有效的抗炎作用[19]。Cai等[5]通过比较克拉霉素与阿奇霉素对COP患者BALF中炎性因子的影响发现,克拉霉素相对于阿奇霉素具有更为强大的抗炎作用。
综上所述,对于轻症COP患者可尝试以大环内酯类药物作为一线治疗药物,对在激素减量或停用后反复发作的COP患者,可考虑加用大环内酯类药物,但大环内酯类药物适应证目前并无一致观点。本研究所引述文献基于个案报道或数量较小的病例对照研究,对进一步明确大环内酯类药物治疗COP的机制、剂量、疗程等尚需进行大规模随机临床对照研究。
1 Vaz AP,Morais A,Melo N,et al.Azithromycin as an adjuvant therapy in cryptogenic organizing pneumonia[J].Rev Port Pneumol,2011,17(4):186-189.
2 Chang WJ,Lee EJ,Lee SY,et al.Successful salvage treatment of steroid-refractory bronchiolar COP with low-dose macrolides[J].Pathol Int,2012,62(2):144-148.
3 Lee J,Cha SI,Park TI,et al.Adjunctive effects of cyclosporine and macrolide in rapidly progressive cryptogenic organizing pneumonia with no prompt response to steroid[J].Intern Med,2011,50(5):475-479.
4 Radzikowska E,Wiatr E,Gawryluk D,et al.Organizing pneumonia-clarithromycin treatment[J].Pneumonol Alergol Pol,2008,76(5):334-339.
5 Cai M,Bonella F,Dai H,et al.Macrolides inhibit cytokine production by alveolar macrophages in bronchiolitis obliterans organizing pneumonia[J].Immunobiology,2013,218(6):930-937.
6 Stover DE,Mangino D.Macrolides:a treatment alternative for bronchiolitis obliterans organizing pneumonia? [J].Chest,2005,128(5):3611-3617.
7 American Thoracic Society,European Respiratory Society.American Thoracic Society/European Respiratory Society International Multidisciplinary Consensus Classification of the Idiopathic Interstitial Pneumonias.This joint statement of the American Thoracic Society(ATS),and the European Respiratory Society(ERS) was adopted by the ATS board of directors,June 2001 and by the ERS Executive Committee,June 2001[J].Am J Respir Crit Care Med,2002,165(2):277-304.
8 李惠萍,范峰,李秋红,等.肺活检证实隐源性机化性肺炎25例临床诊治体会[J].中华结核和呼吸杂志,2007,30(4):259-264.
9 Ianaro A,Ialenti A,Maffia P,et al.Anti-inflammatory activity of macrolide antibiotics[J].J Pharmacol Exp Ther,2000,292(1):156-163.
10 Drakopanagiotakis F,Polychronopoulos V,Judson MA.Organizing pneumonia[J].Am J Med Sci,2008,335(1):34-39.
11 Yousem SA,Lohr RH,Colby TV.Idiopathic bronchiolitis obliterans organizing pneumonia/cryptogenic organizing pneumonia with unfavorable outcome:pathologic predictors[J].Mod Pathol,1997,10(9):864-871.
12 Ichikawa Y,Ninomiya H,Katsuki M,et al.Low-dose/long-term erythromycin for treatment of bronchiolitis obliterans organizing pneumonia(BOOP)[J].Kurume Med J,1993,40(2):65-67.
13 Ishii T,Manabe A,Ebihara Y,et al.Improvement in bronchiolitis obliterans organizing pneumonia in a child after allogeneic bone marrow transplantation by a combination of oral prednisolone and low dose erythromycin[J].Bone Marrow Transplant,2000,26(8):907-910.
14 Mukae H,Kadota J,Kohno S,et al.Increase of activatied T-cells in BAL fluid of Japanese patients with bronchiolitis obliterans organizing pneumonia and chronic eosinophinic pneumonia[J].Chest,1995,108(1):123-128.
15 Dorca J,Padrones S,Manresa F.Macrolides and lower respiratory tract infections[J].Eur Respir Mon,2004(28):78-93.
16 Kudoh S.Erythromycin treatment in diffuse panbronchiolitis[J].Curr Opin Pulm Med,1998,4(2):116-121.
17 Itkin IH,Menzel ML.The use of macrolide antibiotic substances in the treatment of asthma[J].J Allergy,1970,45(3):146-162.
18 刘积锋,钟小宁,何志义,等.小剂量罗红霉素对支气管扩张症稳定期治疗的影响[J].中华结核和呼吸杂志,2012,35(11):824-827.
19 Sharma S,Jaffe A,Dixon G.Immunomodulatory effects of macrolide antibiotics in respiratory disease:therapeutic implications for asthma and cystic fibrosis[J].Paediatr Drugs,2007,9(2):107-118.



