边晓慧,何 平,孙广萍,孙 立,李德天,冯江敏
骨髓间充质干细胞(MSC)的归巢是其在各种肾脏疾病中发挥作用的第一步。目前,大量证据表明,当特定的组织器官受损后,外源性的MSC能够优先定位于受损靶器官的受损部位,包括心[1]、脑[2]、肾[3]等,并且与MSC进入体内的方式无关。目前,对于MSC归巢的机制并不明确,假说认为在受损的部位某种特异性的化学趋化因子或细胞因子较正常组织明显升高,而MSC表达不同的黏附分子或趋化因子,其之间的相互作用促使MSC定向性地移动、黏附、定植于受损部位,从而发挥对靶器官的保护作用。透明质酸(HA)在很多肾脏疾病中都出现表达升高[4-6],而其特异性配体是MSC的表面特异性受体CD44。Zhu等[7]在体外实验中发现HA能剂量依赖性地刺激MSC的迁移,Herrera等[4]在甘油诱导的急性肾衰竭模型中发现MSC的确能够迁移至HA表达明显的区域。所以目前提出了新的观点,即CD44和HA之间的相互作用可能是外源性MSC在体内归巢于受损肾脏的关键因素。本课题组前期实验已经发现在大鼠5/6肾切除后的第8周给予尾静脉注射MSC,不仅归巢的数量较多,而且能够修复受损的肾脏[8]。故本实验拟在该模型中进一步研究MSC的归巢是否也与CD44和HA之间的相互作用有关以及是否影响MSC修复肾脏的能力。
1 材料与方法
1.1 实验材料 实验用细胞株:稳定转染绿色荧光蛋白的大鼠MSC/GFP购自赛业(广州)生物科技有限公司(RASMX-01101)。实验动物:成年健康清洁级雄性SD大鼠36只,体质量200~250 g,鼠龄7~8周,由中国医科大学附属盛京医院动物室提供。主要试剂:SD大鼠MSC基础培养基(RASMX-03011-440,广州赛业),10% MSC专用胎牛血清(RASMX-05001-50,广州赛业)。兔抗大鼠透明质酸结合蛋白(HABP)多克隆抗体(lifespan,USA);小鼠抗大鼠HABP单克隆抗体(Bio-World,USA);小鼠抗大鼠α平滑肌肌动蛋白(α-SMA)单克隆抗体(武汉博士德试剂有限公司);兔抗大鼠CD68多克隆抗体(武汉博士德试剂有限公司);抗CD44抗体(OX50,Becton Dickinson,San Jose,CA,USA);小鼠抗绿色荧光蛋白标签单克隆抗体(Earth OX,LLC,San Francisco,CA,USA)。
1.2 实验方法
1.2.1 MSC的培养和CD44的表达 MSC/GFP在SD大鼠MSC基础培养基中,37 ℃ 5%CO2恒温箱中进行常规细胞培养。MSC能够持续表达绿色荧光(见图1A),流式细胞仪分析MSC明显表达CD44(图1B)。
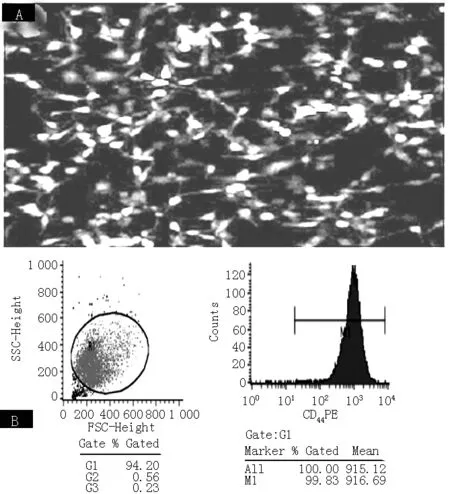
注:A为绿色荧光蛋白标记的MSC;B为CD44在MSC的表达;MSC=间充质干细胞
图1 绿色荧光蛋白标记的MSC表达CD44
Figure1 Expression of CD44in MSC labled by GFP
1.2.2 建立大鼠慢性肾衰竭模型 所有大鼠的实验步骤都经过中国医科大学附属盛京医院动物伦理委员会批准。应用两步法[9]建立大鼠慢性肾衰竭模型,适应性饲养1周后,先行右肾全切,1周后左肾切除2/3。假手术组只进行麻醉和肾被膜剥离,而不进行肾切除术。
1.2.3 MSC的治疗 选取第二次术后8周仍存活的大鼠,根据体质量由小到大编号,从随机数字表上抄录随机数字,每个随机数目除以4,利用完全随机设计法分为4组:假手术组(假手术大鼠尾静脉注射1×107/ml MSC,n=8)、模型组〔5/6肾切除大鼠尾静脉注射1 ml磷酸盐缓冲液(PBS),n=8〕、MSC组(5/6肾切除大鼠尾静脉注射1×107/ml MSC,n=8)和MSC/抗CD44组(5/6肾切除大鼠尾静脉注射1×107/ml提前用抗CD44抗体OX50预孵的MSC,n=8)。治疗4周后处死大鼠,留取血标本和肾组织。
1.3 肾功能指标 处死大鼠后收集血标本,分离上清液,于中国医科大学附属盛京医院检验科应用常规方法检测血清肌酐和尿素氮,进行肾功能的评估。
1.4 组织形态学分析 过碘酸雪夫(PAS)染色和Masson染色后观察病理改变。采用半定量方法计算肾小球硬化指数[10]和肾小管间质损伤指数[11],其中肾小球硬化定义为局灶或球性毛细血管袢的闭塞或玻璃样变,肾小管间质损伤的定义为炎性细胞浸润、小管萎缩/代偿性扩张和间质纤维化。
1.5 免疫荧光法 应用免疫荧光法进行肾组织MSC追踪,双荧光法观察MSC与HA的定位关系。冷冻切片10 μm,热修复,5%脱脂奶粉封闭30 min,滴加小鼠抗绿色荧光蛋白标签单克隆抗体(1∶5 000)或兔抗大鼠HA结合蛋白抗体(1∶50),PBS替代一抗作为阴性对照,4 ℃过夜,避光滴加对应的荧光二抗,4′,6-二脒基-2-苯基吲哚(DAPI)复染核5 min,甘油封片,共聚焦显微镜观察。
1.6 免疫组化法 肾组织石蜡包埋,切片,脱蜡,热修复,5%脱脂奶粉封闭,分别加入一抗:兔抗大鼠HA结合蛋白抗体(1∶50),小鼠抗大鼠α-SMA抗体(肌成纤维细胞标记,1∶320)和兔抗大鼠CD68抗体(巨噬细胞标记,1∶150)按ABC免疫酶染色(ABC)法进行免疫组化染色,二氨基联苯胺(DAB)显色;PBS替代一抗作为阴性对照。每张切片随机取10个高倍视野(×400),计算积分光密度值(IOD),取平均值。
1.7 免疫印迹法 称取100 mg肾皮质,提取总蛋白,应用BCA法测定蛋白浓度,变性,聚丙烯酰胺凝胶电泳,转膜,封闭。不同的转移膜分别加入不同一抗〔小鼠抗大鼠HA结合蛋白抗体(1∶300)和兔抗大鼠β-actin单克隆抗体1∶2 000〕4 ℃过夜,加入相应的二抗,ECL显色发光,电脑扫描拍照,图像分析系统测定光密度值。计算目的蛋白与β-actin光密度比值作为半定量指标。
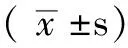
2 结果
2.1 4组肾功能、肾小球硬化指数、肾小管间质损伤指数比较 4组肌酐、尿素氮、肾小球硬化指数、肾小管间质损伤指数比较,差异均有统计学意义(P<0.05);其中与假手术组比较,模型组、MSC组、MSC/抗CD44组肌酐、尿素氮、肾小球硬化指数、肾小管间质损伤指数均升高,差异有统计学意义(P<0.05);与模型组比较,MSC组、MSC/抗CD44组肌酐、尿素氮、肾小球硬化指数、肾小管间质损伤指数均降低,差异有统计学意义(P<0.05);MSC组、MSC/抗CD44组比较,差异均无统计学意义(P>0.05,见表1)。

Table1 Comparasion of renal function,glomerulosclerosis index and renal tubular mesenchymal damage index among 4 groups
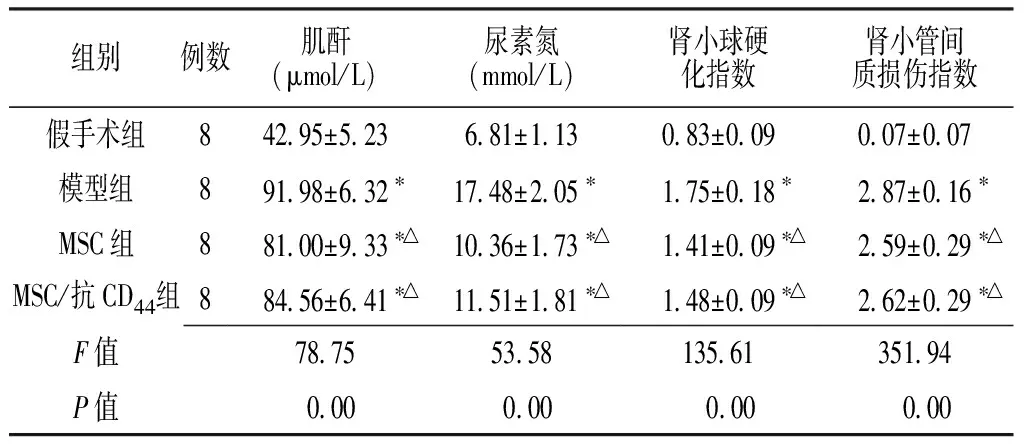
组别例数肌酐(μmol/L)尿素氮(mmol/L)肾小球硬化指数肾小管间质损伤指数假手术组842 95±5 236 81±1 130 83±0 090 07±0 07模型组891 98±6 32∗17 48±2 05∗1 75±0 18∗2 87±0 16∗MSC组881 00±9 33∗△10 36±1 73∗△1 41±0 09∗△2 59±0 29∗△MSC/抗CD44组884 56±6 41∗△11 51±1 81∗△1 48±0 09∗△2 62±0 29∗△F值78 7553 58135 61351 94P值 0 00 0 00 0 00 0 00
注:与假手术组比较,*P<0.05;与模型组比较,△P<0.05
2.2 MSC对肾组织病理的影响 PAS染色和Masson染色结果发现,与假手术组相比(见图2A、图3A),模型组的肾脏病理改变主要为肾小球肥大、肾小管上皮细胞浊肿变性,局灶系膜细胞增生,系膜基质增宽,局灶性肾小球毛细血管袢玻璃样变、间质细胞炎性细胞浸润,灶性间质纤维化(见图2B、图3B)。MSC治疗后上述病理改变均有所改善(见图2C、图3C),提前用抗CD44抗体孵育的MSC治疗4周后,上述病理改变亦得到改善(见图2D、图3D)。
2.3 肾组织中MSC追踪 治疗4周后,假手术组未发现有归巢的MSC(见图4A),而在MSC组的残肾组织中发现较多的MSC,主要定位于肾小管上皮细胞、血管周围、肾间质和部分肾小球内(见图4B),而MSC/抗CD44组归巢的MSC减少,尤其是肾小管上皮细胞内(见图4C)。双免疫荧光结果显示较多MSC归巢HA表达丰富的区域(见图4D)。
2.4 肾组织中HA的表达 HA在假手术组大鼠的肾皮质几乎不表达(见图5A),而髓质有部分表达(见图5B),模型组大鼠受损肾小管上皮细胞胞质中明显分泌HA,在肾小球和肾间质也有少量HA的表达(见图5C)。免疫印迹法也证实模型组大鼠肾皮质HA蛋白表达水平明显增高(见图5D)。
2.5 MSC对肾组织巨噬细胞和肌成纤维细胞的影响 与假手术组相比(见图6A、图7A),模型组大鼠的肾小球和间质内有大量巨噬细胞(CD68阳性的细胞)浸润(见图6B),同时有明显的肌成纤维细胞(α-SMA阳性的细胞)堆积(见图7B),而提前用或不用抗CD44抗体预孵的MSC治疗后均能明显减少巨噬细胞(图6C、D)和肌成纤维细胞(见图7C、D)。
3 讨论
目前研究证实无论是甘油[4]、顺铂[12]或缺血-再灌注[13]诱导的急性肾受损、还是免疫介导的[3]或非免疫介导的[14]慢性肾脏损伤中,外源性MSC均能归巢于受损部位。Kunter等[3]给抗Thy1.1肾炎大鼠的左肾动脉注入标记的MSC,第4~10天20%~50%的肾小球都能够发现标记的MSC,而将标记的系膜细胞用同样的方法注入,结果双肾均未发现标记的MSC。本课题组在慢性马兜铃肾病大鼠实验中发现,尾静脉注射MSC后发现在损伤较为明显的皮髓质交界部位的肾小管和肾间质内有标记的MSC[14-16]。类似的,本实验发现在5/6肾切除术后第8周尾静脉注射MSC,治疗4周后也发现标记的MSC归巢于残肾组织,主要定位于受损的肾小球、肾小管、肾间质和管周毛细血管丛。
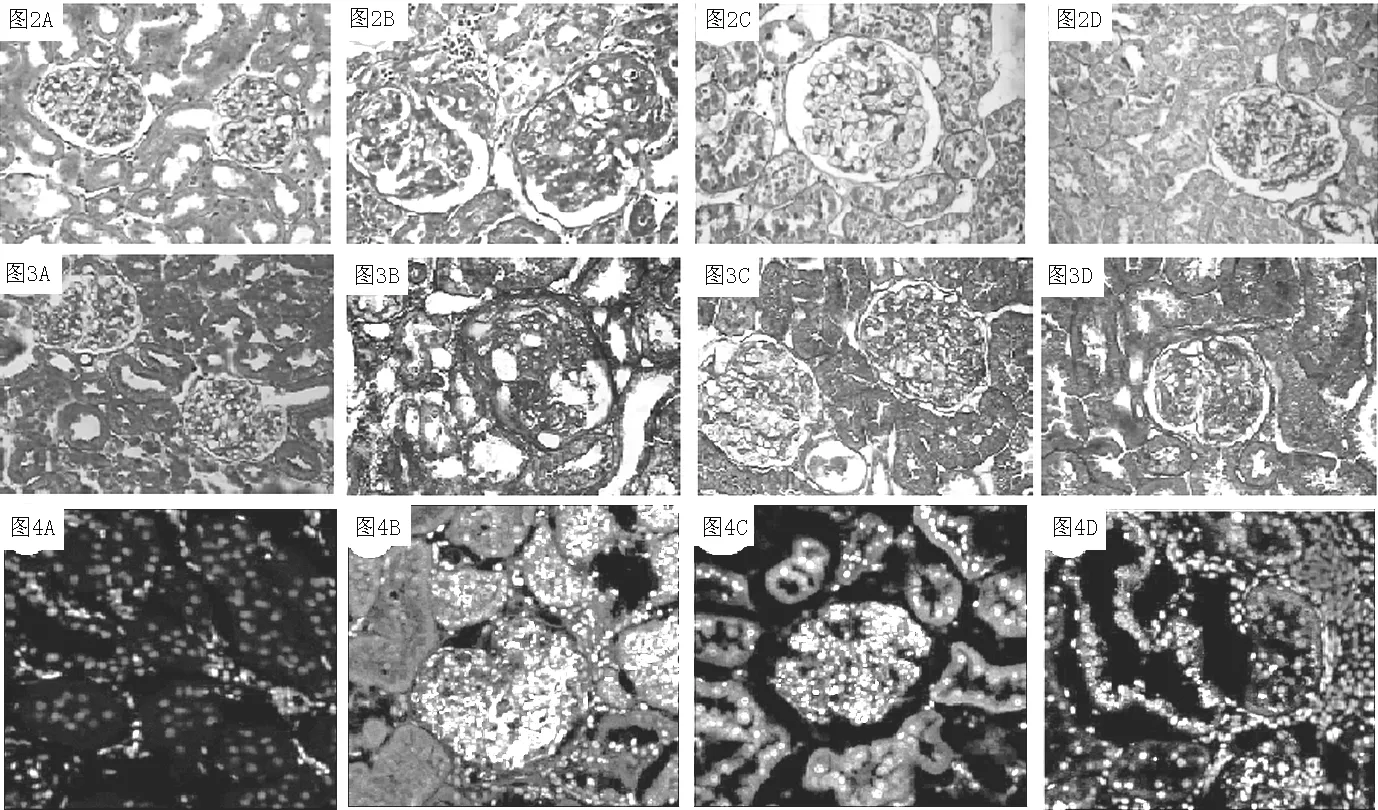
注:A为假手术组,B为模型组,C为MSC组,D为MSC/抗CD44组
图2 肾组织的PAS染色(×400)
Figure2 PAS staining in kidney tissue
注:A为假手术组,B为模型组,C为MSC组,D为MSC/抗CD44组
图3 肾组织的Masson染色(×400)
Figure3 Masson staining in kidney tissue
注:A为假手术组,B为MSC组,C为MSC/抗CD44组,D为MSC与HA在MSC组的共表达
图4 免疫荧光法追踪肾组织中MSC(×400)
Figure4 Tracking MSC in remnant kidney tissue by immunofluorescence
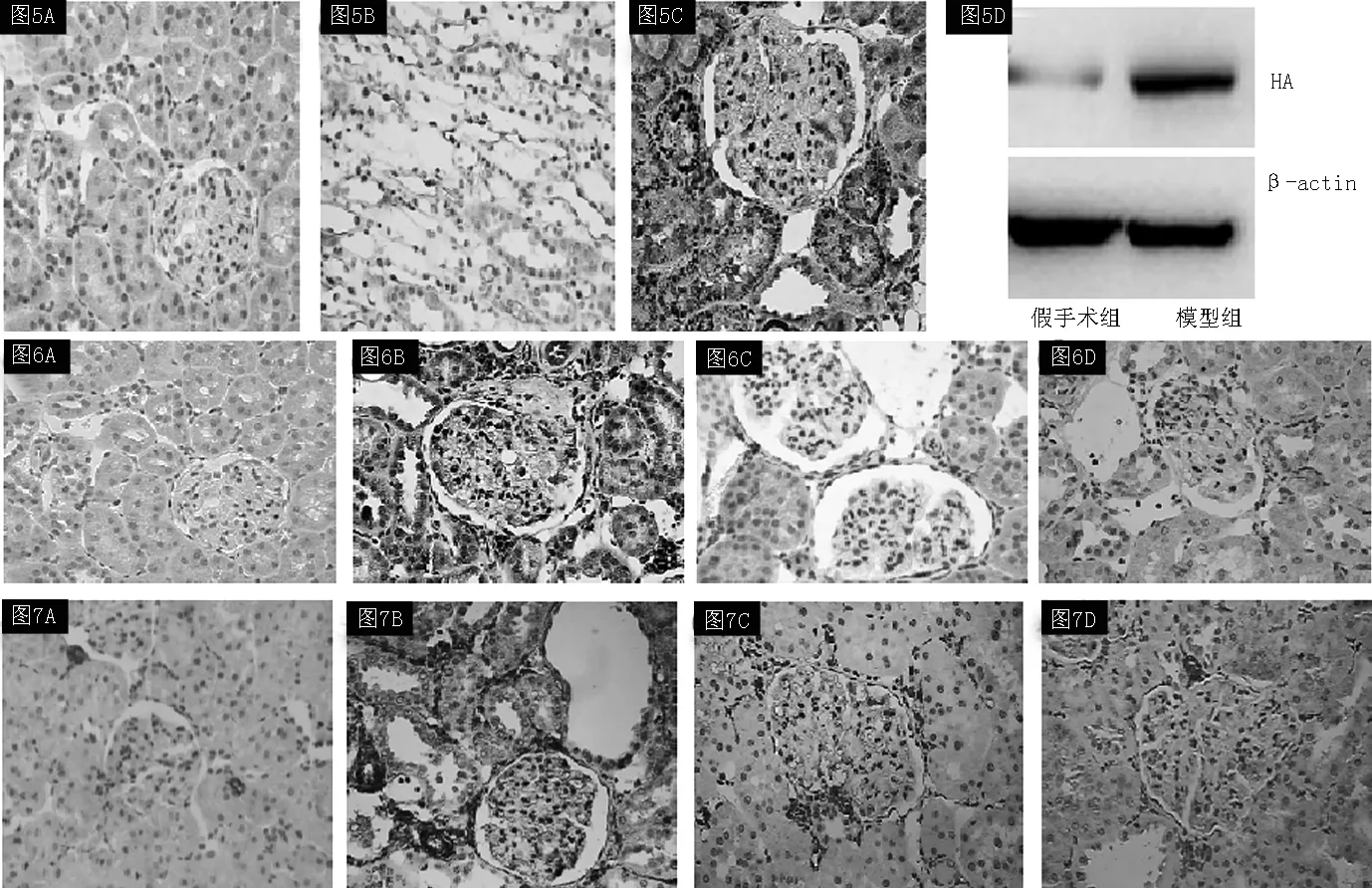
注:A为假手术组肾皮质,B为假手术组肾髓质,C为模型组肾皮质,D为免疫印迹法;HA=透明质酸
图5 肾脏HA免疫组化染色(×400)和肾皮质HA免疫印迹法
Figure5 Expression of HA by immunohistochemical staining in kidney tissue and by Western blotting in renal cortex
注:A为假手术组,B为模型组,C为MSC组,D为MSC/抗CD44组
图6 肾组织中CD68的免疫组化染色(×400)
Figure6 Expression of CD68by immunohistochemistry staining in kidney tissue
注:A为假手术组,B为模型组,C为MSC组,D为MSC/抗CD44组
图7 肾组织中α-SMA的免疫组化染色(×400)
Figure7 Expression of α-SMA by immunohistochemistry staining in kidney tissue
目前,对于MSC归巢的机制并不明确,认为类似于炎性细胞向炎症部位以及造血干细胞(HSC)向骨髓腔内的趋化运动,是一个高度选择的过程,在受损的组织存在某种特异性的化学趋化因子或细胞因子较正常组织明显升高,通过与MSC表达的某种趋化因子的相互作用促使MSC定向性地移动、黏附和定植于受损部位。既往研究已经证实SDF-1-CXCR4的相互作用是目前已知的HSC归巢最强大的趋化剂[17],但史明霞等[18]研究发现大部分的MSC表面几乎检测不到CXCR4的表达,故提示MSC和HSC的归巢机制可能不一样。HA为一种线性非硫酸化糖胺聚糖,是细胞外基质的主要成分之一,其在正常肾髓质内含量丰富,而在肾皮质中几乎完全缺乏,但是在很多急慢性肾脏损伤中都发现肾脏皮质大量表达HA[4-6]。相似的,本实验中发现5/6肾切除术后的肾皮质中大量表达HA,主要由扩张的肾小管上皮细胞和炎性细胞浸润的肾间质分泌,提示与肾脏受损密切相关。大多数MSC表面均表达HA的特异性配体CD44,本研究所用的MSC经过流式细胞仪分析表面标记也证实了这一点。体外实验发现HA能剂量依赖性地刺激MSC的迁移,这种迁移能力可以被单克隆抗CD44抗体所抑制[7]。Herrera等[4]在甘油诱导的急性肾衰竭模型研究中发现MSC迁移至HA表达明显的区域,能够促进受损部位的形态学和功能的恢复,但如果给予用抗CD44抗体预处理的MSC或CD44-/-的MSC或只表达CD44但无CD44功能的MSC则都不能迁移至受损组织,结果证实HA-CD44的相互作用是MSC归巢于急性肾脏损伤的主要原因。本实验发现应用抗CD44特异性的抗体阻断与HA的结合能力后,归巢于残肾组织的MSC也明显减少,同时双荧光分析大部分归巢的MSC位于HA表达丰富的区域,所以本研究结果提示HA-CD44的相互作用在慢性肾衰竭模型中也参与了MSC的归巢。
与Herrera等[4]研究结果不同的是,应用抗CD44抗体虽然阻断了HA与CD44的相互作用,但并不能完全阻断MSC的归巢,同时还依然能够改善残肾功能,减少巨噬细胞的浸润和延缓肾纤维化的发生,解释这些现象可能的原因有:(1)本研究双荧光结果显示并不是所有归巢的MSC都定位于HA表达丰富的区域,这说明HA-CD44的相互作用并不是惟一引起MSC在慢性肾衰竭模型中归巢的趋化剂。近期研究发现人的MSC表面还存在其他一系列的趋化因子的受体,如CCR-CXCL1、CCR7-CX3CL1 和CXCR6-CXCL6等[19],它们之间的相互作用都具有潜在的MSC归巢趋化能力,但可能存在组织特异性或者相互影响。(2)阻断MSC的部分归巢后并未影响MSC修复受损肾脏的能力,与既往研究一致[20-21],说明MSC修复受损肾脏主要是来自于旁分泌的机制[8]。(3)本实验中应用MSC治疗后4周观察治疗效果,如果延长观察时间,用或不用抗CD44抗体提前孵育MSC可能会因归巢的数量差别而表现出不同的治疗效果。
综上所述,在大鼠肾衰竭模型中,MSC表面的受体CD44与受损肾脏组织大量表达的HA之间的相互作用是影响外源性MSC归巢于受损肾脏组织的原因之一,但是在观察期内并未影响MSC修复受损肾脏的能力。
1 Kraitchman DL,Tatsumi M,Gilson WD,et al.Dynamic imaging of allogeneic mesenchymal stem cells afficking to myocardial infarction[J].Circulation,2005,112(10):1451-1461.
2 Ji JF,He BP,Dheen ST,et al.Interactions of chemokines and chemokine receptors mediate the migration of mesenchymal stem cells to the impaired site in the brain after hypoglossal nerve injury[J].Stem Cells,2004,22(3):415-427.
3 Kunter U,Rong S,Djuric Z,et al.Transplanted mesenchymal stem cells accelerate glomerular healing in experimental glomerulonephritis[J].J Am Soc Nephrol,2006,17(8):2202-2212.
4 Herrera MB,Bussolati B,Bruno S,et al.Exogenous mesenchymal stem cells localize to the kidney by means of CD44following acute tubular injury[J].Kidney Int,2007,72(4):430-441.
5 Goransson V,Johnsson C,Jacobson A,et al.Renal hyaluronan accumulation and hyaluronan synthase expression after ischaemia-reperfusion injury in the rat[J].Nephrol Dial Transplant,2004,19(4):823-830.
6 冯江敏,吴靖川.慢性间质性肾炎炎症细胞浸润的特点[J].中华肾脏病杂志,1999,15(6):372-375.
7 Zhu H,Mitsuhashi N,Klein A,et al.The role of the hyaluronan receptor CD44in mesenchymal stem cell migration in the extracellular matrix[J].Stem Cells,2006,24(4):928-935.
8 Bian X,Zhang B,Guo W,et al.Effects of mesenchymal stem cells transplanted at different time points in a rat remnant kidney model[J].Am J Nephrol,2014,39(1):75-84.
9 Schaefer F,Chen Y,Tsao T,et al.Impaired JAK-STAT signal transduction contributes to growth hormone resistance in chronic uremia[J].Journal of Clinical Investigation,2001,108(3):467-475.
10 Aoyama I,Shimokata K,Niwa T.Combination therapy with benazepril and oral adsorbent ameliorates progressive renal fibrosis in uremic rats[J].Nephron,2002,90(3):297-312.
11 Tanaka T,Kojima I,Ohse T,et al.Cobalt promotes angiogenesis via hypoxia-inducible factor and protects tubulointerstitium in the remnant kidney model[J].Laboratory Investigation,2005,85(10):1292-1307.
12 Imberti B,Morigi M,Tomasoni S,et al.Insulin-like growth factor-1 sustains stem cell mediated renal repair[J].J Am Soc Nephrol,2007,18(11):2921-2928.
13 Tögel F,Weiss K,Yang Y,et al.Vasculotropic,paracrine actions of infused mesenchymal stem cells are important to the recovery from acute kidney injury[J].Am J Physiol Renal Physiol,2007,292(5):F1626-1635.
14 邹杰,冯江敏,李维,等.同种异体骨髓间充质干细胞对肾小管周毛细血管丛修复影响的研究[J].中国中西医结合杂志,2008,28(2):146-151.
15 李维,冯江敏,邹杰,等.骨髓源性干细胞干细胞移植对慢性马兜铃酸肾病大鼠的治疗作用[J].中华肾脏病杂志,2007,23(5):336-337.
16 Li W,Jiang H,Feng JM.Isogenic mesenchymal stem cells transplantation improves a rat model of chronic aristolochic acid nephropathy via upregulation of hepatic growth factor and downregulation of transforming growth factor β1[J].Molecular and Cellular Biochemistry,2012,368(1/2):137-145.
17 Juarez J,Bendall L,Bradstock K.Chemokines and their receptors as therapeutic targets:the role of the SDF-1/CXCR4 axis[J].Curr Pharm Pcs,2004,10(11):1245-1259.
18 史明霞,李静,廖联明,等.胎儿骨髓源 FIk1+间充质干细胞的归巢机制[J].中国组织工程研究与临床康复,2009,13(14):2673-2679.
19 Sordi V,Malosio ML,Marchesi F,et al.Bone marrow mesenchymal stem cells express a restricted set of functionally active chemokine receptors capable of promoting migration to pancreatic islets[J].Blood,2005,106(2):419-427.
20 Semedo P,Correa-Costa M,Antonio Cenedeze M,et al.Mesenchymal stem cells attenuate renal fibrosis through immune modulation and remodeling properties in a rat remnant kidney model [J].Stem Cells,2009,27(12):3063-3073.
21 Abdel Aziz MT,Wassef MA,Ahmed HH,et al.The role of bone marrow derived-mesenchymal stem cells in attenuation of kidney function in rats with diabetic nephropathy [J].Diabetol Metab Syndr,2014,6(1):34.



