王文艺,邬 超,杨晓红
饲鸽者肺(PBL)属外源性过敏性肺泡炎(EAA)或过敏性肺炎(HP),是敏感个体反复吸入鸽子的排泄物后远端支气管及肺泡发生超敏反应引起的肺部疾病[1-2]。PBL发病机制是以Ⅲ型免疫复合物及IV型细胞免疫反应介导的免疫反应[3]。本研究旨在探讨维吾尔族人群中饲鸽与未饲鸽者肺泡灌洗液(BALF)与血清中IL-2、IL-10、TNF-α水平的变化及其在PBL发病机制中的作用。
1 对象与方法
1.1 研究对象 选取2012年8月—2013年12月在新疆(喀什、和田)地区至少饲鸽1年以上的维吾尔族受试者,其中新疆维吾尔自治区人民医院呼吸科确诊为PBL的受试者65例为病例组,年龄38~78岁,平均(55.0±10.2)岁;未患PBL的受试者120例为阴性对照组,年龄35~75岁,平均(58.8±15.5)岁。选择同期本院喀什、和田体检中心体检健康的未饲鸽的维吾尔族受试者120例为正常对照组,年龄39~76岁,平均(46.5±11.8)岁。
1.2 纳入与排除标准 病例组:符合PBL诊断标准并确诊为PBL的维吾尔族受试者。PBL的诊断主要参考过敏性肺炎的诊断标准,即Lacasse等[4]提出的标准。阴性对照组:至少饲鸽1年以上且未患PBL的维吾尔族受试者。正常对照组:医学确诊无其他疾病的健康维吾尔族体检者。病例组与阴性对照组排除标准:特发性间质性肺炎、慢性支气管炎、急性呼吸窘迫综合征、肺炎,风湿免疫系统疾病、自身免疫性疾病、恶性肿瘤性疾病等;其他过敏性疾病及其他肺弥漫性病变疾病;饲鸽<1年及饲养其他禽类者。
1.3 检测指标与方法
1.3.1 标本制备 3组受试者均晨起抽取空腹静脉血4 ml,于3.2%枸橼酸钠抗凝剂中3 500 r/min(离心半径13.5 cm)离心5 min,分离血浆及血细胞,置于-80 ℃冰箱内保存备用。BALF使用双层无菌纱布过滤,将无用黏液及痰液过滤掉后,所剩液体立即装入硅塑瓶,以3 000 r/min(离心半径为10 cm)离心10 min后留取上清液,置于-80 ℃冰箱内保存备用。
1.3.2 酶联免疫吸附试验(ELISA)检测细胞因子水平 采用ELISA检测BALF与血清中IL-2、IL-10、TNF-α的水平,严格按照试剂盒说明书操作(ELISA试剂盒购于苏州卡尔文生物科技有限公司,均由英国Costar公司生产),在96孔ELISA平板各孔中加100 μl按一定比例稀释的包被抗体,4 ℃孵育过夜,经清洗、封闭后,在各孔中加入50 μl用0.5%BSA/PBST按一定比例稀释的标准品液或血清样本液,在室温下孵育60 min;每孔加入100 μl用BSA/PBST稀释的生物素化小鼠抗细胞因子抗体,在室温下孵育60 min;每孔加入100 μl 用BSA/PBST按1/1 000稀释的结合辣根过氧化物酶的亲和素稀释液,在室温下孵育30 min;最后在每个孔中加入100 μl 底物溶液,黑暗中室温下孵育30 min,再加入12.5%的H2SO4终止反应。将标准品的测试结果绘制成标准曲线,在分光光度计490 nm波长处读取光密度值,根据样品的测定结果计算出IL-2、IL-10、TNF-α的表达水平。
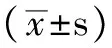
2 结果
2.1 一般资料比较 3组受试者的性别构成和年龄间差异均无统计学意义(P>0.05,见表1)。
2.2 BALF与血清中细胞因子水平比较
2.2.1 BALF与血清中IL-2、TNF-α表达水平比较 病例组BALF与血清中IL-2、TNF-α的表达水平均较阴性对照组、正常对照组升高,阴性对照组较正常对照组亦升高(P<0.05,见表2、3)。
2.2.2 BALF与血清中IL-10表达水平比较 病例组、阴性对照组BALF、血清中IL-10的表达水平较正常对照组降低(P<0.05);而病例组与阴性对照组间差异无统计学意义(P>0.05,见表2、3)。
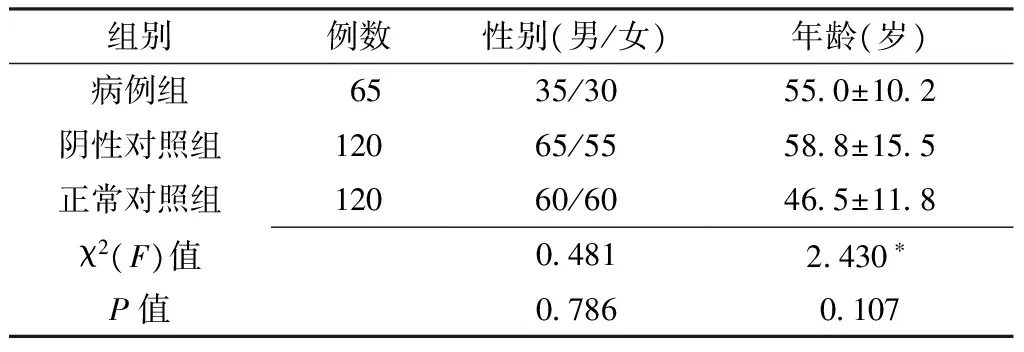
表1 3组受试者性别和年龄比较Table 1 Comparison of sex and age in three groups
注:*为F值
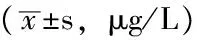
表2 3组受试者BALF中IL-2、IL-10、TNF-α水平比较Table 2 Comparison of IL-2,IL-10,TNF-α levels in BALF in three groups
注:与正常对照组比较,*P<0.05;与阴性对照组比较,△P<0.05
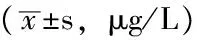
表3 3组受试者血清中IL-2、IL-10、TNF-α水平比较Table 3 Comparison of IL-2,IL-10,TNF-α levels in BALF in serum in three groups
注:与正常对照组比较,*P<0.05;与阴性对照组比较,△P<0.05
3 讨论
3.1 PBL发病机制 EAA是反复吸入某些具有抗原性的有机粉尘后引起的与免疫反应有关的肺部炎性疾病,亦称HP。目前研究表明引起EAA的常见原因有农民肺、甘蔗肺、蘑菇肺、空调肺、软木尘肺、饲鸟和鸽者肺、温室肺、麦芽、乳酪肺、垂体粉吸入肺、二异氢酸肺等[5]。尽管暴露于抗原的人数较多,但发病者占5%~15%[6],可能与外源性抗原和自身遗传易患性相互作用有关。
3.2 IL-2水平与PBL 近年研究认为细胞因子可能影响支气管哮喘和过敏性鼻炎的发生发展[7]。IL-2能促进T淋巴细胞增殖、B淋巴细胞分泌抗体,增进T细胞的杀伤作用,加强自然杀伤(NK)细胞活性[8]。研究发现IL-2在维持调节性T细胞功能方面具有重要作用[9],已经引起研究者的重视,成建华等[10]研究发现IL-2在PBL患者血清中的水平升高。本研究结果显示,饲鸽者较未饲鸽者BALF、血清中IL-2表达水平增高,说明IL-2的表达水平在维吾尔族PBL的发病机制中发挥重要作用,可能与IL-2基因转录水平的变化影响体内蛋白水平的表达有关,也可能由于长期反复吸入外界抗原(鸽子的分泌物、羽毛及排泄物),刺激外周血淋巴细胞重新分布于肺脏,促进局部T淋巴细胞在肺部聚集增殖,使得肺脏淋巴细胞增多,局部免疫反应转向以T细胞为主的肺泡炎。IL-2可激活单核细胞和巨噬细胞,在单核细胞作用下,巨噬细胞炎症蛋白(MIP)-1α被激活,幼稚巨噬细胞转化为多核巨细胞和上皮样细胞,形成肉芽肿,增加饲鸽者患PBL的风险。
3.3 TNF-α水平与PBL TNF-α是肺部重要的炎性递质,诱导中性粒细胞的趋化和局部浸润,可启动炎性反应,正常情况下以较低水平存在于人体,过量的TNF-α可引起炎性反应致组织器官损害[11],促进淋巴细胞向Th1细胞分化介导炎性反应的病理生理过程;有文献报道显示TNF-α的高表达与中性粒细胞及T淋巴细胞等炎性细胞相互作用有关[12],导致慢性阻塞性肺疾病(COPD)气道炎症的发生发展,TNF-α高表达促进肺癌、食管癌、鼻咽癌的发生发展[13]。成建华等[10]研究显示TNF-α的水平与个体所携带的基因型有关,但未发现PBL患者中BALF、血清中TNF-α的表达水平升高。本研究结果显示,在维吾尔族人群中,病例组及阴性对照组TNF-α的表达水平高于正常对照组,说明在维吾尔族人群PBL发病机制中TNF-α的表达水平发挥作用,其作用机制可能是TNF-α促进中性粒细胞表面细胞间黏附分子CD11/18表达及氧自由基释放,介导粒细胞在心肺循环中黏附于肺内毛细血管内皮上,进而损伤血管内皮引起HP。
3.4 IL-10水平与PBL IL-10是一类具有抗炎和抗过敏作用的细胞因子,是Th2细胞分泌的一种细胞因子,可抑制Th1细胞因子介导的炎性反应[14],抑制单核巨噬细胞的增殖和分化,其相对或绝对分泌不足,可能是过敏性疾病的一个易感或易加重因素[15]。本研究结果显示,IL-10的表达水平在维吾尔族PBL患者中降低,可能与新疆的地域特点、维吾尔族人群的体质以及维吾尔族饲鸽者对该病不重视、本研究样本量少及实验误差等因素有关,需要加大样本量进一步证实。
综上所述,本研究通过探讨BALF、血清中IL-2、IL-10、TNF-α表达水平的变化,结果显示IL-2、TNF-α的表达水平升高,参与了维吾尔族PBL的发生发展,可能影响了PBL的发生与转归,而IL-10表达水平的降低对PBL的发生具有一定的警示作用。亟待进一步扩大样本量,研究各细胞因子的基因单核苷酸多态性与PBL的易患性,深入了解PBL发生的分子生物学机制,为其诊断及预防提供分子靶标。
1 Gaxiola M,Buendía-Roldán I,Mejía M,et al.Morphologic diversity of chronic pigeon breeder′s disease:clinical features and survival[J].Respir Med,2011,105(4):608-614.
2 Barrera L,Mendoza F,Zuiga J,et al.Functional diversity of T-cell subpopulations in subacute and chronichypersensitivity pneumonitis[J].Respir Crit Care Med,2008,177(1):44-55.
3 Koschel DS,Cardoso C,Wiedemann B,et al.Pulmonary hypertension in chronic hypersensitivity pneumonitis[J].Lung,2012,190(3):295-302.
4 Lacasse Y,Assayag E,Cormier Y,et al.Myths and controversies in hypersensitivity pneumonitis[J].Semin Respir Crit Care Med,2008,29(6):631-642.
5 Morell F,Villar A,Montero M,et al.Chronic hypersensitivity pneumonitis in patients diagnosed with idiopathic pulmonary fibrosis:a prospective case-cohort study[J].Lancet Respir Med,2013,1(9):685-694.
6 McSharry C,Dye GM,Ismail T,et al.Quantifying serum antibody in bird fanciers′ hypersensitivity pneumonitis[J].BMC Pulmonary Medicine,2006,26(6):16.
7 Bertani T,Abate M,Zoyac G,et al.Tumor necrosis factor induces glomerular damage in the rabbit[J].Am Pathal,2009,134(2):4190-4192.
8 Ukichi K,Okamura T,Fukushima D,et al.Th1/Th2 balance in mouse delayed-type hypersensitivity model with mercuric chloride via skin and oral mucosa[J].Bull Tokyo Dent Coll,2011,52(1):13-20.
9 Mat Z,Grensemann B,Yakin Y,et al.Effect of lipoteichoic acid on IL-2 and IL-5 release from T lymphocytes in asthma and COPD[J].Immunopharmacol,2012,13(3):284-291.
10 成建华,胡娟.饲鸽者血清中细胞因子及基因多态性的检测[J].现代免疫学,2004,24(3):198-202.
11 Ueno T,Miyazaki E.Osteopontin levels are elevated in patients with eosinophilic pneumonia[J].Respirology,2010,15(7):1111-1121.
12 McSharry C,Anderson K,Bourke SJ,et al.Takes your breath away——the immunology of allergic alveolitis[J].Clin Exp Immunol,2002,128(1):3-9.
13 Seifarc C,Demple A,Seifart U,et al.TNF-αlpha,TNF-beta,IL-6,and IL-10 polymorphism in patients with chronic obstructive pulmonary diseases[J].Tissure Antigens,2005,65(1):93-100.
14 Khaghanzadeh N,Samiei A,Ramezani M,et al.Umbelliprenin induced production of IFN-γ and TNF-α,and reduced IL-10,IL-4,Foxp3 and TGF-β in a mouse model of lung cancer[J].Immunopharmacol Immunotoxicol,2014,36(1):25-32.
15 Sung WW,Lee H.The role of interleukin-10 in the progression of human papillomavirus-associated lung carcinoma[J].Oncoimmunology,2013,2(9):25854.



