王佩佩,赵玲玲
·新进展·
轻度胃肠炎伴良性惊厥的研究现状
王佩佩,赵玲玲
410013湖南省长沙市,中南大学湘雅三医院儿科
【摘要】轻度胃肠炎伴良性惊厥(CwG)是婴幼儿胃肠道感染后腹泻病程中出现的一过性表现,主要特征为一次病程中多次发生惊厥,持续时间短暂,胃肠炎表现不严重,不伴有严重脱水及电解质紊乱,预后大多良好。近年来对CwG的研究主要集中在发生机制及对惊厥的有效控制。本文对CwG的研究现状进行综述,认为治疗CwG的重点主要在于对惊厥发作的控制,推荐使用小计量利多卡因或卡马西平控制惊厥发作,但仍无统一标准,因此需要纳入样本量较大的随机对照研究来阐明最好的药物治疗。此外,CwG的病因尚不明确,近年来相关研究逐渐增多,但未出现突破性结果,仍有待进一步研究。增强对CwG的认识对于避免过度评估和应用不必要的抗癫痫药物以及消除家属对远期并发症的担忧具有重要意义。
【关键词】胃肠炎;惊厥;婴幼儿
王佩佩,赵玲玲.轻度胃肠炎伴良性惊厥的研究现状[J].中国全科医学,2016,19(18):2219-2222.[www.chinagp.net]
Wang PP,Zhao LL.Current research status of benign convulsions with mild gastroenteritis[J].Chinese General Practice,2016,19(18):2219-2222.
婴幼儿轻度胃肠炎伴良性惊厥(convulsions with mild gastroenteritis,CwG)20世纪末由日本学者提出[1]。大多学者认为,CwG是一种在胃肠炎的特殊状态下出现的惊厥发作,而不是癫痫,也并非高热惊厥[2-4]。目前,对于CwG的主要临床表现和诊断有较一致的认识[1-12],但是此病的病因、发病机制尚未明确,控制惊厥的药物选择仍未统一。近年来,国内关于此病的回顾性研究增多,但在药物治疗方面的研究欠缺,故本文对数据相对全面的外文文献进行综述,以期为提高CwG的临床诊治思路提供依据。
1CwG的病因
CwG的病因仍不清楚,大部分学者认为与感染有关,特别是病毒感染[2-12]。研究发现,CwG发病时间集中在冬春季节,相应于病毒性胃肠炎爆发的时期,提示本病的发生与病毒感染存在关联[2-3],推测轮状病毒与CwG相关性较高。在本文总结的10篇外文文献[3-12]中,共有343例患儿完善了大便轮状病毒抗原检测,阳性率达49.27%,其中最高的为Cusmai等[6]报道的69.23%,提示轮状病毒与CwG的发生有关。另有研究报道,在患者血清中检测出轮状病毒抗体或RNA[13-14];此外,Chen等[15]认为,诺如病毒感染与CwG有关,在其研究中,诺如病毒感染患者的惊厥发生率为29.7%,而轮状病毒感染患者的惊厥发生率为5.0%,并推测在轮状病毒疫苗普及后,诺如病毒将会是CwG的主要病原体。另外,在CwG患儿的大便中还检测出腺病毒[16]、柯莎奇病毒[15]、沙坡病毒[17]等,甚至检测出细菌(如空肠弯曲菌)[7,12],以上为CwG病原学研究提供了新的思路。
2CwG的发病机制
部分学者提出CwG有遗传易感性,如Sakai 等[18]报道一个6岁姐姐和4岁弟弟同时发生CwG,其父亲和祖父在婴儿时期有无热惊厥史,故认为潜在遗传因素可以提高CwG易感性。本文总结的10篇文献中有9篇[4-12]记录了326例患儿的既往史及家族史,发现这些患儿中有23例本人及104例家族直系亲属有惊厥相关病史,发生率分别为7.01%和31.90%,提示CwG可能存在遗传易感性,但仍需进一步研究。
还有学者进行了CwG与基因突变的相关研究[19-22]。良性家族性新生儿和婴儿惊厥与引起离子通道异常的一些基因(如KCNQ2、SCN1A和SCN2A)突变相关[23],而CwG与婴幼儿良性惊厥一样,用低剂量的改变神经细胞膜离子通透性的药物(卡马西平)治疗有效[20,24],提示CwG可能也与基因突变相关。然而,Weng等[21]检测12例CwG患儿的SCN1A,均未发现突变。PPRT2突变被认为与小儿惊厥、阵发性舞蹈手足徐动征、良性家族性婴儿癫痫症相关[22,25-26]。但Ishii等[22]报道,检测CwG患儿的PPRT2,未发现相关基因突变。所以,对于CwG是否真的存在基因突变,尚待进一步研究。
此外,细胞因子、神经递质在惊厥发病机制中的研究已受到广泛重视,但主要是针对轮状病毒感染。NSP4是一种轮状病毒的糖基化蛋白,其通过改变肠上皮细胞内的钙稳态,在轮状病毒感染性胃肠炎的发病机制中起着重要作用[27]。NSP4使钙离子内流引起肠细胞死亡,从而使细胞内的细胞因子、前列腺素、活性氧以及NSP4本身释放[28]。此外,有学者认为NSP4具有使膜去稳定的作用[29]。由此可推论,轮状病毒可能通过复制和诱导产生NSP4造成神经细胞膜去稳定,甚至释放细胞内物质影响周围细胞,而诱发CwG的惊厥发作。然而,并不是所有患儿的脑脊液中可检测到轮状病毒的RNA,因此这种假设是有争议的。Yeom等[30]发现,在轮状病毒胃肠炎患者中,发生惊厥患者的血钙水平显著低于无惊厥发作的患者,提示体内钙平衡的破坏在轮状病毒胃肠炎致惊厥发作的过程中起着显著作用。一氧化氮(NO)是一种高扩散性、自由基性质的气体,参与突触传递及病理过程,有研究显示,相较于化脓性脑膜炎、脑炎、高热惊厥的患者,轮状病毒胃肠炎伴惊厥的患儿血清及脑脊液中的NO代谢产物(NOx)均显著升高,在一些患者中还存在IL-6和NOx的相关性,提示轮状病毒胃肠炎伴惊厥的患儿惊厥发生可能与NO相关[31]。过量的NO是一种细胞毒性分子,可引起谷氨酸释放增多导致惊厥[32],因此轮状病毒感染引起的机体循环中NSP4、NO等增加可能导致其穿过血-脑脊液屏障,诱发CwG的发作。
另有学者认为,这个年龄组的儿童中枢神经系统发育快速,提示CwG与高热惊厥相似,不成熟大脑对惊厥的发生起着一定的作用,增加了易患性[19]。但不同于高热惊厥,CwG的发生不伴有高热。同时,CwG也与癫痫不同,主要表现为:(1)CwG无人类癫痫的共性,即癫痫的两个特征(脑电图上的痫样放电和癫痫的临床发作)。近年来,暂无CwG患儿脑电图出现痫样放电的报道。(2)虽然CwG患儿的惊厥发作同样具有发作性、短暂性、重复性,但其重复在胃肠炎病程中出现,且不具有刻板性,发作过程中可以出现发作形式的改变,同一个患者同一病程中可出现不同形式的惊厥发作。
3CwG的临床特征
在1995年Komori等[33]定义了CwG的特征:(1)既往健康的6个月至3岁婴幼儿在冬季的病毒性胃肠炎病程的第1天到第5天发生无热的短暂全身强直-阵挛性抽搐;(2)轻度脱水(脱水<5%);(3)惊厥趋向于数天内重复发作;(4)发作间期脑电图无痫样放电;(5)常可检测出大便轮状病毒抗原;(6)其他实验室检查正常,包括脑脊液、血清电解质、血糖;(7)良好的预后。
3.1CwG的一般特征有学者统计CwG占同时期腹泻患儿的2.5~3.0%[7,33]。外文文献366例患儿中男孩162例、女孩204例,男女比为4∶5,发病年龄5~60个月(平均17.89个月),其中高峰期在1~2岁[3-12]。Hung等[3]报道的差异最大的男女比例为1∶1.5(16∶24),提示女孩较男孩更易发生CwG,其原因可能与样本量较少有关。本文所纳入文献中患儿在发病过程中均有胃肠炎表现,但不严重,均为急性起病,以腹泻为主,每日有3~7次水样或稀水样便,多的有10余次,部分伴有呕吐,但不伴有高热(体温≤38 ℃)、严重脱水(体液损失<5%)及低钙、低钠、低血糖、酸中毒等[3-12]。
3.2CwG轻度胃肠炎的特征及其与惊厥发作的关系6篇文献[3,6,8-11]详细地描述了胃肠炎与惊厥发作的时间关系,在277例患儿中,大部分患儿惊厥发作在胃肠炎表现出现之后,主要集中在前3 d,分别为第1天52例(18.77%)、第2天60例(21.66%)、第3天81例(29.24%),共占患儿的69.67%;11例(3.97%)患儿惊厥发作在胃肠炎表现之前12~24 h;24例(8.66%)患儿惊厥发作在胃肠炎表现出现的4 d后。
3.3CwG的临床表现CwG患儿惊厥可为单次发作,但大多数有多次发作,本文10篇文献[3-12]报道了366例患儿的惊厥发作次数(见表1),其中133例(36.34%)有1次惊厥发作,163例(44.54%)有2次惊厥发作,36例(9.84%)有3次惊厥发作,34例(9.29%)有3次惊厥发作,惊厥发作次数最多的有20次[6]。CwG患儿惊厥发作持续时间较短暂,7篇文献[6-12]共273例患儿按持续时间<5 min、5~30 min、>30 min时间段分类,其中232例(84.98%)患儿的惊厥发作持续时间<5 min,35例(12.82%)患儿的惊厥发作持续时间在5~30 min,6例(2.20%)患儿的惊厥发作持续时间>30 min,提示绝大多数患儿的惊厥发作持续时间较短。
惊厥的表现基本为全身强直-阵挛发作。366例患儿共发生了508次惊厥[3-12],其中全身强直-阵挛发作占92.13%(468/508),另7.87%(40/508)为部分发作或复杂性部分发作,如双目凝视、半身发作、失神发作等。有学者报道了发作形式的转变,可见局部发作发展转为全身发作,例如双目左侧凝视变为全身强直-阵挛发作,表明同一患儿在一次病程中多次惊厥可有不同的发作形式[6,8]。Hung等[3]对不同年龄段CwG患儿惊厥发作次数进行分析,发现<1岁患儿惊厥发作1.5次,1~2岁患儿惊厥发作2.0次,3岁患儿惊厥发作3.0次,仅1名>3岁的患儿惊厥发作7次,最终得到不同年龄段的惊厥发作次数差异有统计学意义(P=0.036),2岁以上患儿的惊厥发作次数高于2岁以下患儿(P=0.008)。
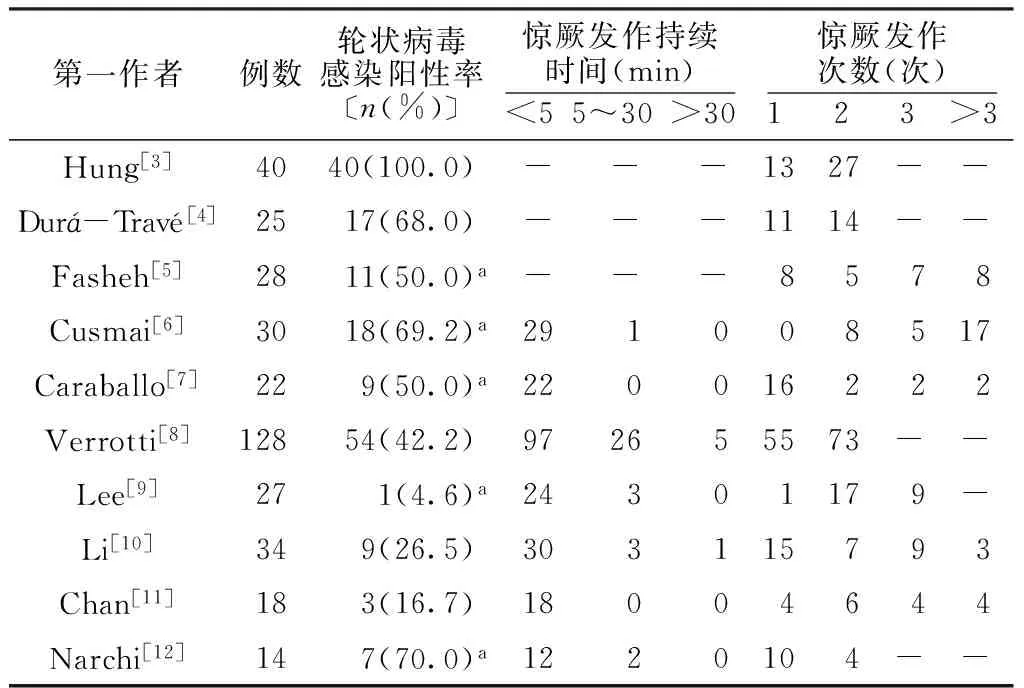
表1 366例CwG患儿的临床表现
注:-表示未按本统计时间划分统计惊厥发作持续时间或发作次数,a表示有失访
4CwG的相关检查
326例患儿中155例完善了颅脑影像学检查,仅2例表现异常[4-12],Li等[10]报道的1例颞叶颅脑间隙扩大和1例为半卵圆中心T2W1低信号。
大部分患儿脑电图结果正常,342例患儿进行了脑电图检测,69例(20.18%)有异常[3-12]。Verrotti等[8]记录了9例患儿发作时的脑电图,其中4例起源于额部,3例起源于顶部,2例起源于枕部,后有6例逐渐泛化到全脑。例如1例部分惊厥发作持续时间为2 min的患儿,记录了从右额部开始的放电在25 s后停止,之后一个独立的惊厥发作时异常波形从左额部开始,随后包含了顶部和整个左半球[8]。并记录了惊厥形式转变和脑电图联系,如记录了1例惊厥发作持续时间为195 s的23个月的患儿的继发性全身的局灶性癫痫发作的整个过程[8],与其右手猛然阵挛相关的左中央-顶部有明显的局部异常放电,在惊厥开始后20 s出现了四肢阵挛脑电图为全脑的异常放电,在惊厥结束时有顶-枕部的局部放电出现。脑电图异常的患儿在随访过程中复查脑电图均恢复正常。
5CwG的药物控制
常用的控制惊厥发作的药物地西泮不推荐应用在CwG。Tanabe等[34]使用静脉或栓剂地西泮(0.27~0.55 mg/kg,平均0.43 mg/kg)治疗16例患儿,仅2例惊厥发作得到了控制,14例惊厥发作未得到控制者中3例患儿再次使用地西泮惊厥发作仍未得到控制。Okumura等[35]使用地西泮治疗11例患儿,其中7例复发惊厥。Kawashima等[31]使用地西泮治疗9例患儿,其中仅2例惊厥发作得到有效控制。
目前,日本研究较多的有效控制CwG发作的药物为利多卡因[34-35]。Okumura等[35]的研究中,作为一线药物或二线药物的利多卡因(1~2 mg·kg-1·h-1持续24~48 h)均有效控制了患儿的惊厥发作。Tanabe等[34]也认为,利多卡因(36 mg胶带贴或静脉注射1 mg·kg-1·h-1)控制惊厥发作是有效的。
Ichiyama等[24]认为,有效治疗CwG的药物是卡马西平,其膜稳定作用能降低神经细胞膜对Na+和Ca2+的通透性,从而降低细胞兴奋性,延长不应期,其用低剂量卡马西平(5 mg·kg-1·d-1)控制惊厥发作的有效率为93.7%(15/16)。此外,Enoki等[36]用单一剂量水合氯醛栓剂(33.8~62.5 mg/kg,平均48.7 mg/kg)治疗10例患儿惊厥发作均有效,并推荐使用≥40 mg/kg的足够剂量的水合氯醛控制惊厥发作。Abe等[17]认为,高剂量苯巴比妥能控制惊厥发作。
6CwG的预防及预后
据最近一项研究报道,在美国,接种完整轮状病毒疫苗的患儿在一年内的惊厥发作次数显著减少[37],提示轮状病毒疫苗可以通过预防轮状病毒感染减少CwG的发生。
10篇文献[3-12]的平均随访时间均>1年,最长达4.5年,大部分患儿预后良好,16例患儿复发CwG,12例发生高热惊厥,值得注意的是3例发展为癫痫,3例神经发育落后,临床均表现为语言发育落后。
1982年,日本Morooka[1]首次报道轻度病毒性胃肠炎可能引发无热惊厥,而不伴有严重脱水、电解质紊乱、低血糖。最近几年,有关CwG的报道和研究逐渐增多,如中国、日本、韩国、意大利、英国、美国、西班牙、阿根廷等[3-12,13-20]。
7小结
综上所述,治疗CwG的重点主要在于对惊厥发作的控制,维持惊厥不再发作及对症治疗。目前,推荐使用小剂量利多卡因或卡马西平控制惊厥发作,但仍无统一标准,还需要进一步纳入样本量较多的随机对照研究来阐明最好的药物治疗。CwG的病因尚不明确,有多种可能,如病毒感染等,近年来基因、细胞、递质等方面的研究逐渐增加,但未出现突破性结果,今后仍有待进一步研究。
作者贡献:王佩佩进行资料收集整理、撰写论文、成文并对文章负责;赵玲玲进行质量控制及审校。
本文无利益冲突。
参考文献
[1]Morooka K.Convulsions and mild diarrhea [J].Shonika(Tokyo),1982,23(2):131-137.
[2]Uemura N,Okumura A,Negoro T,et al.Clinical features of benign convulsions with mild gastroenteritis[J].Brain Dev,2002,24(8):745-749.
[3]Hung JJ,Wen HY,Yen MH,et al.Rotavirus gastroenteritis associated with afebrile convulsion in children:clinical analysis of 40 cases[J].Chang Gung Med J,2003,26(9):654-659.
[4]Durá-Travé T,Yoldi-Petri ME,Gallinas-Victoriano F,et al.Infantile convulsions with mild gastroenteritis:a retrospective study of 25 patients[J].Eur J Neurol,2011,18(2):273-278.
[5]Fasheh Youssef W,Pino Ramírez R,Campistol Plana J,et al.Benign afebrile convulsions in the course of mild acute gastroenteritis[J].Pediatr Emerg Care,2011,27(11):1062-1064.
[6]Cusmai R,Jocic-Jakubi B,Cantonetti L,et al.Convulsions associated with gastroenteritis in the spectrum of benign focal epilepsies in infancy:30 cases including four cases with ictal EEG recording[J].Epileptic Disord,2010,12(4):255-261.
[8]Verrotti A,Nanni G,Agostinelli S,et al.Benign convulsions associated with mild gastroenteritis:a multicenter clinical study[J].Epilepsy Res,2011,93(2/3):107-114.
[9]Lee EH,Chung S.A comparative study of febrile and afebrile seizures associated with mild gastroenteritis[J].Brain Dev,2013,35(7):636-640.
[10]Li T,Hong S,Peng X,et al.Benign infantile convulsions associated with mild gastroenteritis:an electroclinical study of 34 patients[J].Seizure,2014,23(1):16-19.
[11]Chan CM,Chan CW,Ma CK,et al.Norovirus as cause of benign convulsion associated with gastro-enteritis[J].J Paediatr Child Health,2011,47(6):373-377.
[12]Narchi H.Benign afebrile cluster convulsions with gastroenteritis:an observational study[J].BMC Pediatr,2004(4):2.
[13]Sugata K,Taniguchi K,Yui A,et al.Analysis of rotavirus antigenemia and extraintestinal manifestations in children with rotavirus gastroenteritis[J].Pediatrics,2008,122(2):392-397.
[14]Liu B,Fujita Y,Arakawa C,et al.Detection of rotavirus RNA and antigens in serum and cerebrospinal fluid samples from diarrheic children with seizures[J].Jpn J Infect Dis,2009,62(4):279-283.
[15]Chen SY,Tsai CN,Lai MW,et al.Norovirus infection as a cause of diarrhea-associated benign infantile seizures[J].Clin Infect Dis,2009,48(7):849-855.
[16]Kawano G,Oshige K,Syutou S,et al.Benign infantile convulsions associated with mild gastroenteritis:a retrospective study of 39 cases including virological tests and efficacy of anticonvulsants[J].Brain Dev,2007,29(10):617-622.
[17]Abe T,Kobayashi M,Araki K,et al.Infantile convulsions with mild gastroenteritis[J].Brain Dev,2000,22(5):301-306.
[18]Sakai Y,Kira R,Torisu H,et al.Benign convulsion with mild gastroenteritis and benign familial infantile seizure[J].Epilepsy Res,2006,68(3):269-271.
[19]Motoyama M,Ichiyama T,Matsushige T, et al.Clinical characteristics of benign convulsions with rotavirus gastroenteritis[J].J Child Neurol,2009,24(5):557-561.
[20]Matsufuji H,Ichiyama T,Isumi H,et al.Low-dose carbamazepine therapy for benign infantile convulsions[J].Brain Dev,2005,27(8):554-557.
[21]Weng WC,Hirose S,Lee WT.Benign convulsions with mild gastroenteritis:is it associated with sodium channel gene SCN1A mutation [J].J Child Neurol,2010,25(12):1521-1524.
[22]Ishii A,Yasumoto S,Ihara Y,et al.Genetic analysis of PRRT2 for benign infantile epilepsy,infantile convulsions with choreoathetosis syndrome,and benign convulsions with mild gastroenteritis[J].Brain Dev,2013,35(6):524-530.
[23]Ishii A,Fukuma G,Uehara A,et al.A de novo KCNQ2 mutation detected in non-familial benign neonatal convulsions [J].Brain Dev,2009,31(1):27-33.
[24]Ichiyama T,Matsufuji H,Suenaga N,et al.Low-dose therapy with carbamazepine for convulsions associated with mild gastroenteritis[J].No To Hattatsu,2005,37(6):493-497.
[25]Specchio N,Terracciano A,Trivisano M,et al.PRRT2 is mutated in familial and non-familial benign infantile seizures[J].Eur J Paediatr Neurol,2013,17(1):77-81.
[26]Labate A,Tarantino P,Palamara G,et al.Mutations in PRRT2 result in familial infantile seizures with heterogeneous phenotypes including febrile convulsions and probable SUDEP[J].Epilepsy Res,2013,104(3):280-284.
[27]Díaz Y,Chemello ME,Pea F,et al.Expression of nonstructural rotavirus protein NSP4 mimics Ca2+homeostasis changes induced by rotavirus infection in cultured cells[J].J Virol,2008,82(22):11331-11343.
[28]Ruiz MC,Cohen J,Michelangeli F.Role of Ca2+in the replication and pathogenesis of rotavirus and other viral infections[J].Cell Calcium,2000,28(3):137-149.
[29]Tian P,Ball JM,Zeng CQ,et al.The rotavirus nonstructural glycoprotein NSP4 possesses membrane destabilization activity[J].J Virol,1996,70(10):6973-6981.
[30]Yeom JS,Kim YS,Park JS,et al.Role of Ca2+homeostasis disruption in rotavirus-associated seizures[J].J Child Neurol,2014,29(3):331-335.
[31]Kawashima H,Inage Y,Ogihara M,et al.Serumand cerebrospinal fluid nitrite/nitrate levels in patientswith rotavirus gastroenteritis induced convulsion[J].Life Sci,2004,74(11):1397-1405.
[32]Rodríguez-Díaz J,Banasaz M,Istrate C,et al.Role of nitric oxide during rotavirus infection[J].J Med Viro,2006,78(7):979-985.
[33]Komori H,Wada M,Eto M,et al.Benign convulsions with mild gastroenteritis:a report of 10 recent cases detailing clinical varieties[J].Brain Dev,1995,17(5):334-337.
[34]Tanabe T,Okumura A,Komatsu M,et al.Clinical trial of minimal treatment for clustering seizures in cases of convulsions with mild gastroenteritis[J].Brain Dev,2011,33(2):120-124.
[35]Okumura A,Uemura N,Negoro T,et al.Efficacy of antiepileptic drugs in patients with benign convulsions with mild gastroenteritis[J].Brain Dev,2004,26(3):164-167.
[36]Enoki H,Yokota T,Nagasaki R,et al.Single-dose chloral hydrate for benign convulsions with mild gastroenteritis[J].Epilepsia,2007,48(5):1026-1028.
[37]Payne DC,Baggs J,Zerr DM,et al.Protective association between rotavirus vaccination and childhood seizures in the year following vaccination in US children[J].Clin Infect Dis,2014,58(2):173-177.
(本文编辑:李婷婷)
Current Research Status of Benign Convulsions With Mild Gastroenteritis
WANGPei-pei,ZHAOLing-ling.
DepartmentofPediatrics,theThirdXiangyaHospitalofCentralSouthUniversity,Changsha410013,China
【Abstract】Benign convulsions with mild gastroenteritis(CwG)is a transient performance occurring in the course of infant diarrhea after gastrointestinal tract infections.Several seizures usually occur in one course,with short duration.The manifestation of gastroenteritis is not severe and is not complicated with severe dehydration and electrolyte disturbance.Its prognosis is good in most cases.In recent years,the research of CwG usually focuses on the pathogenetic mechanism and effective control of convulsion.The study made a review of the status of research on CwG.The focus of CwG treatment now is the control on seizures,so we recommended the usage of small dosage of lidocaine or carbamazepine for the control of seizures.However,random control studies with larger sample volume should be included to define the optimum medication,for there is no uniform standard yet.Besides,the pathogenesis of CwG is still unclear;despite the increase of relevant studies,no breakthroughs appeared,thus further studies are needed.Improving the understanding of CwG is of significant importance in avoiding excessive assessment and unnecessary application of anti-epilepsy drugs and relieving the worry of family members for long-term complications.
【Key words】Gastroenteritis;Convulsions;Infants
通信作者:赵玲玲,410013湖南省长沙市,中南大学湘雅三医院儿科;E-mail:llzhao2011@qq.com
【中图分类号】R 573.3
【文献标识码】A
doi:10.3969/j.issn.1007-9572.2016.18.022
(收稿日期:2015-10-29;修回日期:2016-02-26)



