张 瑾,陈 薇,刘 蕾
·标准·方案·指南·
2017年《NCCN乳腺癌筛查和诊断临床实践指南》(第1版)更新与解读
张 瑾*,陈 薇,刘 蕾
2017年《美国国家综合癌症网络(NCCN)乳腺癌筛查和诊断临床实践指南》(第1版)更新涉及病史采集和体格检查、乳腺X线检查、超声检查在乳腺癌筛查与诊断中的应用、乳腺磁共振成像(MRI)检查、Gail 乳腺癌风险评估模型测评工具、穿刺与活检等诸多方面。我国与西方国家基层医疗机构在设备应用和诊疗水平方面存在很大差距,因此应结合我国国情,建立适合中国女性的乳腺癌高危人群筛查模型和评估系统,为我国乳腺癌早期发现提供指导依据。
乳腺肿瘤;指南;筛查;诊断
张瑾,陈薇,刘蕾.2017年《NCCN乳腺癌筛查和诊断临床实践指南》(第1版)更新与解读[J].中国全科医学,2017,20(24):2939-2943.[www.chinagp.net]
ZHANG J,CHEN W,LIU L.Updates and interpretations of theNationalComprehensiveCancerNetworkGuidelinesforBreastCancerScreeningandDiagnosis(version 1,2017) [J].Chinese General Practice,2017,20(24):2939-2943.
美国国家综合癌症网络(NCCN)公布的《NCCN乳腺癌临床实践指南》于2006年首次引入中国。根据最新研究进展,美国多学科专家团队于2017-06-02在线发表具有规范化指导意义的2017年《NCCN乳腺癌筛查和诊断临床实践指南》(第1版)(以下简称《指南》)[1]。尽管我国与西方国家在乳腺癌患者临床特点及病理特征、医疗体制等诸多方面存在差异,但该《指南》仍为我国乳腺癌临床诊治过程提供了重要参考依据。本文结合2017年《指南》更新内容及热点问题进行介绍和解读。
1 2017年《指南》更新内容
2017年《指南》更新内容涉及病史采集和体格检查、乳腺X线检查、超声检查在乳腺癌筛查与诊断中的应用、乳腺磁共振成像(MRI)检查、Gail乳腺癌风险评估模型测评工具、穿刺与活检等诸多方面,详见表1。
2 2017年《指南》更新内容解读
2.1 病史采集和体格检查 2017年《指南》强调病史、家族史、临床查体的重要性,推荐体格检查中增加病史及家族史询问,同时乳腺临床查体应贯穿于风险评估、降低乳腺癌风险遗传咨询过程中。要求临床乳腺查体应分别进行立位和仰卧位的视诊与触诊,以发现乳房细微的形状或轮廓改变,触诊应包括整个乳房、腋窝及锁骨区域淋巴结。重视乳房及淋巴结查体可协助影像学医生确认病灶位置并快速做出判断。2017年《指南》对家族史尤为重视,一级亲属患乳腺癌的例数应作为危险因素进行评估。2017年《指南》认为乳腺自检不能降低乳腺癌的检出率和病死率。一项纳入266 064名妇女的随机临床研究证实乳房自检不会降低乳腺癌病死率,但规范乳腺查体有助于发现乳腺良性病灶[2]。尽管如此,2017年《指南》仍认为提高女性乳腺自我保护意识,有助于发现常规筛查的乳腺癌。《中国抗癌协会乳腺癌诊治指南与规范(2015版)》[3]同样认为乳腺自检不能提高乳腺癌早期检出率和降低病死率。笔者认为基层医务工作者应结合中国国情,积极向社区女性传授乳腺自检的方法以及常见乳腺疾病知识,提高女性的乳房自我健康保护意识及防癌意识,同时进行基层医务工作者培训,规范临床乳腺查体方法,这对提高乳腺癌早期诊断有积极意义。
2.2 乳腺X线检查 乳腺X线检查已广泛应用于40岁以上女性乳腺癌筛查,是迄今唯一已被证实可以降低乳腺癌病死率的筛查方法。乳腺X线检查尚未进行年龄限定,对于20~40岁的女性,若无症状、临床乳腺查体阴性、无高危因素,建议每1~3年行临床乳腺查体并提高其乳房自我健康保护意识,不建议行乳腺X线检查。韩国的一项对国内外乳腺癌筛查的荟萃分析建议,对于40~69岁妇女每2年进行1次乳腺X线检查[4]。然而,乳腺X线检查存在辐射暴露、过度诊断、假阳性结果、不必要的活检及手术等缺点。研究者认为医生应充分告知患者乳腺X线检查的必要性以及可能出现的问题,权衡利弊,在提供专业建议后由患者选择是否接受乳腺X线检查[5]。

表1 2017年《NCCN乳腺癌筛查和诊断临床实践指南》(第1版)更新内容
在美国,数字化钼靶摄影技术因其便于计算机储存及处理电子图像,完全取代了专用屏片乳腺摄影的应用。一项纳入45 928名妇女的对比研究发现两种检查方法的总正确率无差异[6]。数字化钼靶摄影技术对青年女性及致密型乳腺的检查正确率显著高于专用屏片乳腺摄影,但对于65岁以上的老年女性其并不能提高诊断正确率[7]。另一项研究结果显示,对于45~69岁患者,数字化钼靶摄影技术筛查乳腺癌的正确率高[6]。同时2017年《指南》中提供了第5版钼靶报告诊断分级方法。
2017年《指南》中提到2D数字钼靶摄影联合数字乳腺断层合成技术(DBT) 可降低乳腺癌诊断假阳性率,提高诊断正确率[7-8]。利用DBT构建三维立体图像可协助乳腺癌诊断。尽管两项乳腺X线技术联合应用会使患者承受双倍辐射剂量,但仍显著低于美国食品药品监督管理局规定的数字钼靶辐射剂量。多项研究结果显示,DBT优势在于通过数字化电脑合成2D图像,有效避免2D数字钼靶摄影重复应用,显著降低辐射剂量,可替代其他乳腺X线技术[9-11]。
笔者认为应首先建立适合中国女性的乳腺癌高危人群筛查模型,对模型筛选出的高危人群进行乳腺X线检查、DBT,在提高检出率的同时,减少乳腺X线检查给乳腺癌低危女性带来的辐射暴露及经济负担。
2.3 超声检查在乳腺癌筛查和诊断中的应用 一项前瞻性研究结果显示,对于致密型乳腺和乳腺癌高危女性,单一钼靶检查诊断乳腺癌的灵敏度为50.0%,而超声检查联合钼靶检查的灵敏度为77.5%;针对该类型女性行超声检查联合钼靶检查,与单一钼靶检查结果相比,每1 000例女性乳腺癌检出率增加4.3例,这可能与钼靶检查对于致密型乳腺微小病灶观察度有限相关,但同时也增加假阳性结果[12]。尽管大量研究结果显示,超声检查作为钼靶检查的辅助手段可提高乳腺癌检出率[13-15],但2017年《指南》仍未将超声检查列为乳腺癌辅助筛查方法,即使对于乳腺癌高危女性,仍仅建议进行乳腺钼靶检查和乳腺MRI检查,并未推荐进行超声检查。超声检查仅在以下情况被推荐应用:(1)实性肿块、复杂型囊肿;(2)年龄<30岁,持续性、自发性、单侧、单导管、血性、浆液血性乳头溢液;(3)年龄<30岁,乳腺肿块、腺体非对称性增厚或结节、乳腺皮肤改变(炎性乳腺癌、乳腺Paget病);(4)年龄≥30岁,乳腺肿块、腺体非对称性增厚或结节、乳腺皮肤改变(炎性乳腺癌、乳腺Paget病),持续性、自发性、单侧、单导管、血性、浆液血性乳头溢液。在以上情况下,超声检查可作为乳腺X线检查的辅助手段。
中国女性乳腺组织普遍较为致密,与西方国家女性相比,中国女性乳腺癌发病年龄高峰较靠前,多集中在40~49岁,绝经前患者比例高[16]。对于乳腺组织密度低尤其是绝经后女性的乳腺,乳腺X线检查能清晰显示各层组织,发现微小钙化点及簇状钙化,但对于绝经前的致密型乳腺患者的乳腺癌病灶显像水平较差。因此根据上述特点,乳腺癌筛查起始年龄应当提前,超声检查可作为乳腺癌筛查的辅助手段。结合中国女性乳腺特点,笔者认为应适当区别于国外指南标准,重新定义超声检查在中国女性乳腺癌筛查中的重要性,按照乳腺影像报告和数据系统(BI-RADS)分类内容,规范乳腺癌超声检查诊断标准,尽量做出适当的影像学诊断。
2.4 乳腺MRI检查 2017年《指南》对比了乳腺X线检查与乳腺MRI检查,发现乳腺MRI检查诊断乳腺癌的灵敏度高、特异度低,导致部分假阳性结果,并且不易发现微小钙化灶[17-18]。目前尚未发现应用乳腺MRI检查进行乳腺癌筛查能够延长患者的生存期,也未见循证医学证据支持在普通人群中利用乳腺MRI检查进行乳腺癌筛查。美国癌症学会(ACS)和NCCN指南共同推荐在高危人群中将乳腺MRI检查作为钼靶检查的辅助筛查方法。2017年《指南》乳腺MRI检查建议见表2。
当乳腺X线检查或超声检查不能确定病变性质时,可考虑进一步行乳腺MRI检查,以提高早期乳腺癌检出率。乳腺MRI检查的优势在于能显示多病灶、多中心或双侧乳腺癌病灶,为制订手术方案提供更可靠的依据,并能同时显示肿瘤与胸壁的关系、腋窝淋巴结转移情况等,对拟行保乳术患者提供影像学参考依据。其优越性还表现在对软组织分辨力高,对致密型乳腺组织、乳腺邻近组织侵犯显示较好,动态增强扫描有助于区分病灶良恶性,因此尽管存在检查时间长、费用昂贵、对导管内原位癌及微小钙化灶常不能检出等缺点,2017年《指南》仍建议针对乳腺癌高危女性行乳腺MRI检查,合理利用影像学检查资源。
2.5 Gail 乳腺癌风险评估模型测评工具 Gail乳腺癌风险评估模型测评工具是美国国家癌症研究所(NCI)和美国乳腺癌与肠癌外科辅助治疗研究组(NSABP)基于 Gail乳腺癌风险评估的统计模型。应用该测评工具有助于筛查浸润性乳腺癌高风险女性。Gail乳腺癌风险评估模型测评工具评估乳腺癌患病风险的高危因素包括:(1)筛查时年龄;(2)月经初潮年龄;(3)初次分娩年龄;(4)一级亲属乳腺癌患者例数;(5)既往良性乳腺病灶数目;(6)既往乳腺组织活检中是否存在非典型性增生;(7)种族(此模型适用于高加索、亚裔、非裔美国人种)。Gail 乳腺癌风险评估模型测评工具不适用于携带乳腺癌易感基因突变、乳腺癌或卵巢癌家族史、既往接受过胸部放射治疗以及小叶原位癌患者评估乳腺癌患病风险。
表2 2017年《NCCN乳腺癌筛查和诊断临床实践指南》中关于乳腺MRI检查应用的建议
Table 2 Recommendations for the application of breast MRI in theNationalComprehensiveCancerNetworkGuidelinesforBreastCancerScreeningandDiagnosis(version 1,2017)
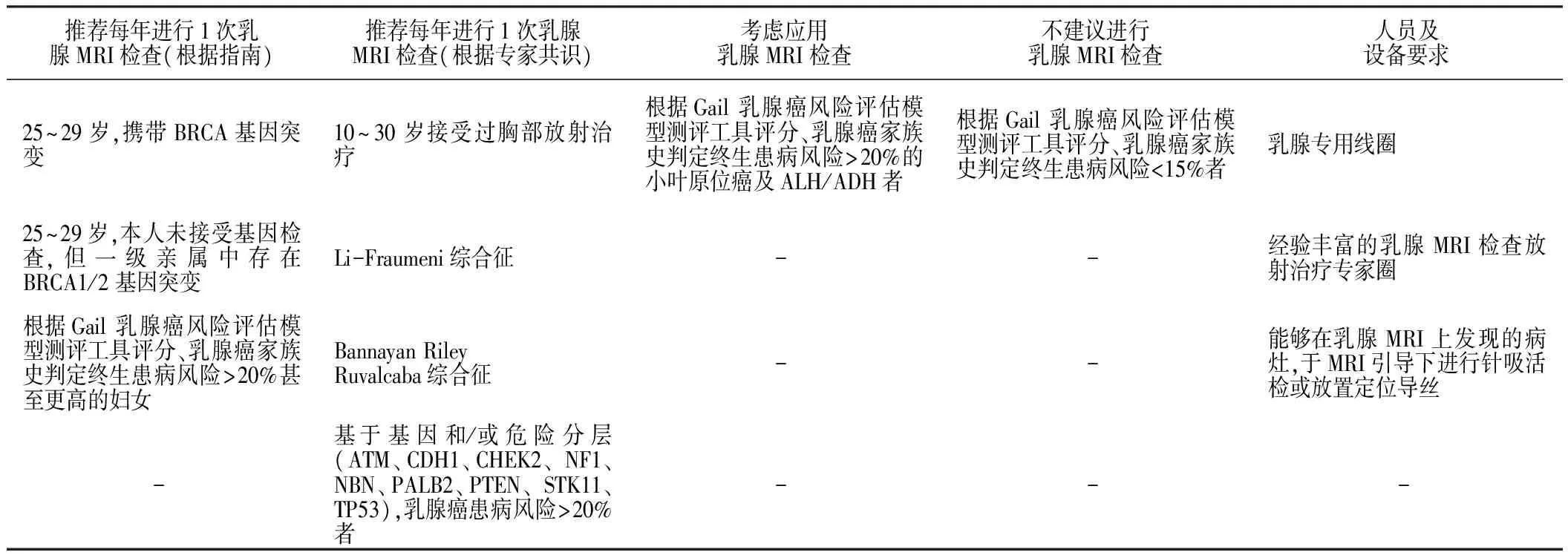
推荐每年进行1次乳腺MRI检查(根据指南)推荐每年进行1次乳腺MRI检查(根据专家共识)考虑应用乳腺MRI检查不建议进行乳腺MRI检查人员及设备要求25~29岁,携带BRCA基因突变10~30岁接受过胸部放射治疗根据Gail乳腺癌风险评估模型测评工具评分、乳腺癌家族史判定终生患病风险>20%的小叶原位癌及ALH/ADH者根据Gail乳腺癌风险评估模型测评工具评分、乳腺癌家族史判定终生患病风险<15%者乳腺专用线圈25~29岁,本人未接受基因检查,但一级亲属中存在BRCA1/2基因突变Li-Fraumeni综合征 - -经验丰富的乳腺MRI检查放射治疗专家圈根据Gail乳腺癌风险评估模型测评工具评分、乳腺癌家族史判定终生患病风险>20%甚至更高的妇女BannayanRileyRuvalcaba综合征 - -能够在乳腺MRI上发现的病灶,于MRI引导下进行针吸活检或放置定位导丝 -基于基因和/或危险分层(ATM、CDH1、CHEK2、NF1、NBN、PALB2、PTEN、STK11、TP53),乳腺癌患病风险>20%者 - - -
注:-表示无此项
根据高危因素评估女性可能患乳腺癌的风险,进而对高危女性积极采取预防措施,开展乳腺癌风险评估与预测的研究具有现实意义。Gail乳腺癌风险评估模型测评工具在欧美国家广泛应用,其正确率得到了充分验证[19-21]。但是 KHAZAEE-POOL[22]等回顾性分析评价 Gail乳腺癌风险评估模型测评工具在印度222名女性中的预测作用,结果提示该模型不适用于印度女性。另外,CHAY等[23]的前瞻性研究纳入了28 104名新加坡女性,评价 Gail 乳腺癌风险评估模型测评工具预测乳腺癌的价值,结果显示Gail 乳腺癌风险评估模型测评工具过高估计所有年龄组的乳腺癌风险,以60~64岁老年妇女组的差异最大,可能与当地乳腺癌发病率较低及乳腺X线检查普及率低等多种因素相关,提示 Gail乳腺癌风险评估模型测评工具存在地域限制。笔者认为中国女性由于种族、居住环境、生活习惯等方面与欧美国家女性存在较大差异,所以Gail乳腺癌风险评估模型测评工具是否适用于我国女性还需要进一步验证。
2.6 穿刺与活检 细针穿刺活检具有创伤较小和价格低等优势,但其需要由有经验的病理学专家诊断,有细针穿刺活检结果的情况下,如需要鉴别非典型性增生和恶性病变时仍需再次进行粗针穿刺活检。虽然可在超声检查等影像学引导下对未触及肿块病变进行细针穿刺活检,但仍有研究表明组织切除活检和粗针穿刺活检诊断乳腺癌的正确率更高[24]。粗针穿刺活检可获得足够组织样本量,并具有可在乳腺X线检查、超声检查或MRI引导下进行穿刺活检等优点,超声引导下粗针穿刺活检诊断乳腺癌的灵敏度高达97%~99%[25]。除少数情况外,2017年《指南》推荐术前均应进行粗针穿刺活检以明确病理诊断。在进行粗针穿刺活检后,以下情况推荐进行开放活检:(1)经粗针穿刺活检仍未明确诊断的病灶;(2)非典型增生和小叶原位癌;(3)穿刺活检组织病理诊断为良性,但影像学诊断不支持;(4)分泌黏液的病灶、潜在分叶状肿瘤、乳头状病变、放射状瘢痕以及其他病理学专家认为需要进一步取材的病理类型的病变。
近年来,不可触及肿块的乳腺癌患者数量逐渐增多,影像学引导下的乳腺微创活检显得尤为重要。笔者认为根据中国国情,在有条件的大型医院,可以根据2017年《指南》进行乳腺微创活检。基层医务工作者应充分了解乳腺穿刺活检适应证,基层医院应增加相应设备,在影像学引导下进行穿刺活检或组织切除活检,降低假阴性率。
3 小结
2017年《指南》先介绍详尽的病史采集和细致的体格检查,然后根据年龄段及症状推荐采取相应检查,利用Gail乳腺癌风险评估模型测评工具进行风险评估,对于乳腺癌高危人群行乳腺MRI检查,并根据检查结果进行随访或采取进一步措施(超声、穿刺、活检),其整体思路明确,可操作性强,为中国医疗工作者提供重要参考依据。但在临床工作中仍应结合中国国情,建立适合中国女性的乳腺癌高危人群筛查模型和评估系统,积极进行乳腺癌筛查,增加乳腺癌早期检出率。
作者贡献:陈薇、刘蕾进行论文撰写,论文修改并对文章负责;张瑾指导论文撰写与修改,进行质量控制及审校。
本文无利益冲突。
[1] National Comprehensive Cancer Network.NCCN Clinical Practice Guidelines in Oncology:breast cancer screening and diagnosis.version 1.2017[EB/OL].(2017-06-02)[2017-07-15].https://www.nccn.org/professionals/physician_gls/pdf/breast-screening.pdf.
[2]THOMAS D B,GAO D L,RAY R M,et al.Randomized trial of breast selfexamination in Shanghai:final results[J].J Natl Cancer Inst,2002,94(19):1445-1457.
[3]中国抗癌协会乳腺癌专业委员会.中国抗癌协会乳腺癌诊治指南与规范(2015版)[J].中国癌症杂志,2015,25(9):692-754.
[4]LEE K,KIM H,LEE J H,et al.Retrospective observation on contribution and limitations of screening for breast cancer with mammography in Korea:detection rate of breast cancer and incidence rate of interval cancer of the breast[J].BMC Womens Health,2016,16(1):72.DOI:10.1186/s12905-016-0351-1.
[5]BLEYER A,WELCH H G.Effect of three decades of screening mammography on breast-cancer incidence[J].N Engl J Med,2012,367(21):1998-2005.DOI:10.1056/NEJMoa1206809.
[6]PISANO E D,GATSONIS C,HENDRICK E,et al.Diagnostic performance of digital versus film mammography for breast-cancer screening[J].N Engl J Med,2005,353(17):1773-1783.DOI:10.1056/NEJMoa052911.
[7]PISANO E D,HENDRICK R E,YAFFE M J,et al.Diagnostic accuracy of digital versus film mammography:exploratory analysis of selected population subgroups in DMIST[J].Radiology,2008,246(2):376-383.DOI:10.1148/radiol.2461070200.
[8]SKAANE P,HOFVIND S,SKJENNALD A.Randomized trial of screen-film versus full-field digital mammography with soft-copy reading in population-based screening program:follow-up and final results of Oslo Ⅱ study[J].Radiology,2007,244(3):708-717.DOI:10.1148/radiol.2443061478.
[9]SKAANE P,BANDOS A I,GULLIEN R,et al.Comparison of digital mammography alone and digital mammography plus tomosynthesis in a population-based screening program[J].Radiology,2013,267(1):47-56.DOI:10.1148/radiol.12121373.
[10]ZUCKERMAN S P,CONANT E F,KELLER B M,et al.Implementation ofsynthesized two-dimensional mammography in a population-baseddigital breast tomosynthesis screening program[J].Radiology,2016,281(30):730-736.DOI:10.1148/radiol.2016160366.
[11]SKAANE P,BANDOS A I,EBEN E B,et al.Two-view digital breasttomosynthesis screening with synthetically reconstructed projectionimages:comparison with digital breast tomosynthesis with full-fielddigital mammographic images[J].Radiology,2014,271(3):655-663.DOI:10.1148/radiol.13131391.
[12]BERG W A,BLUME J D,CORMACK J B,et al.Combined screening withultrasound and mammography vs mammography alone in women atelevated risk of breast[J].JAMA,2008,299(18):2151-2163.DOI:10.1001/jama.299.18.2151.
[13]BERG W A,ZHANG Z,LEHRER D,et al.Detection of breast cancer with addition of annual screening ultrasound or a single screening MRI to mammography in women with elevated breast cancer risk[J].JAMA,2012,307(13):1394-1404.DOI:10.1001/jama.2012.388.
[14]SCHEEL J R,LEE J M,SPRAGUE B L,et al.Screening ultrasound as an adjunct to mammography in women with mammographically dense breasts[J].Am J Obstet Gynecol,2015,212(1):9-17.DOI:10.1016/j.ajog.2014.06.048.
[15]HOOLEY R J,GREENBERG K L,STACKHOUSE R M,et al.Screening US in patients with mammographically dense breasts:initial experience with Connecticut Public Act 09-41[J].Radiology,2012,265(1):59-69.DOI:10.1148/radiol.12120621.
[16]LI J,ZHANG B N,FAN J H,et al.A nation-wide multicenter 10-year(1999-2008) retrospective clinicalepidemiological study of female breast cancer in China[J].BMC Cancer,2011,11:364.DOI:10.1186/1471-2407-11-364.
[17]LORD S J,LEI W,CRAFT P,et al.A systematic review of the effectiveness of magnetic resonance imaging(MRI) as an addition tomammography and ultrasound in screening young women at high risk of breast cancer[J].Eur J Cancer,2007,43(13):1905-1917.DOI:10.1016/j.ejca.2007.06.007.
[18]MANN R M,KUHL C K,KINKEL K,et al.Breast MRI:guidelines from the European Society of Breast Imaging[J].Eur Radiol,2008,18(17):1307-1318.DOI:10.1007/s00330-008-0863-7.
[19]ULUSOY C,KEPENEKCI I,KOSE K,et al.Applicability of the Gail model for breast cancer risk assessment in Turkishfemale population and evaluation of breastfeeding as a risk factor [J].Breast Cancer Res Treat,2010,120(2):419-424.DOI:10.1007/s10549-009-0541-8.
[20]NOVOTNY J,PECEN L,PETRUZELKA L,et al.Breast cancer risk assessment in the Czech female populationan adjustment of the original Gail model[J].Breast Cancer Res Treat,2006,95(1):29-35.DOI:10.1007/s10549-005-9027-5.
[21]DECARLI A,CALZA S,MASALA G,et al.Gail model for prediction of absolute risk of invasive breast cancer:independentevaluation in the Florence-European prospective investigation into cancer andnutrition cohort[J].J Natl Cancer Inst,2006,98(23):1686-1693.DOI:10.1093/jnci/djj463.
[22]KHAZAEE-POOL M,MAJLESSI F,NEDJAT S,et al.Assessing breast cancer risk among Iranian women using the Gail model[J].Asian Pac J Cancer Prev,2016,17(8):3759-3762.
[23]CHAY W Y,ONG W S,TAN P H,et al.Validation of the Gail model for predicting individual breast cancer risk in a prospective nationwide study of 28,104 Singapore women[J].Breast Cancer Res,2012,14(1):R19.DOI:10.1186/bcr3104.
[24]NG A K,GARBER J E,DILLER L R,et al.Prospective study of the efficacy of breast magnetic resonance imaging and mammographic screening in survivors of hodgkin lymphoma[J].J Clin Oncol,2013,31(18):2282-2288.DOI:10.1200/JCO.2012.46.5732.
[25]MANDELBLATT J S,STOUT N K,SCHECHTER C B,et al.Collaborative modeling of the benefits and harms associated with different U.S.breast cancer screening strategies[J].Ann Intern Med,2016,164(4):215-225.DOI:10.7326/M15-1536.
(本文编辑:崔莎)
2017年《NCCN乳腺癌筛查和诊断临床实践指南》(第1版)原文见:https://www.nccn.org/professionals/physician_gls/pdf/breast-screening.pdf.
Updates and Interpretations of theNationalComprehensiveCancerNetworkGuidelinesforBreastCancerScreeningandDiagnosis(Version 1,2017)
ZHANGJin*,CHENWei,LIULei
TheThirdDepartmentofBreastCancer,TianjinMedicalUniversityCancerInstitute&Hospital;NationalClinicalResearchCenterforCancer;BreastCancerPreventionandTreatmentResearchCenterinTianjin,China;KeyLaboratoryofCancerPreventionandTreatmentinTianjin;KeyLaboratoryofCancerPreventionandTreatmentinMinistryofEducation;ClinicalResearchCenterforMalignantTumorinTianjin,Tianjin300060,China*Correspondingauthor:ZHANGJin,Professor,Chiefphysician;E-mail:zhangjin@tjmuch.com
Updates of theNationalComprehensiveCancerNetworkGuidelinesforBreastCancerScreeningandDiagnosis(version 1,2017)involved history-taking and physical examination,mammography,the application of ultrasonography in screening and diagnosis of breast cancer,magnetic resonance imaging of breast,evaluation tool Gail breast cancer risk assessment model,puncture and biopsy and so on.There is a huge gap in the device application and diagnosis and treatment level between China and the western countries of primary health care institutions.Based on the national conditions of our country,we should establish a screening model and evaluation system for high-risk groups of breast cancer for Chinese women,and to provide guidance for the early detection of breast cancer in China.
Breast neoplasms;Guidebooks;Screening;Diagnosis
R 737.9
A
10.3969/j.issn.1007-9572.2017.24.001
2017-07-11;
2017-07-24)
【编者按】 美国国立综合癌症网络(NCCN)每年发布的各种恶性肿瘤临床实践指南得到了全球临床医师的认可和遵循。作为美国21家顶尖肿瘤中心组成的非营利性学术组织,NCCN的宗旨是在全球范围内提高肿瘤服务水平,造福肿瘤患者。乳腺癌是公认的女性健康杀手之一,全球每年新增100多万女性乳腺癌患者,其中至少有40万死于乳腺癌。与其他大多数国家一样,乳腺癌也成为了中国女性最常见的癌症,其发病率和病死率逐年升高。为此,本刊特邀请中国天津乳腺癌防治研究中心常务副主任、天津医科大学肿瘤医院乳腺肿瘤三科科主任、中国抗癌协会乳腺癌专业委员会副主任委员、天津医学会肿瘤分会副主任委员张瑾教授对2017年《NCCN乳腺癌筛查和诊断临床实践指南》(第1版)的更新内容进行解读,以期为我国乳腺癌临床诊治过程提供重要参考依据。
300060天津市,天津医科大学肿瘤医院乳腺肿瘤三科,国家肿瘤临床医学研究中心,中国天津乳腺癌防治研究中心,天津市“肿瘤防治”重点实验室,乳腺癌防治教育部重点实验室,天津市恶性肿瘤临床医学研究中心
*通信作者:张瑾,教授,主任医师;E-mail:zhangjin@tjmuch.com



