鲁欢,汤水福,陈刚毅,苏保林,詹冬香,吴兴波,王超,罗月中
特发性膜性肾病(IMN)是原发性肾小球肾炎的常见病理类型,也是原发性肾病综合征(NS)最常见的原因,占原发性NS的30%~40%[1]。病理诊断为膜性肾病(MN)后,应首先排除继发因素,才可以诊断为IMN[2]。IMN发病率高、影响范围广,可累及不同年龄段、任何种族人群[1,3]。IMN的主要临床表现为NS,自然病程差异较大,虽然30%左右的患者可自发缓解,但30%~50%的患者会进展至肾衰竭[4-5]。患者常因高度水肿影响工作和生活,出现各种严重致残、致死并发症,需进行肾脏替代治疗,给社会、家庭带来沉重负担。IMN在组织学方面与肾小球足细胞受损直接相关。然而,至今仍未发现治疗本病的特效药。本课题组前期研究发现IMN与脾肾阳虚密切相关,应用温阳利水方治疗IMN取得较好效果[6]。足细胞M型磷脂酶A2受体(PLA2R)是成人IMN的靶抗原之一[7-9],血清抗PLA2R(anti-PLA2R)水平与脾肾阳虚IMN存在一定关联[10],为进一步探讨温阳利水方的作用机制,本研究拟采用首次确诊为IMN、血清anti-PLA2R阳性、脾肾阳虚患者的血清,与小鼠永生化足细胞(以下统称足细胞)共孵育,制备足细胞损伤的脾肾阳虚IMN体外模型,观察温阳利水方水提物对损伤小鼠足细胞的保护作用。
1 材料与方法
1.1 诊断标准
1.1.1 西医诊断标准
1.1.1.1 MN的诊断标准 MN是以肾小球基底膜(GBM)上皮细胞下免疫复合物沉积伴GBM弥漫增厚为特征的一组疾病,肾组织免疫荧光特点是以IgG、C3为主沿毛细血管壁颗粒样沉积,可伴有其他免疫球蛋白沉积,但强度较弱[2]。
1.1.1.2 IMN的诊断标准 符合上述MN的诊断标准,且临床上排除系统性红斑狼疮、感染、肿瘤及药物等继发性膜性肾病(SMN)。
1.1.2 中医诊断标准 参照2006年中华中医药学会肾病分会《原发性肾病综合征的诊断、辨证分型及疗效评定(试行方案)》[11]的辨证标准,主症:神疲乏力、或有面浮肢肿、或有畏寒;次症:少气懒言、腰酸身重、或自汗、易感冒;舌:胖、或舌边有齿痕;脉:虚无力(弱、濡、软);符合2项主症和2项次症,参照舌脉,可诊断为脾肾阳虚。
1.2 实验材料
1.2.1 实验细胞 MPC5小鼠足细胞系由美国Baylor医学院Danesh教授惠赠,广东省人民医院史伟教授转赠。
1.2.2 中药 根据《伤寒论》和《中国药典》,温阳利水方由制附子15 g、白术45 g、白芍30 g、茯苓30 g、生姜15 g、黄芪30 g组成,以上药物均购自广州中医药大学第一附属医院中药房。
1.2.3 脾肾阳虚IMN患者和正常人血清 2015年2—3月,选取在广州中医药大学第一附属医院肾病科住院,首次肾穿刺活检确诊为IMN、血清anti-PLA2R阳性、脾肾阳虚的患者28例,采集清晨空腹静脉血。同时间段,采集30例健康志愿者清晨空腹静脉血。本研究遵循伦理学标准,受试者均签署知情同意书,本研究方案通过广州中医药大学第一附属医院伦理委员会审核,完成临床试验透明化注册(ChiCTROCH-14005137)。
1.2.4 实验试剂及仪器 RPMI-1640、Ⅰ型鼠尾胶原(美国Corning Incorporated),澳洲胎牛血清(FBS)、0.05%胰蛋白酶(美国Gibco公司),重组小鼠干扰素γ(INF-γ)(以色列ProSpec),PBS缓冲液(美国Hyclone公司),CCK-8试剂盒(日本Dojindo),多聚甲醛、氢氧化钠、Triton X-100(广州化学试剂厂),Rhodamine Phalloidin(美国 Cytoskeleton),RNA Extraction Kit、PrimeScriptTM RT Master Mix、SYBR® Premix Ex TaqTM Ⅱ( 日 本 Takara),PCR Forward Prime、PCR Reverse Prime(美国 Invitrogen),多通道移液器(德国Eppendorf),高速冷冻离心机(美国SIGMA),CO2培养箱(美国Shellab),加热磁力搅拌器(德国IKA),精密天平、pH计(德国Sartorius),量筒(中国BOMEX公司),多功能酶标仪、微量检测板(美国Thermo Scientific),倒置荧光显微镜(德国Leica),超纯水系统(美国Millipore),电子细胞计数仪、T-100 regular PCR、实时荧光定量PCR仪(美国Bio-Rad)。
1.3 实验方法
1.3.1 P22足细胞培养 MPC5小鼠足细胞复苏后,用含10%FBS的RPMI-1640培养基,1 U/ml重组小鼠INF-γ在5%CO2、33 ℃培养箱诱导增殖4~5 d。提前用Ⅰ型鼠尾胶原包被培养皿。待细胞生长融合至80%~85%,用0.05%胰蛋白酶消化,传代至Ⅰ型鼠尾胶原预包被的培养皿,转入5% CO2、37 ℃培养箱。含10% FBS的RPMI-1640培养基诱导分化8~14 d,分化成熟后进行后续实验。
1.3.2 脾肾阳虚IMN患者和健康志愿者血清制备 具体制备方法见文献[12]。
1.3.3 温阳利水方水提物制备 加6倍量超纯水分别浸泡制附子及其余药物30 min,先煎制附子1 h,后加入其余药物及浸泡液一起煎煮,煮沸后再煎煮40 min,过滤,收集滤液;加4倍量超纯水于上述药渣中再次煎煮,煮沸后再煎煮30 min,过滤,收集滤液。合并滤液,过滤,8 000 r/min离心5 min(离心半径10 cm),过滤,80 ℃下减压,滤液浓缩至浸膏,用超纯水定容至165 ml,即终浓度为1 g/ml。依次过0.45 μm和0.22 μm针头滤器,除颗粒杂质、灭菌。-20 ℃保存备用。
1.3.4 CCK-8试剂盒检测温阳利水方水提物的氧化还原性取96孔板,设RPMI-1640培养基组和RPMI-1640培养基加温阳利水方水提物组,前者每孔添加RPMI-1640培养基100 μl,后者每孔添加RPMI-1640培养基100 μl和温阳利水方水提物10 μl,每组设5个复孔。5% CO2、37 ℃培养箱孵育20 h后,每孔加CCK-8 10 μl,孵育4 h后,酶标仪测定450 nm处吸光度(OD值)。
1.3.5 CCK-8试剂盒检测温阳利水方水提物对足细胞增殖能力的影响 取分化成熟的P22足细胞,同步化24 h后,制备细胞悬液,取10 μl至细胞计数仪计数,以8 000个细胞/孔的密度将细胞悬液接种于96孔板,加入含10%胎牛血清的RPMI-1640培养基补足至100 μl/孔。培养24 h后,每孔加入提前用RPMI-1640培养基稀释至相应浓度的温阳利水方水提 物 10 μl, 设 0、1、2、4、8、10、20、40、60、80、100 mg/ml温阳利水方水提物组共11组,每组设5个复孔。5%CO2、37 ℃培养箱孵育20 h后,每孔加CCK-8 10 μl,孵育4 h后,酶标仪测定450 nm处OD值。不含细胞的完全培养基空白孔调零。
1.3.6 制备体外模拟足细胞损伤的IMN脾肾阳虚模型 取分化成熟的P22足细胞,同步化24 h后,制备细胞悬液,取10 μl至细胞计数仪计数,以8 000个细胞/孔的密度将细胞悬液接种于96孔板,加入含10%胎牛血清的RPMI-1640培养基补足至100 μl/孔。培养24 h后,弃培养液,每孔加入含不同比例的脾肾阳虚IMN患者和/或健康志愿者血清的RPMI-1640培养基100 μl,对照组:健康志愿者血清10 μl+RPMI-1640培养基90 μl;5% IMN血清组:脾肾阳虚IMN患者血清5 μl+健康志愿者血清5 μl+RPMI-1640培养基90 μl;7.5% IMN血清组:脾肾阳虚IMN患者血清7.5 μl+健康志愿者血清2.5 μl+RPMI-1640培养基90 μl;10%IMN血清组:脾肾阳虚IMN患者血清10 μl+RPMI-1640培养基90 μl;每组设5个复孔。5% CO2、37 ℃培养箱孵育20 h,每孔加CCK-8 10 μl,5% CO2、37 ℃培养箱继续孵育4 h,酶标仪测定450 nm处OD值。不含细胞的完全培养基空白孔调零。
1.3.7 脾肾阳虚IMN患者血清和或温阳利水方水提物与足细胞共孵育
1.3.7.1 细胞免疫荧光检测P22足细胞骨架蛋白F-actin 取分化成熟的P22足细胞,同步化24 h后,制备细胞悬液,取10 μl至细胞计数仪计数,以50 000个细胞/孔的密度将细胞悬液接种于6孔板,加入含10%胎牛血清的RPMI-1640培养基补足至2 ml/孔。设正常对照组,模型组,2、4、8 mg/ml温阳利水方水提物组,共5组,每组3个复孔。培养24 h后,弃培养液,1×PBS洗2次。按照分组,每孔加入含10%健康志愿者或10%脾肾阳虚IMN患者血清的RPMI-1640培养基和不同浓度温阳利水方水提物,至总体积2 ml,具体添加方法见表1。5% CO2、37 ℃分别孵育24 h和48 h。弃去培养基,37 ℃预热的PBS洗一次,4 ℃预冷的4%多聚甲醛室温固定20 min,1×PBS洗涤5 min×3次,0.3%的Triton X-100室温透化细胞膜10 min,1×PBS洗涤5 min×2次,每孔添加200 μl的100 nmol/L的罗丹明-鬼笔环肽,室温避光孵育30 min后,PBS洗涤5 min×3次,立即上镜观察骨架蛋白F-actin。
1.3.7.2 qRT-PCR检测各组Caspase-3 mRNA表达水平 取分化成熟的P22足细胞,同步化24 h后,制备细胞悬液,取10 μl至细胞计数仪计数,以200 000个细胞/孔的密度将细胞悬液接种于6孔板,加入含10%胎牛血清的RPMI-1640培养基补足至2 ml/孔。设空白组,正常对照组,模型组,2、4、8 mg/ml温阳利水方水提物组,总共6组。培养24 h后,弃培养液,1×PBS洗2次。按照分组,空白组加入含10%胎牛血清的RPMI-1640培养基2 ml/孔,其余各组,每孔加入含10%健康志愿者或10%脾肾阳虚IMN患者血清的RPMI-1640培养基和不同浓度温阳利水方水提物,至总体积2 ml,具体添加方法见表1。5% CO2、37 ℃分别孵育24 h和48 h。

表1 各组血清和温阳利水方水提物添加方法Table 1 Details in adding serum and aqueous extract from Wenyanglishui Decoction
按Takara说明书步骤提取细胞总RNA,测定其在230、260、280、320 nm处的OD值,按公式〔(样品260 nm处的OD值-空白260 nm处的OD值)×40×20〕计算总RNA;按公式〔(样品260 nm处的OD值-空白260 nm处的OD值)(/样品280 nm处的OD值-空白280 nm处的OD值)〕,估测总RNA纯度,该比值在1.8~2.1为合格。2%琼脂糖电泳检测总RNA完整性。按说明书,配制20 μl体系进行反转录;配制25 μl体系进行扩增,qRT-PCR法检测Caspase-3基因表达情况。反应条件:95 ℃模板DNA预变性30 s、95 ℃变性5 s、56 ℃退火30 s,共进行40个循环,65 ℃延伸5 s。内参基因GAPDH及目的基因Caspase-3引物序列详见文献[12]。实验重复3次,每个样本、每个基因均采用3复孔,采用双△Ct的方法计算目的基因表达量,结果以2-∆∆Ct表示。
1.4 统计学方法 采用SPSS 17.0软件进行统计学分析。计量资料以(±s)表示,两组间比较采用成组t检验;多组间比较采用单因素方差分析,组间两两比较方差齐采用LSD检验,方差不齐采用Dunnett T3检验。以P<0.05为差异有统计学意义。
2 结果
2.1 温阳利水方水提物的氧化还原性 RPMI-1640培养基组和RPMI-1640培养基加温阳利水方水提物组OD值分别为(0.22±0.07)、(0.13±0.01)。两组OD值比较,差异无统计学意义(t=1.937,P>0.05)。
2.2 温阳利水方水提物对足细胞增殖能力的影响 0、1、2、4、8、10、20、40、60、80、100 mg/ml温阳利水方水提物组OD值比较,差异有统计学意义(P<0.05)。20、40、60、80、100 mg/ml温阳利水方水提物组OD值低于0 mg/ml温阳利水方水提物组,差异有统计学意义(P<0.05)。1、2、4、8、10 mg/ml温阳利水方水提物组OD值比较,差异无统计学意义(P>0.05,见表2)。为便于观察药物浓度梯度作用,遂选取2、4、8 mg/ml作为后续实验温阳利水方水提物干预浓度。
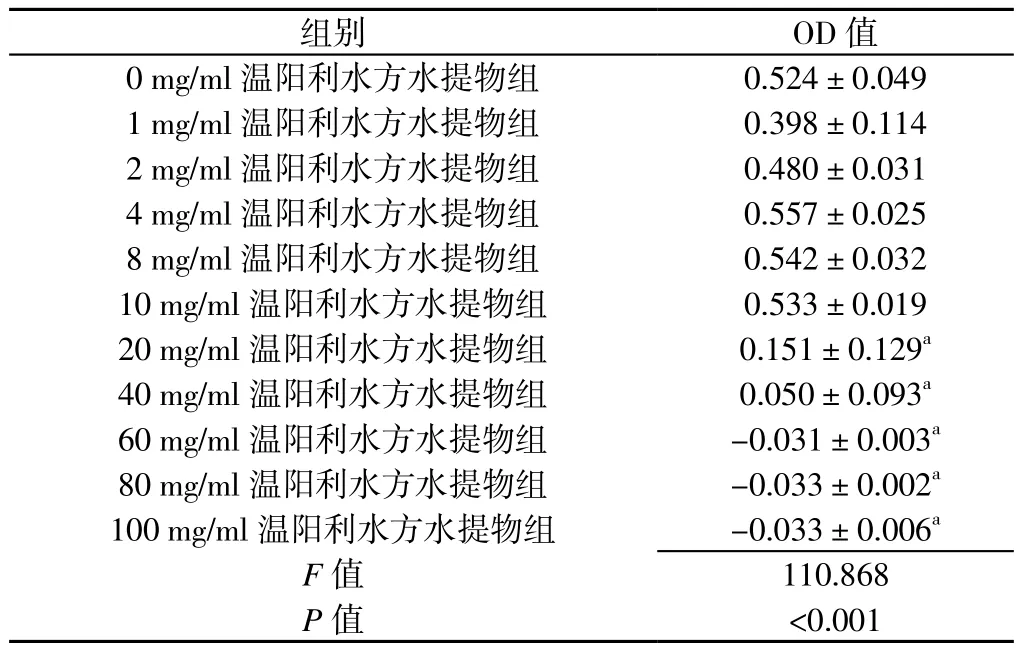
表2 温阳利水方水提物对足细胞增殖能力的影响(x±s)Table 2 Influence of aqueous extract from Wenyanglishui Decoction on the proliferation ability of mouse podocytes
2.3 不同浓度脾肾阳虚IMN患者血清对足细胞增殖能力的影响 对照组、5% IMN血清组、7.5% IMN血清组和10% IMN血清组OD值依次为(0.76±0.05)、(0.75±0.02)、(0.82±0.04)、(0.66±0.07)。4组OD值比较,差异有统计学意义(F=5.85,P=0.02)。10% IMN血清组OD值低于对照组、5% IMN血清组、7.5% IMN血清组,差异有统计学意义(P=0.035、0.048、0.003)。遂选取10%脾肾阳虚IMN患者血清作为体外模拟足细胞损伤的血清浓度。
2.4 温阳利水方水提物对脾肾阳虚IMN患者血清干预足细胞形态的影响 孵育24 h后,荧光显微镜下观察示,正常对照组足细胞内骨架蛋白F-actin表达丰富,与细胞轴方向一致呈束状分布,纤维稠密、强劲有力。模型组F-actin表达减少,与细胞轴方向不一致,部分断裂,排列紊乱。2 mg/ml温阳利水方水提物组F-actin表达较模型组稍多,但较正常对照组仍明显减少,与细胞轴方向不一致,部分断裂,排列紊乱。4 mg/ml温阳利水方水提物组F-actin表达较模型组增加,与细胞轴方向一致,但密度仍不及正常对照组。8 mg/ml温阳利水方水提物组F-actin表达较模型组明显增加,与细胞轴方向一致呈束状分布(见图1)。
孵育48 h后,荧光显微镜下观察示,正常对照组足细胞内骨架蛋白F-actin表达尚可,与细胞轴方向一致呈束状分布,未见纤维断裂。模型组F-actin表达明显减少,与细胞轴方向不一致,大部分纤维断裂,排列杂乱。2 mg/ml温阳利水方水提物组F-actin表达较模型组稍多,与细胞轴方向不一致,纤维断裂,排列紊乱。4 mg/ml温阳利水方水提物组F-actin表达较模型组增加,束状与断裂纤维并见,排列紊乱。8 mg/ml温阳利水方水提物组F-actin表达较模型组明显增加,可见较多呈束状,与细胞轴方向一致(见图1)。
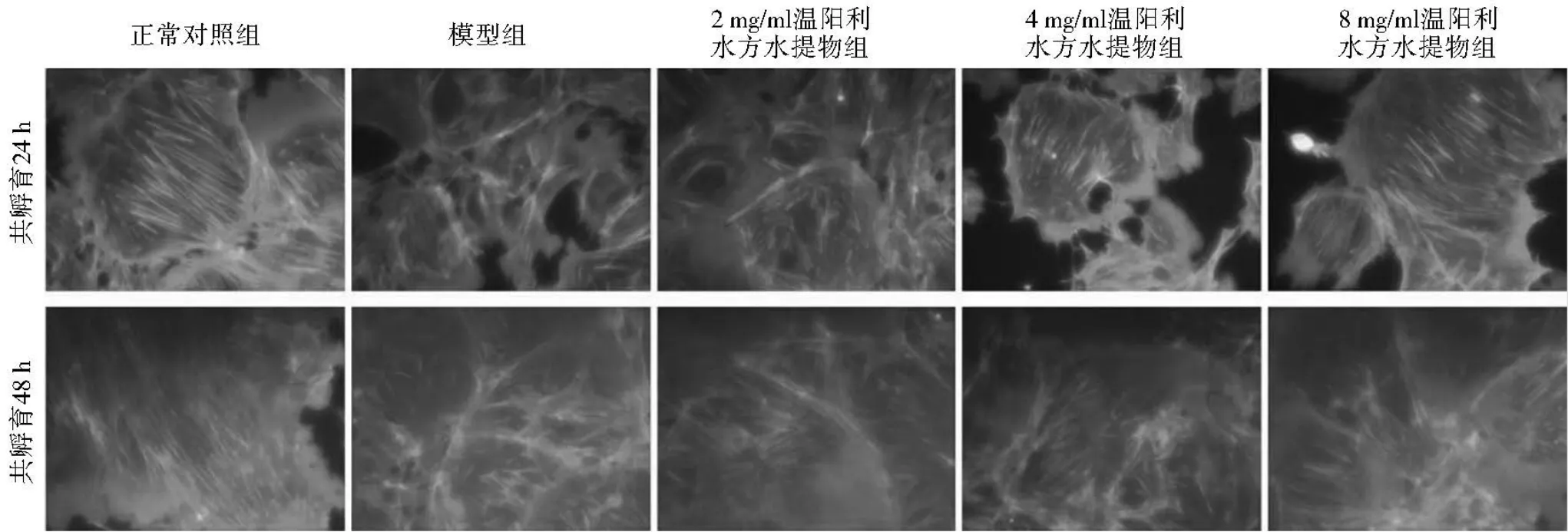
图1 温阳利水方水提物与脾肾阳虚IMN患者血清共孵育24 h和48 h后对足细胞骨架蛋白F-actin的影响(×400)Figure 1 Immunofluorescence microscopy of F-actin cytoskeleton of podocytes of the 5 groups at 24 h and 48 h after incubation
2.5 温阳利水方水提物对脾肾阳虚IMN患者血清干预足细胞Caspase-3 mRNA的影响 孵育24、48 h,5组Caspase-3 mRNA比较,差异有统计学意义(P<0.05)。孵育24 h,模型组Caspase-3 mRNA高于正常对照组,差异有统计学意义(P<0.05)。孵育48 h,模型组Caspase-3 mRNA高于正常对照组、2 mg/ml温阳利水方水提物组、8 mg/ml温阳利水方水提物组,差异有统计学意义(P<0.05);孵育48 h,8 mg/ml温阳利水方水提物组Caspase-3 mRNA低于2、4 mg/ml温阳利水方水提物组,差异有统计学意义(P<0.05,见表3)。
3 讨论
生物医学研究和生物医药产业的发展需要依赖疾病模型的构建,以探究疾病发生发展机制、筛选治疗药物和评价治疗效果[13]。由于足细胞为终末分化细胞,原代培养成功率低,不能直接将肾病患者足细胞分离后体外培养以研究足细胞损伤的机制。从最开始的Heymman肾炎模型,到人类和小鼠永生化足细胞系的建立,经历了漫长的摸索过程,使得足细胞的体外研究成为可能。目前,对多种肾脏疾病发病机制的探索,多使用相应疾病患者血清与足细胞体外共孵育,寻找此类患者血清中的致病因子。陈朝红等[14]体外培养永生化小鼠足细胞,将含10%局灶节段性肾小球硬化(FSGS)患者血清的培养液与足细胞共孵育24 h,发现FSGS患者血清中存在循环因子直接导致足细胞损伤。
本研究构建的脾肾阳虚IMN足细胞损伤模型,造模血清存在下述特殊之处:首先,必须是经肾活检和实验室检测确诊的IMN患者;其次,中医辨证符合脾肾阳虚;最后,患者血清anti-PLA2R阳性。该模型可排除不同致病因素和发病过程的干扰,直接作用于IMN的靶细胞,较好的体现了中医“病”“证”结合的特点,是建立脾肾阳虚IMN足细胞损伤的合适模型。本研究结果显示,10% IMN血清组足细胞增殖能力较其他组明显减弱,因此选用浓度为10%的脾肾阳虚IMN患者血清构建足细胞损伤IMN脾肾阳虚模型。
足突是足细胞最重要的结构和功能单位,内含丰富的actin纤维,聚合为F-actin后形成微丝。足细胞病的共同特点是面对损伤应激时,足突回缩和固有结构弱化。目前,关于足细胞病最基本的分子表现形式,业内广泛认可的是足细胞Factin骨架蛋白结构的改变[15]。且已有学者证实,稳定足细胞Factin骨架蛋白具有重要的治疗作用[16]。本研究通过荧光显微镜观察示,正常对照组F-actin表达丰富,与细胞轴方向一致呈束状分布,纤维稠密、强劲有力;而模型组F-actin表达减少,与细胞轴方向不一致,部分断裂,排列紊乱。在模型组基础上,添加不同浓度温阳利水方水提物后,F-actin表达较模型组增多,纤维断裂和排列紊乱情况均有所改善。由此可见,脾肾阳虚IMN患者血清与足细胞共孵育后,可导致骨架蛋白F-actin正常结构破坏;添加温阳利水方水提物共孵育后,F-actin表达、纤维断裂和重排现象均有所改善,提示温阳利水方可缓解脾肾阳虚IMN患者血清致足细胞损伤。
F-actin骨架蛋白重排,可使局灶黏附激酶磷酸化,导致细胞核NF-κB上调[17],促进p53表达,后者可转录激活凋亡相关蛋白,在线粒体外膜形成小孔,导致细胞色素C等促凋亡蛋白从线粒体中释放,其中,线粒体内部释放的pro-caspase-3直接参与凋亡信号的转导[18-19]。研究发现,Caspase-3的表达水平与各种肾脏固有细胞的凋亡、炎症、纤维化密切相关[20]。张弢等[21]检测不同肾小球肾炎患者肾活检组织中Caspase-3的表达量,观察到其主要表达在肾小球和肾小管细胞的细胞膜和细胞质,且与正常对照组、系膜增生性肾小球肾炎组相比,MN组Caspase-3表达量最高。本研究观察到,孵育24 h和48 h后,模型组Caspase-3 mRNA均较正常对照组增加;提示IMN脾肾阳虚患者血清可诱导足细胞发生凋亡反应。此外,与模型组比较,孵育48 h,2、8 mg/ml温阳利水方水提物组Caspase-3 mRNA均降低,提示温阳利水方水提物可通过下调Caspase-3 mRNA表达,缓解脾肾阳虚IMN患者血清导致的足细胞损伤反应。
温阳利水法是治疗脾肾阳虚水湿泛滥水肿的中医经典疗法,温阳利水代表方“真武汤”自“医圣”张仲景创制以来就被历代医家沿用至今。本研究所用温阳利水方是在“真武汤”基础上,罗月中教授结合多年临床实践观察,调整药材剂量、增加药味制定而成。近年来,大量临床和基础研究均证实,黄芪具有较好的肾脏保护作用。如黄芪水提物可上调足细胞与基底膜之间黏附分子的表达[22];黄芪甲苷抑制系膜细胞增殖,减轻体外培养足细胞的氧化应激水平[23],通过抑制JNK和ERK1/2的活化,缓解补体膜攻击复合物C5b-9对体外培养小鼠足细胞骨架蛋白和线粒体活化蛋白激酶的损伤[24]。亦有研究发现,真武汤水提物高效液相色谱(HPLC)特征图谱大部分色谱峰来自白芍(占66.7%)[25]。本研究采用同样的煎药方法,提示水提液主要成分之一为白芍活性成分。体内研究证实,白芍总苷具有促进Bcl-2表达、下调Bax、Caspase-3 表达的作用[26]。
综上所述,本研究构建了脾肾阳虚IMN足细胞损伤模型,并予温阳利水方水提物共孵育,直接模拟温阳利水方对IMN脾肾阳虚足细胞病变的治疗作用。借助细胞分子生物学方法,从细胞、分子、基因等不同层面,探讨脾肾阳虚IMN患者血清对足细胞结构的影响以及温阳利水法干预的效应及机制。结果提示温阳利水方水提物可改善脾肾阳虚IMN患者血清致小鼠足细胞骨架蛋白F-actin重排,可能通过抑制Caspase-3 mRNA的表达发挥抗凋亡效应。由于课题组未能成功获得人永生化足细胞,无法探讨IMN患者血清anti-PLA2R与足细胞PLA2R特异性结合后对足细胞结构和功能产生的影响及作用机制,实属遗憾。期待我国能早日自主构建人永生化足细胞系,为明确IMN具体发病机制及过程、探索中药作用环节提供新的途径。
志谢:衷心感谢广东省人民医院史伟教授、章斌教授和张丽主治医师及肾病科实验室的师弟师妹们!感谢广州中医药大学岭南医学研究中心中医骨伤科学实验室何伟教授、王海彬教授、詹冬香老师提供良好的实验环境。
作者贡献:鲁欢进行文章的构思和设计,文章的可行性分析,撰写论文;鲁欢、罗月中进行论文的修订,英文的修订;鲁欢、詹冬香进行实验操作;鲁欢、苏保林、吴兴波进行资料整理、数据分析;苏保林、王超进行细胞培养;汤水福、陈刚毅、罗月中进行质量控制及审校,对文章整体负责,监督管理。
本文无利益冲突。
[1]RONCO P,DEBIEC H.Membranous nephropathy:a fairy tale for immunopathologists,nephrologists and patients[J].Mol Immunol,2015,68(1):57-62.DOI:10.1016/j.molimm.2015.07.003.
[2]王海燕.肾脏病学[M].3版.北京:人民卫生出版社,2008:1032-1033.WANG H Y.Nephrology[M].3rd ed.Beijing:People's Medical Publishing House,2008:1032-1033.
[3]PONTICELLI C,PASSERINI P.Management of idiopathic membranous nephropathy[J].Expert Opin Pharmacother,2010,11(13):2163-2175.DOI:10.1517/14656566.2010.494599.
[4]DUBUF-VEREIJKEN P W,BRANTEN A J,WETZELS J F.Idiopathic membranous nephropathy:outline and rationale of a treatment strategy[J].Am J Kidney Dis,2005,46(6):1012-1029.DOI:10.1053/j.ajkd.2005.08.020.
[5]VAN DEN BRAND J A,HOFSTRA J M,WETZELS J F.Lowmolecular-weight proteins as prognostic markers in idiopathic membranous nephropathy[J].Clin J Am Soc Nephrol,2011,6(12):2846-2853.DOI:10.2215/CJN.04020411.
[6]罗月中,苏式兵,郎建英,等.成人特发性膜性肾病遗传易感性与中医证型的关联性研究[J].中国中西医结合肾病杂 志,2012,13(1):30-33.DOI:10.3969/j.issn.1009-587X.2012.01.010.LUO Y Z,SU S B,LANG J Y,et al.Association of genetic susceptibility with TCM syndromes to idiopathic membranous nephropathy in adults[J].Chinese Journal of Integrated Traditional and Western Nephrology,2012,13(1):30-33.DOI:10.3969/j.issn.1009-587X.2012.01.010.
[7]BECK LH Jr,BONEGIO R G,LAMBEAU G,et al.M-type phospholipase A2 receptor as target antigen in idiopathic membranous nephropathy[J].N Engl J Med,2009,361(1):11-21.DOI:10.1056/NEJMoa0810457.
[8]鲁欢,汤水福,陈刚毅,等.血清抗M型磷脂酶A2受体抗体对成年人特发性膜性肾病诊治的指导作用[J].中国全科医 学,2016,19(14):1647-1652.DOI:10.3969/j.issn.1007-9572.2016.14.009.LU H,TANG S F,CHEN G Y,et al.Role of M _ type Phospholipase A2 receptor antibody in the diagnosis and treatment of idiopathic membranous nephropathy in adults[J].Chinese General Practice,2016,19(14):1647-1652.DOI:10.3969/j.issn.1007-9572.2016.14.009.
[9]杨雪芬,潘阳彬,丁国华,等.成人特发性膜性肾病与分泌型磷脂酶A2-ⅠB及抗磷脂酶A2受体抗体的相关性研究[J].中国全科医学,2015,18(9):1018-1022,1028.DOI:10.3969/j.issn.1007-9572.2015.09.12.TANG X F,PAN Y B,DING G H,et al.Correlation of secreted phospholipase A2-ⅠB,anti - phospholipase A2 receptor antibody with idiopathic membranous nephropathy among adult patients[J].Chinese General Practice,2015,18(9):1018-1022,1028.DOI:10.3969/j.issn.1007-9572.2015.09.12.
[10]鲁欢,涂海涛,苏保林,等.血清抗M型磷脂酶A2受体抗体与特发性膜性肾病脾肾阳虚的关联探讨[J].辽宁中医杂志,2017,44(5):905-909.DOI:10.13192/j.issn.1000-1719.2017.05.003.LU H,TU H T,SU B L,et al.Correlation of serum antibody to M-type phospholipase A2 receptor and syndrome of spleen and kidney Yang dificiency in patients with idiopathic membranous nephropathy[J].Liaoning Journal of Traditional Chinese Medicine,2017,44(5):905-909.DOI:10.13192/j.issn.1000-1719.2017.05.003.
[11]王永钧,鲁盈.原发性肾病综合征的诊断、辨证分型及疗效评定(试行方案)[J].上海中医药杂志,2006,40(10):51-52.DOI:10.3969/j.issn.1007-1334.2006.10.024.WANG Y J,LU Y.Diagnosis,syndrome differentiation and treatment evaluation(trial scheme)on primary nephrotic syndrome[J].Shanghai Journal of Traditional Chinese Medicine,2006,40(10):51-52.DOI:10.3969/j.issn.1007-1334.2006.10.024.
[12]涂海涛,鲁欢,罗月中,等.温阳利水方含药血清对脾肾阳虚IMN患者血清致小鼠足细胞凋亡的作用[J].广东医学,2017,38(18):2745-2749.DOI:10.3969/j.issn.1001-9448.2017.18.001.TU H T,LU H,LUO Y Z,et al.Research of the effect of serum containing formulation warming Yang on apoptosis of mouse Sertoli cells induced by serum from patients with spleen-kidney Yang insufficiency IMN[J].Guangdong Medical Journal,2017,38(18):2745-2749.DOI:10.3969/j.issn.1001-9448.2017.18.001.
[13]薛丽香,张凤珠,孙瑞娟,等.我国疾病动物模型的研究现状和展望[J].中国科学:生命科学,2014,44(9):851-861.DOI:10.1360/N052014-00186.XUE L X,ZHANG F Z,SUN R J,et al.Research status and perspective of disease animal models in China[J].Scientia Sinica Vitae,2014,44(9):851-861.DOI:10.1360/N052014-00186.
[14]陈朝红,刘志红,秦卫松,等.利用体外培养足细胞针对局灶节段性肾小球硬化患者的循环因子进行检测[J].肾脏病与透析肾移植杂志,2009,18(1):3-12.DOI:10.3969/j.issn.1006-298X.2009.01.002.CHEN Z H,LIU Z H,QIN W S,et al.Visualize circulating factor by using podocytes as a target cell in patients with FSGS[J].Chinese Journal of Nephrology Dialysis & Transplantation,2009,18(1):3-12.DOI:10.3969/j.issn.1006-298X.2009.01.002.
[15]SCHELL C,HUBER T B.The evolving complexity of the podocyte cytoskeleton[J].J Am Soc Nephrol,2017,28(11):3166-3174.DOI:10.1681/ASN.2017020143.
[16]SCHIFFER M,TENG B,GU C,et al.Pharmacological targeting of actin-dependent dynamin oligomerization ameliorates chronic kidney disease in diverse animal models[J].Nat Med,2015,21(6):601-609.DOI:10.1038/nm.3843.
[17]MORIGIM,BUELLI S,ANGIOLETTI S,et al.In response to protein load podocytes reorganize cytoskeleton and modulate endothelin-1 gene:implication for permselective dysfunction of chronic nephropathies[J].Am J Pathol,2005,166(5):1309-1320.DOI:10.1016/S0002-9440(10)62350-4.
[18]BOATRIGHT K M,SALVESEN G S.Mechanisms of caspase activation[J].Curr Opin Cell Biol,2003,15(6):725-731.DOI:10.1016/j.ceb.2003.10.009.
[19]赵瑞杰,李引干,王会,等.Caspase家族与细胞凋亡的关系[J].中国畜牧杂志,2010,46(17):73-78.ZHAO R J,LI Y Q,WANG H,et al.Relationship of Caspase family and apoptosis[J].Chin J Anim Sci,2010,46(17):73-78.
[20]TUNCDEMIR M,OZTURK M.The effects of angiotensin-Ⅱreceptor blockers on podocyte damage and glomerular apoptosis in a rat model of experimental streptozotocin-induced diabetic nephropathy[J].Acta Histochem,2011,113(8):826-832.DOI:10.1016/j.acthis.2010.12.003.
[21]张弢,张雨,李小丽,等.TGF-β1、Caspase-3和WT1在肾活检肾小球肾炎组织中的表达及临床病理意义[J].大理 学 院 学 报,2014,13(4):25-29,93.DOI:10.3969/j.issn.1672-2345.2014.04.008.ZHANG T,ZHAGN Y,LI X L,et al.Expressions and clinicalpathological significance of TGF-β1,Caspase-3 and WT1 in glomerulonephritis[J].Journal of Dali University,2014,13(4):25-29,93.DOI:10.3969/j.issn.1672-2345.2014.04.008.
[22]桂定坤.黄芪水提物促肾脏水钠排泄及肾脏保护作用的细胞分子机制研究[D].上海:复旦大学,2007.GUI D K.Celluar and molecular mechanism of aqueous extrat of Astragali Radix on renal water and sodium excretion and its renal protective effects[D].Shanghai:Fudan University,2007.
[23]肖文珍.黄芪甲苷的抗氧化应激作用对体外高糖刺激足细胞的保护作用[D].苏州:苏州大学,2013.XIAO W Z.The antioxidative effects of Astragaloside Ⅳ protect against podocyte lesion exposed to high glucose[D].Suzhou:Soochow University,2013.
[24]萧翠玉.真武汤的临床运用和药理研究[D].武汉:湖北中医学院,2007.XIAO C Y.The clinical application and medicinal study of the prescription of 'Zhen Wu decoction'[D].Wuhan:Hubei College of Chinese Medicine,2007.
[25]吴俊标,贺雨,梁春玲,等.真武汤水提液HPLC特征图谱研究及指标成分的测定[J].中国实验方剂学杂志,2014,20(18):45-49.DOI:10.13422/j.cnki.syfjx.2014180045.WU J B,HE Y,LIANG C L,et al.HPLC characteristics of aqueous extract of Zhenwu decoction and determination of markers[J].Chinese Journal of Experimental Traditional



