姜武,凌逸虹,吴晓丹,蔡木炎,张惠忠,林育珠,丁培荣*,潘志忠,万德森
DNA错配修复(MMR)系统是维持生物基因组稳定的重要途径,其通过识别、水解受损DNA片段等一系列步骤实现MMR,从而保证了DNA复制过程的高保真性[1]。MMR基因胚系突变或者启动子区甲基化会导致MMR蛋白功能缺失,进而导致肿瘤相关基因突变增多并累积,是结直肠癌重要的发病原因之一[2]。针对MMR蛋白,即MLH1、MSH2、MSH6和PMS2 4个蛋白的免疫组化检测在结直肠癌临床实践中具有重要价值,MMR状态可以预测5-氟尿嘧啶(5-FU)单药辅助化疗的疗效[3],并富集抗程序性细胞死亡蛋白(PD)-1免疫治疗的优势人群[4],免疫组化检测发现MMR蛋白缺失是结直肠癌患者预后良好的指标[5],但同时也提示了Lynch综合征的可能[6],需要进一步进行遗传筛查和基因检测。尽管MMR蛋白免疫组化检测已经在临床上普遍开展,但在实践中仍存在病理报告不够规范的情况。为此,本文将对结直肠癌MMR蛋白免疫组化结果临床判读中出现的问题进行汇总分析,以为该项目后续的开展提供参考。
本研究价值:
作为一项逐渐普及的病理检查,结直肠癌错配修复(MMR)蛋白免疫组化结果判读的规范性需要引起广泛重视。不规范的判读包括以百分数、半定量、+/-等表述形式;同时应警惕4个MMR蛋白染色结果均阴性的情况。医务人员应明确MMR蛋白免疫组化染色结果是二分类的,且极少存在4个蛋白全部表达缺失,关注内对照染色质量,设置标准外对照病例,并对有疑问的染色结果及时复核,将有助于提升最终结果的准确性。
1 资料与方法
1.1 一般资料 选取2010年11月—2015年12月在中山大学肿瘤防治中心就诊并进行MMR蛋白免疫组化检测的结直肠腺癌患者,共3 357例,全部纳入分析。
1.2 免疫组化检测 免疫组化检测采用Envision两步法进行常规染色。采用的初始一抗单克隆抗体分别为MLH1克隆ES05抗体,MSH2克隆RED2抗体,MSH6克隆EP49抗体,PMS2克隆EP51抗体,以上均为北京中杉金桥生物技术有限公司产品,检测操作步骤按照说明书进行。
1.3 方法 回顾性分析MMR蛋白免疫组化检测报告,并进行再判读。免疫组化结果依据肿瘤及正常组织细胞核内染色情况进行判定:肿瘤细胞核无着色而内对照正常细胞核着色,判为MMR蛋白染色阴性,即MMR蛋白表达缺失;肿瘤细胞核与正常细胞核均着色,判为MMR蛋白染色阳性,即MMR蛋白正常表达。报告均由2位经验丰富的高年资病理医生独立阅片得出,若出现判定结果不一致,则由第3位高年资病理医生复核,综合评定结果,筛选其中判读不规范和存在争议的结果,总结并重读MMR蛋白免疫组化检测结果。
2 结果
2.1 判读MMR蛋白免疫组化结果表述不规范的病例情况共发现103例患者的免疫组化判读结果表述存在争议,认为其无法满足临床需求。不规范的判读可总结为以下几种类型:(1)以百分数形式描述的免疫组化结果,例如MLH1(80%+)等,共计25例患者;(2)以半定量形式描述免疫组化结果,即表述为弱+、局灶+、部分+、个别+等半定量形式,共计65例患者的75个染色指标;(3)免疫组化结果模糊表述为+/-,共计13例患者的14个染色指标。
2.2 MMR蛋白免疫组化结果表述不规范病例的重读结果 对上述103例患者免疫组化结果再次阅片判读,必要时进行重新染色。重读结果如下:(1)25例以百分数形式描述的免疫组化结果,重读结果均为染色阳性。(2)75个以半定量形式描述的免疫组化结果,重读后69个指标为染色阳性,5个指标为染色阴性,1个指标仍无法判定(肿瘤组织缺失,无法重染复核)。(3)14个免疫组化结果模糊表述为+/-的指标,重读后13个指标为染色阳性,1个指标为染色阴性(详见表1)。
2.3 4个MMR蛋白免疫组化染色全阴的病例分析 共3例患者出现4个MMR蛋白免疫组化染色均为阴性,该检测结果存在临床争议。经重新切片染色后,1例为4个MMR蛋白均染色阳性,即pMMR;1例为MSH6蛋白染色阴性,其余3个MMR蛋白染色阳性;1例为MLH1和PMS2蛋白成对染色阴性,其余2个MMR蛋白染色阳性(详见表2)。
2.4 引起判读结果争议的原因 造成上述病例判读结果争议的原因除了部分病理医生对判定标准不熟悉外,更重要的原因是染色片质量欠佳,造成判读困难。包括如下2种典型情况:(1)内对照不表达或表达过弱,导致判读为假阴性(见图1A)或假阳性(见图1B)。(2)非特异性染色,肿瘤细胞核染色定位不准,胞质弥漫染色,无法判断肿瘤组织MMR蛋白表达情况(见图1C)。
3 讨论
鉴于MMR状态对于肿瘤筛查、预后判断及治疗决策上的积极作用,美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)结直肠癌指南推荐对结直肠癌患者的病理标本均应进行MMR蛋白免疫组化或微卫星不稳定(MSI)状态检测[7]。由于MMR蛋白免疫组化检测对仪器和技术要求不高,开展相对容易,目前已成为结直肠癌标本的常规病理检测内容。
然而,确保免疫组化检测结果稳定、可靠并不是一件容易的工作。肿瘤标本需要及时固定;选择的检测蜡块应该同时含有肿瘤组织和正常组织,以便进行内对照;抗原修复过程既要能充分暴露所检测的抗原,又要避免过度修复所导致的假阳性;DAB染色时间要恰当,避免因染色不足或染色过度而影响结果判读。随着检测试剂标准化和染色流程自动化,上述步骤的质量控制得到了很好的保证,极大限度地降低了因检测环节偏差而导致的结果不确定性。

表1 MMR蛋白免疫组化结果表述不规范病例的重读结果Table 1 Reevaluating results for the irregular interpretation of immunohistochemistry for mismatch repair proteins

表2 4个MMR蛋白免疫组化染色全阴病例的重读结果Table 2 Reevaluating results for the patients with four mismatch repair proteins deficiency
本研究回顾了中山大学肿瘤防治中心开展MMR蛋白免疫组化检测以来的病理报告,并对其中报告不规范的病理结果进行重读和再评估,绝大多数患者最终得到了确切判定,仅有1例患者的MSH2蛋白因原片染色欠佳,且剩余蜡块中已无肿瘤组织可供重染,致使结果无法判断。临床判读过程中,病理医生易出现偏差的环节总结如下:首先,病理医生应意识到MMR免疫组化结果是二分类的,即只有阴性和阳性两种结果,而并不存在染色强度的差别,或者阳性细胞数量的多少。其次,应注意染色质量的评估,以避免假阳性和假阴性。常规情况下,MMR蛋白在正常组织中是阳性表达的,如果出现正常内对照不表达或者表达过弱时,无论肿瘤组织染色如何,均应慎重判读。不仅如此,MMR蛋白的表达应该是定位于细胞核,若出现胞膜或胞质染色阳性时,如本研究中部分患者出现弥漫的胞质染色,提示染色定位不准,质量欠佳。
被检测的4个MMR蛋白中,MSH2和MSH6蛋白形成MutS α二聚体,负责识别错配碱基并与异常DNA相结合[8],MLH1和PMS2蛋白则形成MutL α异二聚体,在三磷腺苷(ATP)作用下修复DNA错配[9]。其中MLH1和MSH2蛋白是MMR系统的核心蛋白,当MLH1或MSH2蛋白缺失的时候也会引起其异二聚体配对蛋白的成对缺失。然而,4个MMR蛋白全部表达缺失的现象则是极其罕见的,本研究对3例MMR蛋白染色全阴性的患者进行复核,结果显示存在因染色问题而导致的误判。解决这一问题最简单、有效的办法即设置标准外对照,选择检测结果确切的阳性病例和阴性病例各一例进行同时染色,通过评估对照的染色情况来判定受检者的MMR状态。
综上所述,作为一项临床开展逐渐普及的病理检查,MMR蛋白免疫组化结果的判读仍需要引起广大医务人员的重视。MMR蛋白免疫组化结果判读存在争议的原因主要在于以百分数形式描述、以半定量形式描述、模糊表述为+/-以及4个MMR蛋白染色结果均为阴性等情况。因此,应加强对MMR蛋白功能的认知,明确其免疫组化结果是二分类的,且极少存在4个蛋白全部表达缺失,对有疑问的染色结果及时复核,将有助于提升最终结果的准确性,更好地指导临床诊治。
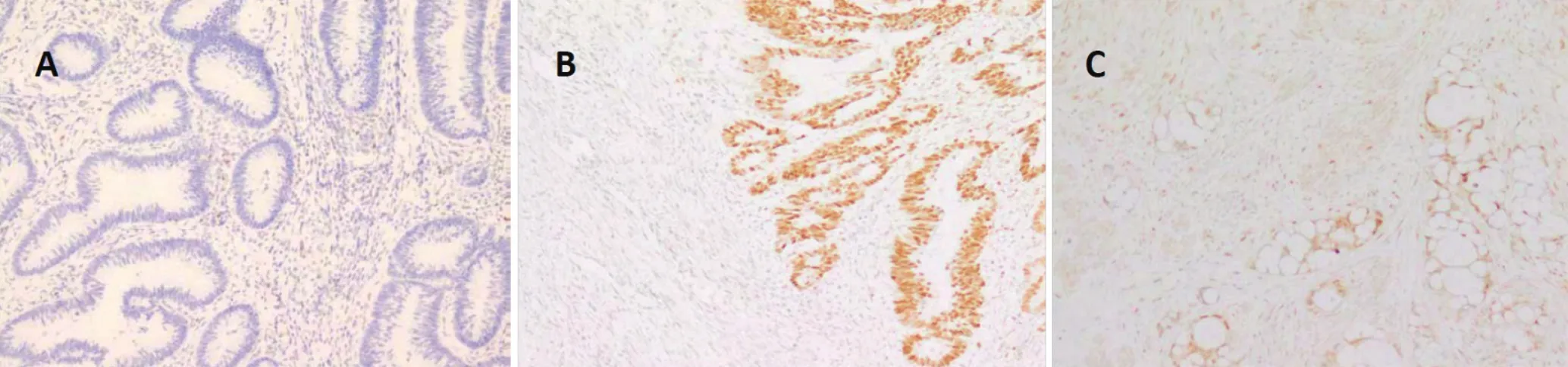
图 1 MMR蛋白免疫组化染色质量欠佳典型图例Figure 1 Typical illustration of poor immunohistochemical staining for MMR proteins
作者贡献:姜武、凌逸虹进行文章的构思与设计,研究的实施与可行性分析,数据整理,结果分析与解释,撰写论文;吴晓丹、林育珠进行数据收集;蔡木炎、丁培荣进行论文修订;张惠忠、潘志忠、万德森负责文章的质量控制及审校;丁培荣对文章整体负责,监督管理。
本文无利益冲突。



