蔡博,陈娴秋,杨文兰,杨光红,黄劲,全华,冯永红,5,6*
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种病因不明、进行性发展的致命性肺部疾病[1]。IPF影响着全世界近300万人,其发病率随年龄的增加而急剧升高[2]。尽管吡非尼酮和尼达尼布等新药的运用给IPF的治疗带来了希望,但IPF的疾病进展瞬息万变,IPF患者中位生存时间一般为2~3年[3],急性加重后,其生存时间会缩短至3个月内[4],死亡率依旧很高。因此,有效地构建和使用IPF死亡风险预测模型,对临床医生评估患者病情、预后及今后的临床防治工作有着重要的意义。目前已有研究表明,性别-年龄-肺功能(gender,age,and physiologic variables,GAP)评分以及GAP分期对IPF患者的死亡风险均有着较强的预测能力[5]。复合生理指数(composite physiologic index,CPI)可排除肺气肿、肺动脉高压的干扰,对IPF疾病严重程度提供更为准确的整体评估[6]。国内外研究一般仅应用其中一种模型来进行预测,而哪一种模型更具有优势或临床应用价值,目前少见报道。本研究使用同一病例数据库比较GAP分期与CPI对IPF的临床预测价值,旨在为临床医生评估IPF患者病情、预后及今后的临床防治工作提供参考。
1 对象与方法
1.1 研究对象 选取2012—2019年在同济大学附属上海市肺科医院确诊的200例IPF患者为研究对象,收集患者初次住院的病例资料,其中男181例(90.5%),女19例(9.5%);年龄41~85岁,平均年龄(66.0±7.6)岁;临床症状:咳嗽182例(91.0%)、气促107例(53.5%)、咳痰101例(50.5%)、胸痛10例(5.0%);临床体征:Velcro啰音159例(79.5%)、杵状指29例(14.5%);合并/并发症:低氧血症68例(34.0%)、心脏疾病39例(19.5%)、肺气肿33例(16.5%)、肺动脉高压25例(12.5%)、呼吸衰竭12例(6.0%)、胃食管反流症6例(3.0%)、慢性阻塞性肺疾病4例(2.0%)。入选标准:(1)符合2018年美国胸科学会(ATS)/欧洲呼吸学会(ERS)/日本呼吸学会(JRS)/拉丁美洲胸科协会(ALAT)制订的IPF诊断标准[1];(2)有完整的初次住院临床记录:基本临床资料、肺功能检查结果、肺部高分辨率CT(HRCT)检查结果、实验室检查结果;(4)同意并签署知情同意书。排除标准:(1)初次诊断与末次诊断不符;(2)临床数据不全,尤其是肺功能检查时因呛咳或气急等原因配合欠佳,未进行弥散功能检测者;(3)本研究CPI评分时需要完整的一氧化碳弥散量(DLCO)数据,因弥散功能严重减退而无法完成者;(4)进行门诊或电话随访的失访者。IPF患者的筛选流程见图1。本研究经同济大学附属上海市肺科医院伦理委员会审批(K17-006)。
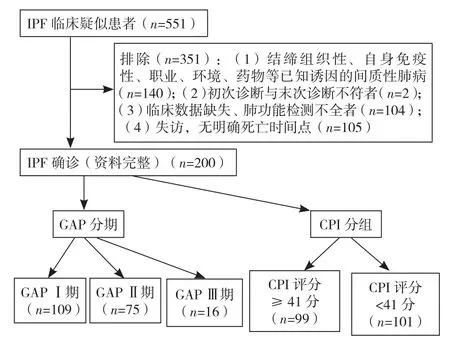
图1 IPF患者筛选流程图Figure 1 IPF patients screening flow chart
1.2 方法
1.2.1 GAP模型 GAP评分及分期参照2012年LEY等[7]制订的标准:(1)性别0~1分:男性1分,女性0分;(2)年龄0~2分:≤60岁0分,61~65岁为1分,>65岁2分;(3)用力肺活量占预计值百分比(FVC%pred)0~2分:>75%为0分,>50%~75%为1分,≤50%为2分;(4)DLCO占预计值百分比(DLCO%pred)0~3分:>55%为0分,>36%~55%为1分,≤36% 为2分,无法完成3分。GAP分期按0~3分为GAP Ⅰ期,4~5分为GAP Ⅱ期,6~8分为GAP Ⅲ期。不同GAP分期患者年龄、氧分压(PaO2)、二氧化碳分压(PaCO2)、氧饱和度(SaO2)、FVC%pred、第1秒用力呼吸末容积占预计值百分比(FEV1%pred)、肺总量所占预计值(TLC%pred)、DLCO%pred、CPI评 分、CPI分组、死亡情况比较,差异均有统计学意义(P<0.05);不同GAP分期患者性别、磨玻璃影比例、蜂窝状影比例比较,差异均无统计学意义(P>0.05),见表1。
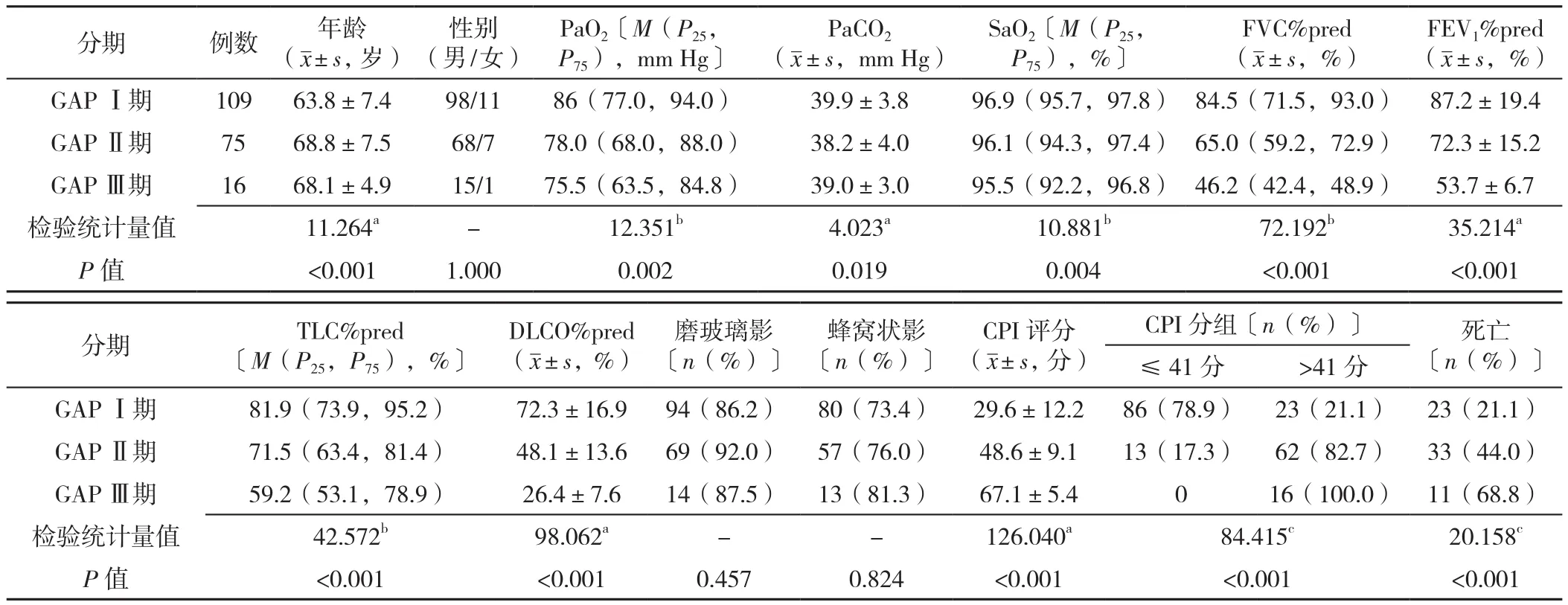
表1 不同GAP分期患者的临床、影像学、生理学特征比较Table 1 Comparison of clinical,imaging and physiological characteristics of patients by GAP staging
1.2.2 CPI模型 CPI依照WELLS等[8]的预测模型,包括3个参数:DLCO%pred、FVC%pred、FEV1%pred。计算公式:CPI=91.0-(0.65×DLCO%pred)-(0.53×FVC%pred)+(0.34×FEV1%pred)。MURA等[9]发现CPI评分>41分对IPF患者3年内死亡率的预测具有高度特异性,本研究依此结果将患者分为两组:CPI评分≤41分,CPI评分>41分。不同CPI评分患者 PaO2、SaO2、FVC%pred、FEV1%pred、TLC%pred、DLCO%pred、磨玻璃影比例、蜂窝状影比例、GAP分期、死亡率比较,差异均有统计学意义(P<0.05);不同CPI评分患者年龄、性别、PaCO2比较,差异均无统计学意义(P>0.05),见表2。
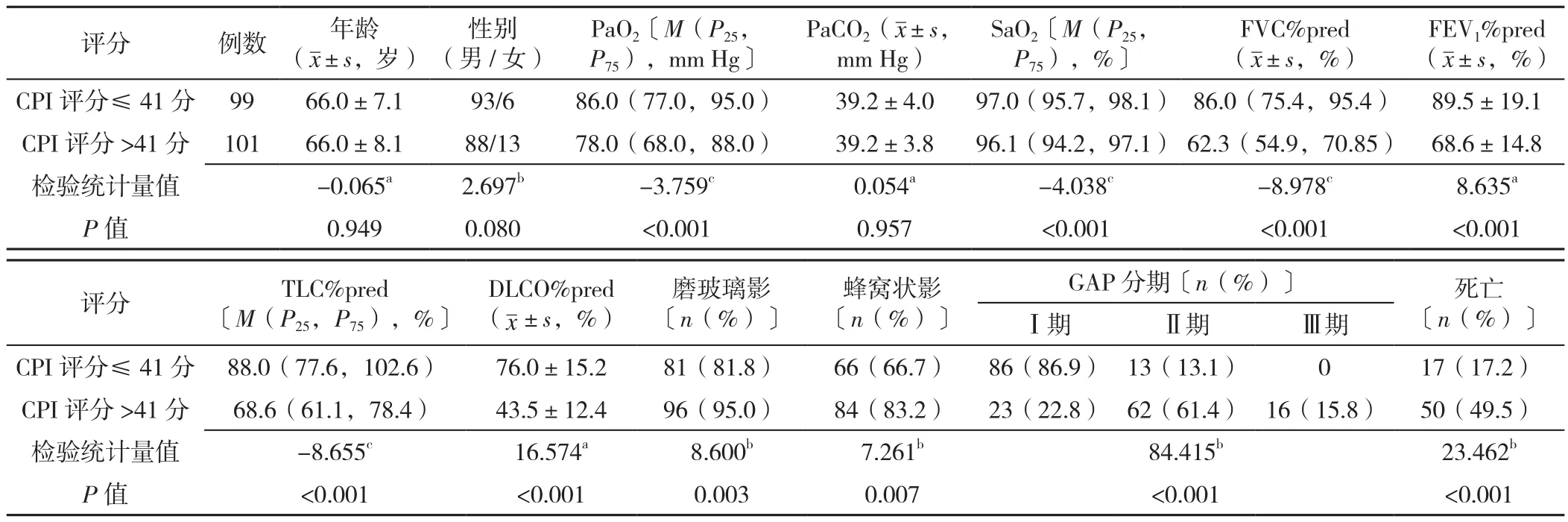
表2 不同CPI评分患者的临床、影像学、生理学特征比较Table 2 Comparison of clinical,imaging and physiological characteristics of patients by CPI score
1.2.3 观察指标 动脉血气分析指标(PaCO2、PaO2、SaO2);Master Screen Diffusion肺功能检查仪(德国Erich Jaeger公司)检测肺功能指标,包括FVC%pred、TLC%pred、DLCO%pred、FEV1%pred;HRCT观察指标(毛玻璃影、蜂窝状影);GAP评分及分期;CPI评分及分组;通过电话、门诊随访以及本院电子信息数据库获取IPF患者的生存情况,记录患者生存时间。本部分研究结局为死亡,生存时间为患者首次确诊到死亡时间。患者首次出院后3个月、6个月、1年、之后依次维持在1年/次进行随访,随访截止至2020-12-08,平均随访时间(42.9±1.8)个月。其中死亡67例(33.5%),生存133例(66.5%)。
1.3 统计学方法 采用SPSS 25.0统计学软件进行数据分析。计量资料符合正态分布以(±s)表示,采用成组t检验或方差分析进行组间比较;计量资料不符合正态分布以M(P25,P75)表示,组间比较采用秩和检验;计数资料以相对数表示,组间比较采用χ2检验或Fisher's确切概率法;采用单因素Cox比例风险回归模型对IPF预后影响因素进行分析;绘制两模型预测IPF患者死亡率的受试者工作特征曲线(ROC曲线),比较CPI和GAP分期在1年死亡率、2年死亡率、3年死亡率(有29例患者随访时间<3年,计算时以缺失数据处理)以及总体死亡率上的ROC曲线下面积(AUC),并使用Medcalc软件分析两者的预测效能。以P<0.05为差异有统计学意义。
2 结果
2.1 IPF患者预后影响因素的单因素Cox比例风险回归模型分析 以IPF患者生存情况为因变量(赋值:生存=0,死亡=1),以GAP评分(赋值:实测值)、CPI评分(赋值:实测值)、GAP分期(赋值:GAP Ⅰ期=0,GAP Ⅱ期=1,GAP Ⅲ期=2)为自变量,使用单因素Cox比例风险回归模型进行分析,结果显示,GAP评分〔HR=1.038,95%CI(1.023,1.054)〕,CPI评分〔HR=1.509,95%CI(1.286,1.771)〕是IPF患者预后的独立影响因素(P<0.05),且IPF患者的死亡风险随着GAP及CPI评分增加而增加;GAP Ⅱ期〔HR=2.622,95%CI(1.536,4.475)〕和Ⅲ期〔HR=4.002,95%CI(1.947,8.226)〕IPF患者的死亡风险分别是GAP Ⅰ期IPF患者的2.622倍和4.002倍,见表3。
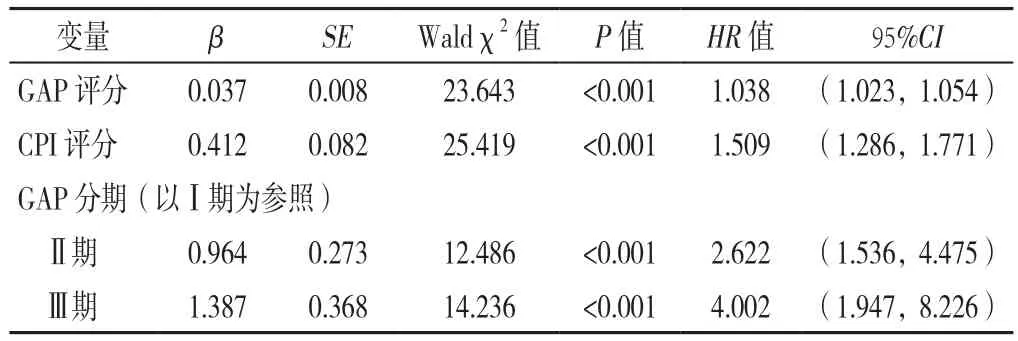
表3 IPF患者预后影响因素的Cox比例风险回归模型分析Table 3 Cox proportional-hazards regression analysis of factors potentially affecting the prognosis of IPF patients
2.2 GAP分期和CPI在总体以及不同时间点死亡率的AUC比较 GAP分期预测IPF患者1年内死亡率、2年内死亡率、3年内死亡率、总体死亡率的AUC分别为0.685〔95%CI(0.616,0.749)〕、0.675〔95%CI(0.606,0.740)〕、0.642〔95%CI(0.571,0.708)〕、0.668〔95%CI(0.598,0.733)〕;CPI预测IPF患者1年内死亡率、2年内死亡率、3年内死亡率、总体死亡率的AUC分别为 0.750〔95%CI(0.684,0.809)〕、0.745〔95%CI(0.679,0.804)〕、0.735〔95%CI(0.669,0.795)〕、0.745〔95%CI(0.679,0.804)〕。GAP分期与CPI预测IPF患者2年内死亡率、3年内死亡率、总体死亡率的AUC比较,差异均有统计学意义(Z=2.193,P=0.028 3;Z=2.918,P=0.003 5;Z=2.529,P=0.011 4);GAP分期与CPI预测IPF患者1年内死亡率的AUC比较,差异无统计学意义(Z=1.799,P=0.072 1),见图2。
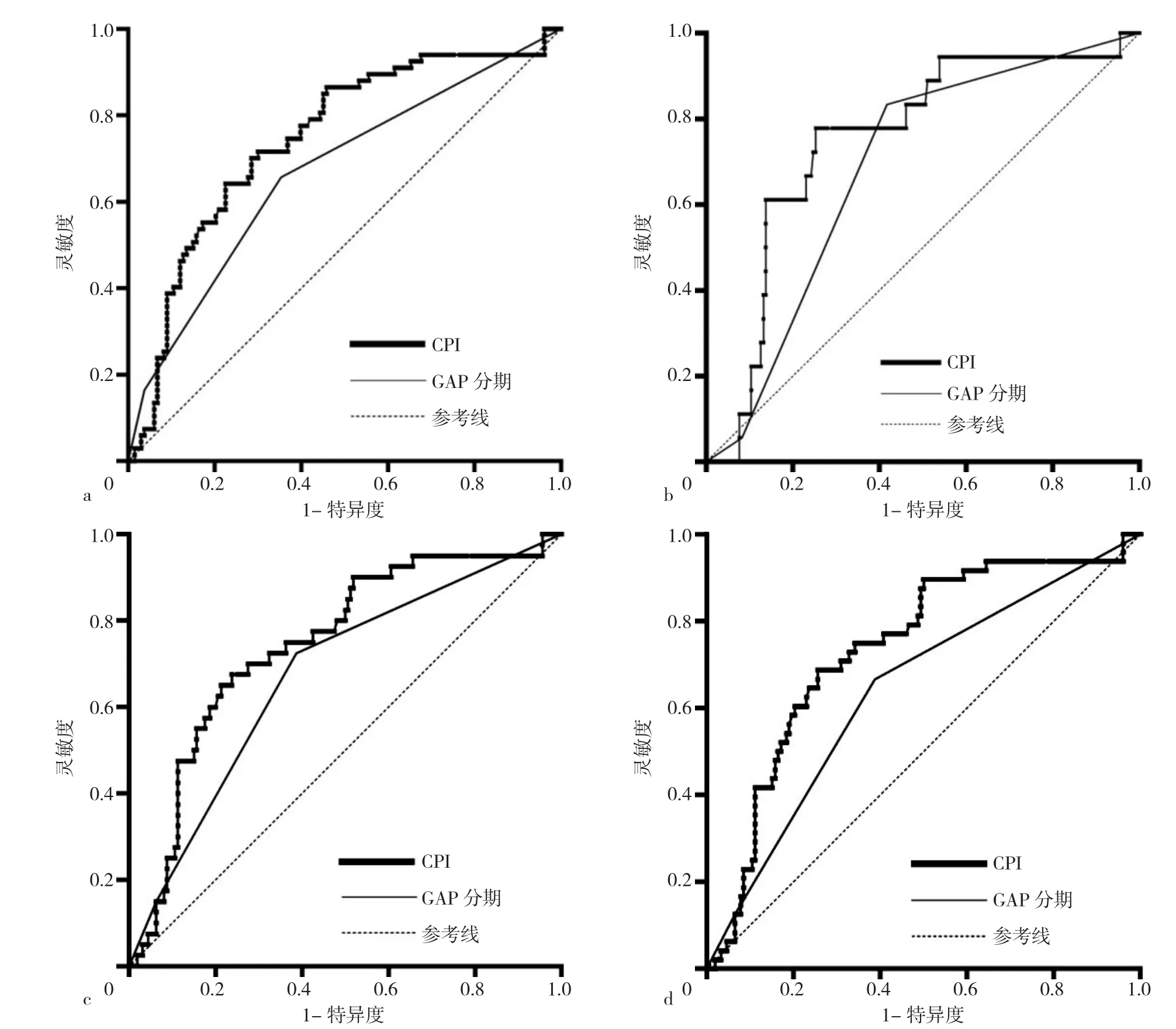
图2 GAP分期和CPI在总体以及不同时间点死亡率预测能力的受试者工作特征曲线Figure 2 ROC curve of GAP staging and CPI score in predicting the overall mortality and one-,two- and three-year mortality of IPF patients
3 讨论
IPF患者肺纤维化过程尚不完全清楚,自然病程变化大,如何更好地识别、预测疾病的进展,提高患者生命质量,给予临床医生更优的治疗决策是大家关注的话题。近年来,国内外陆续进行了一系列关于IPF患者疾病严重程度及死亡风险预测指标的探索研究,如HRCT得分、分子生物学标志物(金属蛋白酶7,表面活性剂蛋白A,CC趋化因子配体18)、长期肺功能指标变化等[10-11]。但这些预测模型涉及的因素复杂,需要耗费大量人力及物力,且有些预测指标尚未得到大规模病例研究的验证。2012年LEY等[7]基于多中心、回顾性队列研究结果建立的GAP模型(GAP,多维分析系统,GAP计算器)与2003年WELLS等[8]通过CT观察IPF疾病严重程度发现的CPI模型是两种简单易测的IPF患者临床预测模型。
在GAP模型中主要关注4个变量:性别、年龄、FVC %pred和DLCO%pred,其是一个二次风险评估系统,包括GAP计算器和GAP分期,通过GAP计算器确立GAP分值,使每个IPF患者的评估个体化,根据其分值的大小可迅速对患者病情严重程度做出分期。文献报道GAP分期一方面用于评估患者疾病风险,预测1~3年的死亡率;另一方面评估诊治手段的利弊,特别是患者肺移植前的死亡风险,有利于肺移植受体及时机的选择,合理利用供体,避免资源的浪费[7,12]。CPI模型整合了肺功能(FVC %pred、FEV1%pred、DLCO%pred)和HRCT影像特征,在制定过程中校正了肺气肿这一混杂因素[13],能更好地反映患者肺纤维化程度,临床实用性更强。这两种模型分别建立在不同的数据库基础上,哪一种模型更具有优势?其预测效能如何?目前尚无结论。所以本文在同一IPF患者数据库中对两种模型进行了比较。
由于IPF患者疾病严重程度主要体现在肺功能下降、缺氧加重及肺纤维化进展,即蜂窝肺形成[1],在比较时选取了GAP模型和CPI模型关联的临床参数,即有代表性的动脉血气指标、肺功能指标和HRCT肺纤维化(蜂窝肺、磨玻璃影)。本研究结果显示,不同GAP分期及CPI评分的患者FVC%pred、FEV1%pred、TLC%pred、DLCO%pred比较均有统计学差异;不同GAP分期患者PaO2、PaCO2、SaO2比较有统计学差异;不同CPI评分患者PaO2、SaO2比较也存在统计学差异,而对于PaCO2,可能由于校正了肺气肿的干扰没有显示出统计学差异。
本研究中GAP模型与CPI模型一致性较强,GAP分期越高者CPI评分越高。不同CPI评分分组的患者,在GAP分期中也存在统计学差异。GAP与CPI两模型均能很好地预测IPF患者的死亡率。GAP Ⅰ期、GAPⅡ期、GAPⅢ期患者死亡率分别为21.1%、44.0%、68.8%,不同CPI分期患者死亡率比较有统计学差异,此结果与相关循证医学证据一致[14],可作为IPF患者特定阶段下病情评估框架;CPI评分高低也显示出死亡风险的高低,评分越高者死亡风险越高,CPI评分≤41分与CPI评分>41分患者死亡率比较有统计学差异。单因素Cox比例风险回归模型结果显示,GAP评分和CPI评分均是影响IPF患者预后的独立因素。
本研究结果显示,CPI在总体以及不同时间点上的AUC均大于GAP分期,与LEE等[15]在韩国进行的一项大型队列研究结果一致。同时,本研究使用Medcalc软件比较两种模型预测效能,发现CPI在2年内死亡率、3年内死亡率以及总体死亡率的预测能力上明显优于GAP分期。这可能是因为GAP模型存在更多局限性:(1)GAP模型对DLCO%pred指标的依赖性更强,有研究显示DLCO采集时需要患者的高度配合且患者的肺容量需>1.2 L,易造成患者的选择偏倚[16];(2)GAP Ⅲ期患者易被低估,IPF患者病情进展快,很多患者在IPF诊断后可能会出现心力衰竭等严重合并症但在疾病评估时仅被归于GAP Ⅰ期或Ⅱ期,可能会降低预测的准确性[17]。另外,一项日本的回顾性研究也显示,GAP Ⅰ期或Ⅱ期的死亡率易被低估而影响模型的预测能力[18]。(3)GAP模型并未校正肺气肿的影响;同时,与CPI模型争议多基于肺气肿的校正上,有研究表明在过度校正肺气肿后,IPF患者的肺功能情况可能会被过高估计,从而影响IPF死亡率的真实性[19-20],也有研究认为合并肺气肿对IPF患者的生存没有显著影响[21]。而本研究结果提示,今后临床医生在实际工作中对IPF死亡风险进行预判时,可优先选择CPI模型。
综上所述,GAP分期和CPI均显示出较强地预测IPF患者死亡风险的能力,但CPI在总体死亡率、2年内死亡率、3年内死亡率的预测上明显优于GAP分期。然而本研究也存在一些局限性:本研究中初筛确诊的IPF患者409例,GAP分期与CPI均排除了未测和无法测量DLCO%pred的患者104例,在有完整临床指标的305例确诊的IPF患者中,105例(34.4%)失访和死亡时间缺失患者也一并被排除,可能会导致选择偏移,从而限制这两种模型的预测能力;同时本研究中两种预测模型的AUC仅为0.64~0.75,对于结果预测的准确性还有待考证。未来仍需开展大规模的前瞻性研究,探索并建立更为实用可行的IPF患者的死亡风险预测模型。
志谢:本文作者感谢李惠萍教授对论文的批评指导。
作者贡献:蔡博进行文章的构思与设计,统计学处理,结果的分析与解释,撰写论文;蔡博、陈娴秋、杨文兰、杨光红、黄劲、冯永红进行研究的实施与可行性分析;蔡博、陈娴秋、杨文兰、杨光红、黄劲、全华进行数据收集;蔡博、陈娴秋、杨文兰、全华进行数据整理;蔡博、陈娴秋、冯永红进行论文的修订;冯永红负责文章的质量控制及审校,对文章整体负责,监督管理。
本文无利益冲突。



