戴靖榕,李婕,何旭,李杨,李燕*
衰弱是老年人身体功能逐渐下降的一种特殊状态,其特点是肌力及耐力减弱、生理功能减退、机体易损性增加、抗应激能力下降等,并由此继发跌倒、失能、认知障碍、精神异常,甚至死亡等不良后果[1-2]。为识别高危老年人,FRIED 等[3]提出使用临床表型描述衰弱状态的特征,该表型包括5 个身体组成部分(即肌力下降、步行速度减慢、疲乏、身体活动量减少和无意识的体质量减轻),现已普遍应用于临床研究。
随着我国人口老龄化加剧,老年衰弱问题日益严峻,而当前关于衰弱的诊断依据不客观、发病机制不清楚、干预方式不健全,因此,当前对衰弱的研究仍处在初级阶段。既往多数研究探讨了与老年综合征相关的症状,如认知功能、日常活动能力、焦虑抑郁等,尚缺乏25-羟维生素D〔25(OH)D〕、白介素(IL)-6 与老年衰弱的相关性研究。因此,本研究探讨老年衰弱与25(OH)D、IL-6 的相关性,以期为今后寻找老年衰弱的客观诊断依据及干预方法奠定基础。
1 对象与方法
1.1 研究对象 选取2020 年11 月至2021 年4 月在云南省第一人民医院老年医学科住院的慢性疾病稳定期老年患者152 例为研究对象。纳入标准:(1)年龄≥60 岁,无新发疾病的住院复查患者;(2)无沟通障碍,能够配合完成老年综合评估(CGA);(3)自愿参加本研究并签署知情同意书。排除标准:(1)近1 个月有服用维生素D 及抗炎相关药物者;(2)近期存在急性感染性疾病者;(3)严重的躯体疾病或精神疾病,即不能配合完成Fried 量表评估及存在沟通障碍者;(4)长期卧床或病情不稳定者;(5)评估量表或实验室数据信息不全者。本研究通过云南省第一人民医院医学伦理委员会审批后实施(编号:KHLL2021-KY034)。
1.2 数据收集
1.2.1 一般资料 收集患者一般资料,包括年龄、性别、身高、体质量、体质指数(BMI)、文化程度、食物或药物过敏史、视力下降、听力下降、有无义齿、婚姻状况、饮食习惯、睡眠时间、是否服用助眠药、当前吸烟(指调查前30 d 内吸过烟)、当前饮酒(指调查前30 d内饮过酒)情况。
1.2.2 老年综合评估 “老年综合评估系统软件平台(住院版)”是云南省第一人民医院老年医学科自主研发的软件,其由多个国家通用评估量表构成,具有一定的智能化,可根据每项评估选项自动计算得分并给出评估结果(根据各通用量表制定的准则及参考范围得出),评估人员可通过微信小程序或计算机收集患者资料,后期可自动生成Excel 表格进行数据汇总。评估人员由接受过“老年综合评估系统”软件培训的老年科医师进行评估,评估内容主要包括营养状态评估:采用微型营养评估量表(MNA-SF),即≥24 分为营养良好,17~<24分为潜在营养不良,0~<17 分为营养不良。认知功能评估:采用简易智力状态检查量表(MMSE),即0~9 分为重度障碍,10~20 分为中度障碍,21~26 分为轻度障碍,27~30 分为认知正常。焦虑抑郁评估:采用老年抑郁量表(GDS-15)评估,分值≥6 分时提示为焦虑抑郁状态。抑郁状态评估:采用抑郁自评量表(SDS)评估,临界值为T 分50 分,<50 分为无抑郁状态,≥50 分为抑郁状态。焦虑状态评估:采用焦虑自评量表(SAS)评估,<50 分为无焦虑状态,≥50 分为焦虑状态。日常生活能力评估:采用基本生活活动能力(BADL)量表评估,即91~100 分为日常生活功能良好,61~90 分为轻度功能障碍,41~60 分为中度功能障碍,21~40 分为重度功能障碍,0~20 分为完全残疾。工具性生活能力评估:采用工具性日常生活活动能力(IADL)量表评估,主要评估能否上街购物、外出活动、食物烹调、家务维持、洗衣服五项内容,存在3 项及以上需要协助者即为失能。睡眠状况评估:采用阿森斯失眠量表(AIS)评估,即0~3 分为睡眠良好,4~6 分为潜在失眠,7~24 分为失眠。跌倒风险评估:采用Morse 跌倒风险评估量表,即0~24 分为低度风险,25~44 分为中度风险,≥45 分为重度风险。平衡功能评估:采用Tinetti 平衡及步态量表评估,即<15 分表示有跌倒风险,15~<24 分表示平衡功能障碍,≥24 分表示躯体功能良好。疼痛评估:采用视觉模拟法评估,即0 分无疼痛,1~3 分为轻度疼痛,4~6 分为中度疼痛,7~10 分为重度疼痛。尿失禁评估:采用尿失禁问卷表简表(ICI-Q-SF)评估,即0 分为无症状,1~7 分轻度尿失禁,8~14 分为中度尿失禁,15~21 分为重度尿失禁。便秘评估:采用Roma Ⅲ量表,即≥2 分为便秘。有无跌倒(近1 年内)、慢性病数量、多病共存(患有≥2 种疾病)、多重用药(口服用药≥5 种)、用药数量等;衰弱的评估见表1。

表1 Fried 量表内容Table 1 Contents of the Chinese version of Fried
1.2.3 实验室检查 采集住院老年患者6:00~8:00 空腹静脉血约30 ml 送本院检验科进行化验,采用自动分析仪(仪器为湘仪L1550,离心转速为3 500 r/min,离心时间5 min,离心半径15.7 cm)检测相关指标,检测内容主要包括:白细胞计数(WBC)、红细胞计数(RBC)、血红蛋白(Hb)、血小板计数(PLT)、中性粒细胞分数(NEUT)、C 反应蛋白(CRP)采用仪器法;天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)采用速率法;三酰甘油(TG)采用去游离甘油法;总蛋白(TP)采用双缩脲法;白蛋白(ALB)采用溴甲酚绿法;总胆固醇(TC)采用胆固醇氧化酶法;高密度脂蛋白(HDL)、低密度脂蛋白(LDL)采用清除法;血钠(Na+)、血钾(K+)、血氯(Cl-)采用离子选择电极法;肌酐(Cr)、糖化血红蛋白(HbA1c)采用酶法;尿素氮(BUN)采用脲酶紫外速率法;尿酸(UA)采用酶比色法;血钙(Ca2+)采用偶氮胂Ⅲ法;空腹血糖采用己糖激酶法;果糖胺采用四氮唑蓝法;促甲状腺激素(TSH)、三碘甲状腺原氨酸(T3)、甲状腺激素(T4)、游离三碘甲状腺原氨酸(FT3)、游离甲状腺激素(FT4)、铁蛋白、维生素B12、叶酸、25(OH)D、雌二醇、睾酮、同型半胱氨酸(Hcy)、空腹胰岛素(FINS)采用电化学发光法;活化部分凝血活酶时间(APTT)、凝血酶原时间(PT)、凝血酶时间(TT)、D-二聚体(DD2)采用磁珠法或免疫比浊法;肿瘤坏死因子(TNF)、IL-10、IL-6、IL-12P70、IL-1、IL-8 采用化学发光法。
1.2.4 数据质量控制 (1)评估医师必须通过“老年综合评估系统软件平台(住院版)”培训、考核。(2)数据不完整或数据前后矛盾时视为无效数据,予以排除。
1.3 统计学方法 采用SPSS 23.0 软件进行统计学分析,符合正态分布的计量资料以(±s)表示,三组间比较采用单因素方差分析;非正态分布的计量资料以M(P25,P75)表示,多组间比较采用Kruskal-Wallis 检验。计数资料以相对数表示,组间比较采用χ2检验。慢性疾病稳定期老年患者衰弱的影响因素分析采用多因素Logistic 回归分析。以P<0.05 为差异有统计学意义。
2 结果
152 例患者中,无衰弱47 例(30.9%)、衰弱前期51 例(33.6%)、衰弱期54 例(35.6%)。
2.1 不同程度衰弱患者一般资料和老年综合征比较不同程度衰弱患者性别、身高、体质量、BMI、文化程度、食物或药物过敏史、有义齿、离异/丧偶、饮食习惯、睡眠时间、服用助眠药、当前吸烟、当前饮酒、存在焦虑状态、近1 年内跌倒、疼痛、尿失禁、便秘、多病共存情况比较,差异均无统计学意义(P>0.05);不同程度衰弱患者年龄、视力下降、听力下降、营养状况、认知功能、存在焦虑抑郁状态、存在焦虑状态、日常生活能力、失能、睡眠情况、跌倒风险、平衡功能、慢性病数量、多重用药、用药数量比较,差异均有统计学意义(P<0.05),见表2。
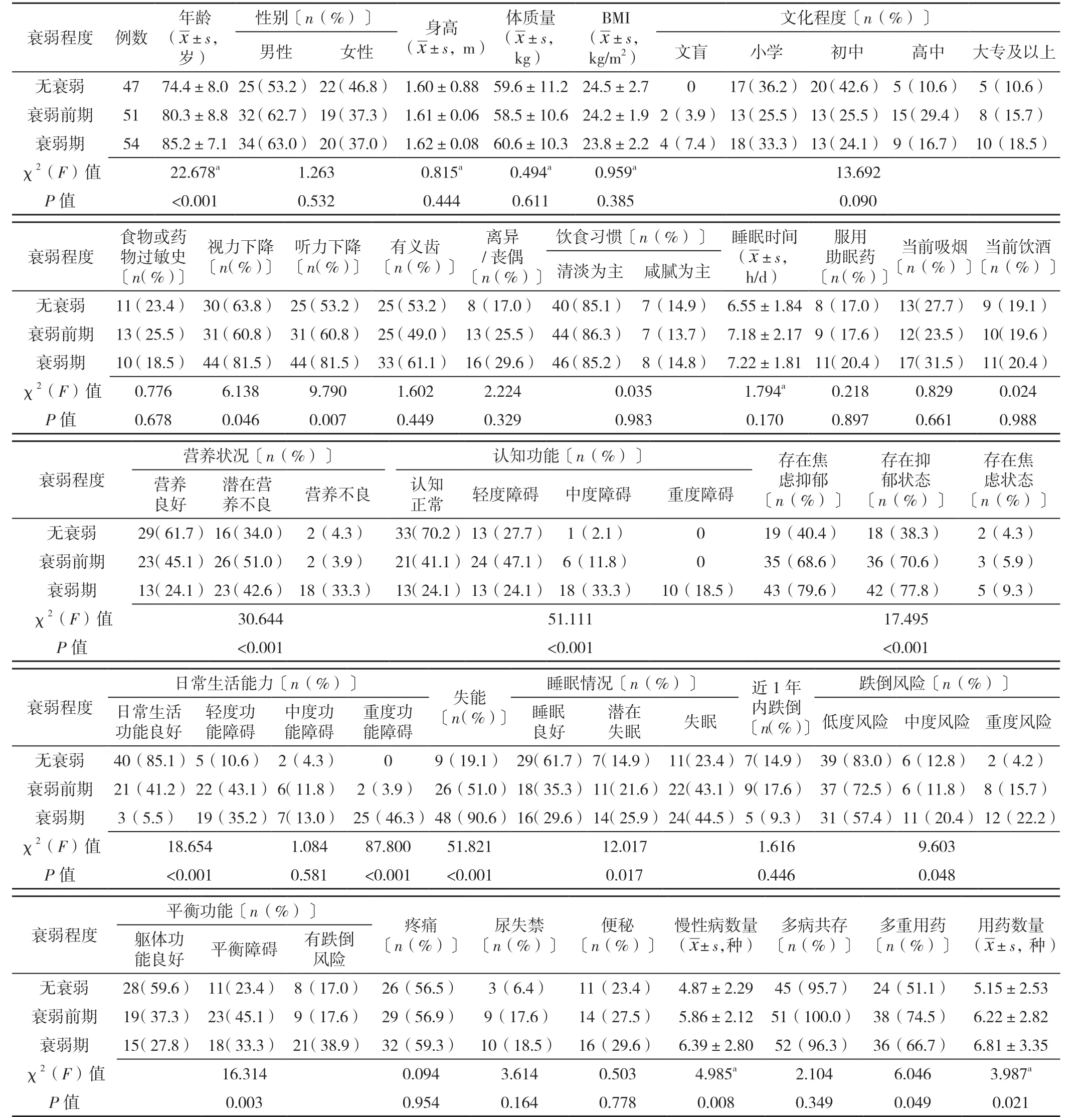
表2 不同程度衰弱患者一般资料和老年综合征比较Table 2 Comparison of clinical data and geriatric syndromes in participants by level of frailty
2.2 不同程度衰弱患者实验室检查指标比较 不同程度 衰 弱 患 者WBC、RBC、PLT、NEUT、CRP、AST、TG、TP、TC、HDL、LDL、K+、Cr、HbA1c、BUN、UA、Ca2+、空腹血糖、果糖胺、TSH、T3、T4、FT3、FT4、铁蛋白、维生素B12、叶酸、睾酮、FINS、TT、TNF、IL-10、IL-12P70、IL-1 比较,差异均无统计学意义(P>0.05);不同程度衰弱患者Hb、ALT、ALB、Na+、Cl-、25(OH)D、 雌 二 醇、Hcy、APTT、PT、DD2、IL-6、IL-8 水平比较,差异均有统计学意义(P<0.05),见表3。
2.3 二元Logistic 回归分析 将慢性疾病稳定期老年患者是否衰弱作为因变量(赋值:1=无衰弱,2=衰弱前期+衰弱期),将表1~2 中差异有统计学意义(P<0.05)的变量作为自变量〔年龄(赋值:实测值)、视力(赋值:0=正常,1=下降)、听力(赋值:0=正常,1=下降)、营养状况(赋值:0=营养良好,1=潜在营养不良,2=营养不良)、认知功能(赋值:0=认知正常,1=认知障碍)、焦虑抑郁状态(赋值:0=无焦虑抑郁状态,1=有焦虑抑郁状态)、抑郁状态(赋值:0=无抑郁状态,1=有抑郁状态)、日常生活能力(赋值:0=日常生活功能良好,1=日常生活功能障碍)、失能(赋值:0=未失能,1=失能)、睡眠状况(赋值:0=睡眠良好,1=潜在失眠,2=失眠)、跌倒风险(赋值:0=低度风险,1=中度风险,2=重度风险)、平衡功能(赋值:0=躯体功能良好,1=平衡功能障碍,2=有跌倒风险)、慢性病数量(赋值:实测值)、多重用药(赋值:0=无,1=有)、用药数量(赋值:实测值)、Hb(赋值:实测值)、ALT(赋值:实测值)、ALB(赋值:实测值)、Na+(赋值:实测值)、Cl-(赋值:实测值)、25-(OH)D(赋值:实测值)、雌二醇(赋值:实测值)、Hcy(赋值:实测值)、APTT(赋值:实测值)、PT(赋值:实测值)、DD2(赋值:实测值)、IL-6(赋值:实测值)、IL-8(赋值:实测值)〕,进行二元Logistic 回归分析,结果显示:失能、25-(OH)D、IL-6 是慢性疾病稳定期老年患者衰弱的独立影响因素(P<0.05),见表4。
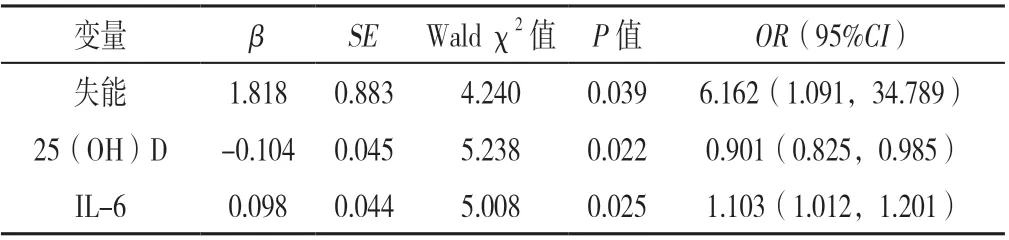
表4 慢性疾病稳定期老年患者衰弱的影响因素的二元Logistic 回归分析Table 4 Binary Logistic regression analysis of frailty in elderly chronic disease inpatients
3 讨论
3.1 老年衰弱的发生情况及独立相关因素 本研究结果显示,住院老年患者衰弱的总体发病率为35.6%(54/152),与国内赖小星等[4]、卫尹等[5]及国外研究[6]的老年住院患者衰弱发生率分别为31.3%、34.4%、35.4%的结果相近,高于王湾湾等[7]调查的老年住院患者衰弱发生率为25.1%的结果,但低于靳秋露等[8]研究发现的高龄老年患者(≥80 岁)衰弱发生率为41.6%的结果。造成患病率有差异的原因可能是评估工具、年龄、研究对象不同。但从总体来看,我国衰弱患病率不容乐观,鉴于衰弱可继发多种不良后果[1-2],因此,早期筛查、预防并干预可极大减少老年衰弱患病率及住院率。
据美国、墨西哥、澳大利亚等国家研究均表明维生素D 是衰弱的独立影响因素[9-11]。另外,国外一项包括13 项研究共计20 355 例研究对象,其在原始分析和敏感性分析中均显示了25(OH)D 水平与衰弱严重程度(Fried 的表型定义)之间存在明显的反向关系[12]。本研究结果均与以上研究结果一致。然而,据比利时一项≥75 岁社区妇女的横断面研究显示,低维生素D 水平与下肢肌力及握力之间没有关系[13]。造成这种明显差异的原因可能是来自比利时的研究仅针对≥75 岁的社区妇女,然而25(OH)D 易受到多种因素的影响,如性别、年龄、地域等,因此其结果可能存在一定的局限性。
据国外多项荟萃分析显示,衰弱及衰弱前期与较高水平的CRP、IL-6 有关[14-15]。同样,最近一项纳入23 910 例老年人的荟萃分析显示,衰弱及衰弱前期与较高水平的炎性因子相关,尤其是CRP 和IL-6[16]。本研究与以上研究结果基本相似,虽然在本研究中,CRP不是衰弱的独立危险因素,但单因素比较仍具有统计学意义(P<0.05),造成这方面的差异原因可能是本研究样本量相对较少,其次本研究入选对象为慢性疾病稳定期的老年患者,而CRP 作为急性期反应物[17],在多种病理生理条件下均可能升高,因此,这种非特异性炎性标志物不一定与衰弱相关[18]。
3.2 25(OH)D、IL-6 与老年衰弱 25(OH)D 是维生素D 的主要循环代谢物,是全球公认的反映维生素D状态的标志物。维生素D 缺乏多合并肌肉衰弱[19]。由于维生素D 受体(VDR)分布于皮肤、肌肉等多个靶器官[20]。一方面VDR 作为核受体介导的基因效应,即VDR 与1,25 二羟维生素D〔1,25-(OH)2D〕结合,引起肌肉纤维的增殖和分化,另外也可影响相关蛋白质的合成;另一方面VDR 也可通过非核受体介导的非基因效应,激活可以诱导MAP 激酶、磷脂酶C 的信号转导通路,使大量钙离子快速流入细胞,影响肌肉收缩[21-22]。因此,25(OH)D 缺乏导致衰弱的可能机制:(1)影响肌肉力量,导致握力下降[23-24];(2)减少肌肉细胞的发育,最终导致无意识的体质量减轻[25]。此外,维生素D 缺乏也可继发甲状旁腺功能亢进引发骨溶解,导致骨质疏松,甚至骨折的发生,而骨折能加剧衰弱和骨质疏松的进展,导致失能、残疾等不良事件的发生。
IL-6 水平随着年龄的增长而升高[14],高IL-6 既可作为肌少症发生的预测因子,也可作为衰弱、肌少症等产生不良结果的预测因子,如失能、功能下降甚至死亡等[26]。IL-6 可抑制TNF-α 和IL-1β 并诱导CRP、纤维蛋白原及其他急性期反应物的产生[14];同时还可间接降低机体生长激素(GH)和胰岛素样生长因子1(IGF-1)水平,减少蛋白质合成而导致肌少症。另外,血清IL-6、CRP 水平升高与握力降低亦具有关联性[27]。MA 等[28]纳入了130 例老年人的研究显示,IL-6 与衰弱老年人的力量和步态速度呈负相关;在调整了年龄和性别后,IL-6 水平与老年人的运动耐量亦呈负相关,因此,其建议IL-6 可作为功能下降和衰弱的生物标志物。
以上研究均提示高水平IL-6 与老年衰弱相关,而维生素D 缺乏可参与炎症和免疫系统激活[29]。有研究认为,补充维生素D 可降低外周血IL-6 水平,并抑制外周血单核细胞、巨噬细胞和T 细胞产生IL-6[30-31],同时上调抗炎性因子(如IL-10)和炎症抑制分子的表达[32]。
3.3 维生素D 对老年衰弱的干预 一些相关的流行病学研究认为,维生素D 在维持或改善老年人的肌力、功能、体能表现及保持独立性方面具有潜在的作用[33]。国外研究发现,通过钙和维生素D 的联合补充可减少骨折发生率及跌倒风险[34-36]。另外,一项包含5 615名参与者的随机对照试验表明,维生素D 补充剂对基线时的整体肌肉力量仅有轻微的改善,而对维生素D缺乏的患者却有明显的改善作用[37]。相对于成年人,老年人补充维生素D 可能需要更长的时间或更大的剂量才能对肌肉产生有益影响[38],并减缓衰弱进展[39]。但据CUMMINGS 等[40]证实,补充大剂量的维生素D也可能增加跌倒的风险。因此,关于维生素D 补充的理想临界值也成为一个值得注意的问题。据美国医学研究所建议25(OH)D>50 nmol/L(20 μg/L)[41]便满足人体所需;而美国内分泌学会却设定了>72.5 nmol/L 为充足阈值,52.5~72.5 nmol/L 为不足阈值,<50 nmol/L 为缺乏阈值[42]。由此可见,关于老年人通过补充维生素D 来干预老年衰弱在剂量临界值上还需进一步探讨。
本研究局限性:
首先,本研究为横断面研究且样本量较小,不能直接探讨25-羟维生素D、白介素6 与衰弱之间的因果关系;其次,本研究为单中心研究,存在一定的地域局限性;最后,本研究对象为慢性疾病稳定期的住院老年患者,不能代表整个老年群体。
4 总结
住院老年患者中,老年衰弱患病率不容乐观,及早筛查、诊断并干预显得尤为重要;此次研究发现25(OH)D、IL-6 与慢性疾病稳定期老年患者衰弱独立相关,即25(OH)D 是慢性疾病稳定期老年患者衰弱的保护性因素,IL-6 是慢性疾病稳定期老年患者衰弱的危险性因素。因此,25(OH)D、IL-6 有望成为慢性疾病稳定期老年患者衰弱的预测因子或诊断衰弱的客观生物学指标。另外,补充维生素D 可能有助于预防或延缓老年衰弱,但关于维生素D 的补充剂量还需进一步探讨。
作者贡献:戴靖榕进行文章的构思与设计,结果的分析与解释,撰写论文;李燕进行研究的实施与可行性分析,负责文章的质量控制及审校;李婕、何旭、李杨进行数据收集;何旭、李杨进行数据整理及录入;李婕进行统计学处理,论文的修订;戴靖榕、李燕对文章整体负责,监督管理。
本文无利益冲突。



