王少堃,王世强*,王一杰,胥祉涵
抑郁症是常见的精神疾病之一,患者常表现出明显的持久性情绪低落、兴趣减退甚至悲观厌世、企图自杀等临床症状,可诱发肥胖、心血管疾病等并发症,对患者的身心健康及生活质量构成严重威胁。流行病学调查显示,目前我国抑郁症患者超9 500 万,抑郁症终身患病率为6.9%,年发病率为3.6%[1]。抑郁症也是全球范围内主要致残性疾病之一,预计到2030 年其造成的经济负担将升至世界首位[2],因此抑郁症的防治目前仍是我国乃至世界公共卫生的重要课题之一。
尽管随着医疗水平的进步,临床治疗抑郁症的手段越发多样化,但基本局限于传统药物治疗、心理疗法两大类,且疗效并不理想。药物是最常用的传统治疗手段,一项临床研究发现,只有约一半的抑郁症患者在经药物治疗后症状有明显改善,而高达1/3 的患者在多次药物治疗后症状仍未有明显改善[3],且药物治疗常伴有一系列不良反应,如失眠、体质量增加、头痛或恶心。心理疗法虽无药物不良反应,但其治疗耗时长,并且对患者的经济能力有较高要求,所以患者常难以坚持治疗。因此,目前临床仍迫切寻求预防、治疗抑郁症的新方法。
运动是促进身心健康的有效方式,并且对部分疾病的治疗能起到积极影响。运动疗法是指通过某些运动方式,使患者获得全身或局部运动功能、感觉功能等恢复的训练方法,具有操作性强、依从性高、不良反应少、适用人群广等优势。近年来多项研究表明,运动在预防、治疗抑郁症方面均具有良好的效果[4-5]。但运动疗法治疗抑郁症患者的相关研究证据较为琐碎,需进行系统性地整理与归纳。本文通过总结既往有关运动疗法对抑郁症影响的最新研究成果,阐述运动类型、运动强度、运动频率和运动量对不同人群抑郁症干预效果的影响,并在简要解析诱发抑郁症的神经生物学机制的基础上,结合既往研究得出的运动对神经元可塑性、神经分泌系统功能、机体的炎性反应和氧化性应激等的调控作用,整合并梳理运动疗法治疗抑郁症的可能机制,弥补抑郁症运动处方制订时理论依据缺乏的空白,为临床治疗抑郁症提供新的思路。
1 本文文献检索策略
计算机检索PubMed、Web of Science、中国知网(CNKI)等数据库,检索时间设定为建库至2022 年2 月,中文检索词包括“运动”“抑郁症”“神经系统”“炎症”“氧化应激”,英文检索词包括“exercise”“depression”“nervous system”“inflammation”“oxidative stress”。纳入标准:文献内容涉及运动对抑郁症的影响、抑郁症发生的神经生物学机制和运动抗抑郁的机制。排除标准:与本文主题无关联、质量差、无法获得全文的文献。最终纳入文献75 篇。
2 运动对抑郁的影响
2.1 运动类型对抑郁症的影响 美国运动医学会制订的《ACSM 运动测试与运动处方指南》(第10 版)[6]指出,常见的运动类型主要包括有氧运动和抗阻运动两类。
2.1.1 有氧运动对抑郁症的影响 有氧运动指人体在氧气供应充分的情况下进行的运动,规律的有氧运动可有效改善不同年龄段抑郁症患者的症状。SONG 等[7]研究表明,有氧运动能有效改善大学生的抑郁症状。华正春等[8]利用瑜伽和太极拳运动对健康大学生进行运动干预研究,结果发现长期的身心练习能明显改善大学生的焦虑、抑郁和压力等负面情绪,并可有效提高其正念水平。另一项研究显示,改善青少年的心肺适能(cardiorespiratory fitness,CRF)对缓解抑郁、焦虑等具有积极的影响[9]。OLSON 等[10]研究发现,8 周中等强度的有氧运动能明显改善成年重度抑郁症(major depressive disorder,MDD)患者的认知控制能力和抑郁症状,这与OERTEL-KNÖCHEL 等[11]的研究结果一致。且对产后抑郁妇女和老年抑郁患者来说,有氧运动也不失为一种改善自身生活质量、减少焦虑和抑郁等负面情绪的有效方法[12-13]。有研究发现,有氧运动在治疗部分疾病方面比抗阻运动效果更佳,KWOK 等[14]研究表明,对于轻至中度帕金森病患者,8 周的瑜伽运动比伸展和抗阻训练能更有效地改善其运动功能障碍,缓解患者焦虑和抑郁症状并提高其生活质量。
2.1.2 抗阻运动对抑郁症的影响 抗阻运动指肌肉在克服外界阻力时所进行的运动。有研究指出,抗阻运动可改善患者抑郁症状,且患者肌肉力量与其抑郁程度呈负相关[15]。但一项Meta 分析表明,抗阻运动虽然能明显缓解成年患者的抑郁症状,不过其缓解效果与患者的运动总量、健康水平和力量改善程度的相关性并不明显[16]。在一些研究中抗阻运动显示出了良好的抗抑郁效果,如KHORVASH 等[17]发现抗阻运动可有效改善大学生患者的焦虑和抑郁情绪并降低其机体促炎细胞因子的水平。LECHEMINANT 等[18]对产后抑郁妇女进行为期18 周的抗阻运动干预,结果显示患者抑郁情绪明显减少,自我效能感增加。对老年人进行为期4 个月的抗阻运动干预发现,干预后的老年人抑郁症状明显减轻,且抗阻运动干预效果与传统抗抑郁治疗效果相比差异不明显[19]。然而有部分报道指出,抗阻运动对抑郁症患者的症状改善效果不佳。GORDON 等[20]对患有慢性疲劳综合征的青少年分别进行持续4 周的有氧运动和抗阻运动干预,结果发现只有有氧运动能改善患者的疲劳程度和抑郁症状,而抗阻运动并未体现出该效果。PENNINX 等[21]研究也发现,有氧运动可明显改善老年人的抑郁症状,而抗阻运动对抑郁症无明显改善效果。DORNER 等[22]也发现了抗阻运动虽然可以改善老年人的认知功能,但对抑郁情绪没有明显的作用。这些研究结果的不一致可能是由研究设计不同导致的,部分研究者考虑到老年人和肌肉功能障碍患者等特殊人群的健康状况,选择进行强度小、周期短的抗阻运动干预,相比于年轻、健康的受试者而言,其运动依从性较差,难以坚持定期运动,因此对其抑郁症的改善效果也不明显[23-24]。
上述研究表明,有氧运动可能是防治抑郁症更为有效的干预方式,抗阻运动虽然在某些试验中显示出良好的抗抑郁效果,但其结论仍存在争议,需进一步研究验证,详见表1。
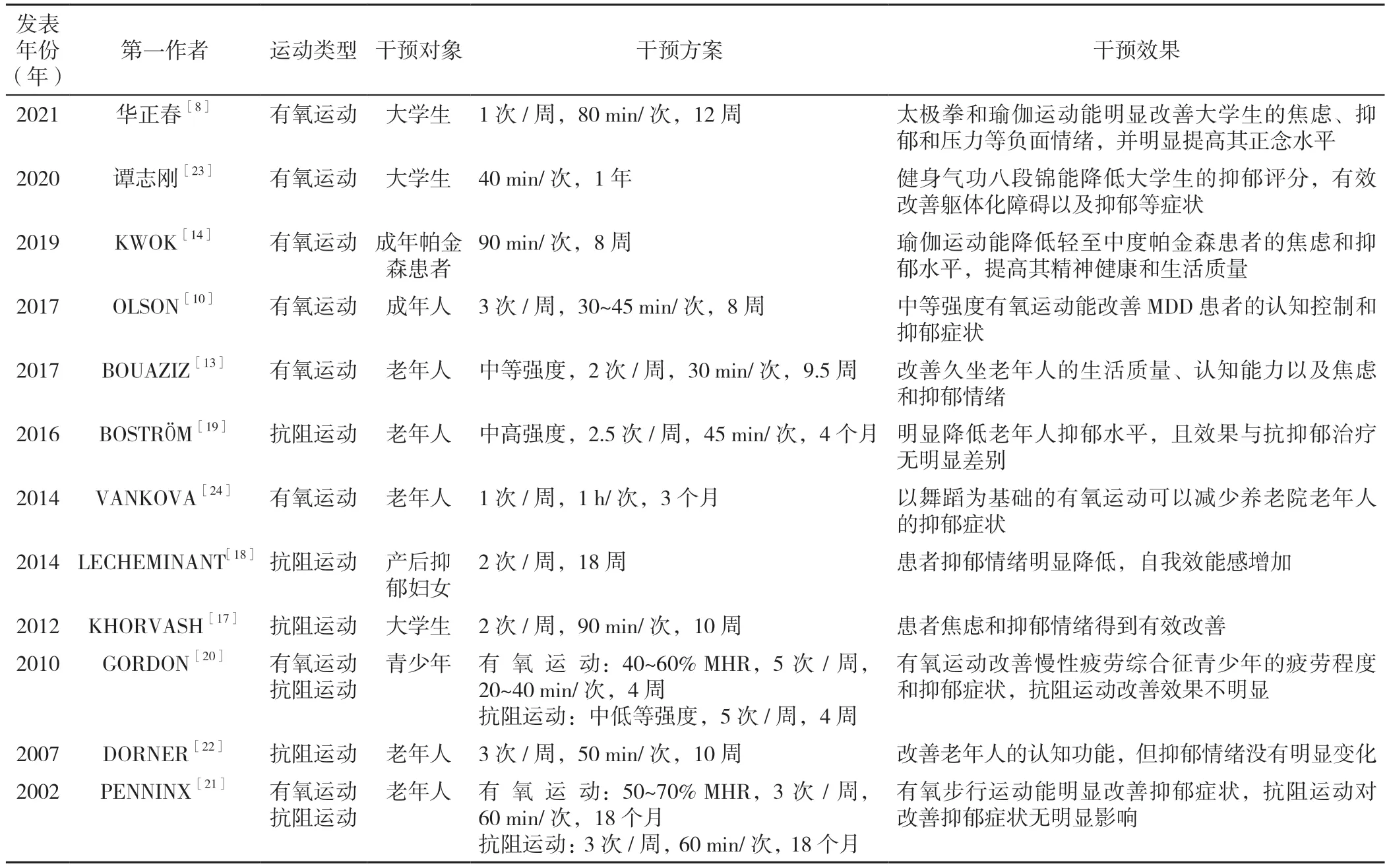
表1 不同运动类型对不同人群抑郁症干预的效果汇总Table 1 Summary of the effect of different exercise types on depression in different groups
2.2 运动强度、运动频率及运动量对抑郁症的影响
2.2.1 运动强度对抑郁症的影响 运动强度是制订运动处方的关键要素,对于不同年龄阶段的患者而言,不同的运动强度有不同的干预效果。PAOLUCCI 等[25]对患有抑郁症的大学生分别进行了为期6 周的高强度间歇训练和中等强度连续训练,结果显示,中等强度连续训练明显减少了患者的抑郁症状,而高强度间歇训练虽然能改善患者的抑郁症状,但却提高了其感知压力及机体促炎细胞因子的水平。NORRIS 等[26]研究发现,与中等强度〔50%~60% 最大心率(MHR),即运动时心率达到MHR 的50%~60%〕的有氧运动相比,高强度(70%~75% MHR)的有氧运动减少儿童、青少年抑郁和焦虑情绪的效果更加明显。BALCHIN 等[27]对成年抑郁患者分别进行持续6 周、3 次/周不同强度的干预,结果显示中等强度和高强度的有氧运动均可明显改善患者的抑郁症状,而低强度的有氧运动对患者抑郁症状的改善效果并不明显。另有研究指出,中等强度的运动可以大幅减少老年患者的抑郁症状,而剧烈运动则没有明显效果[28]。从目前的研究结果来看,在抑郁症的运动干预中,中等强度和高强度的有氧运动配合力量训练和各种协调锻炼通常比单一的低强度运动更加有效。对于不同的人群而言,其适合的运动强度应在制订干预措施时加以考虑。但相比于制订特定运动强度,制订一个患者能长期坚持的运动处方可能更加重要。
2.2.2 运动频率对抑郁症的影响 BLUMENTHAL 等[29]研究发现,为期4 个月、强度为70%~85% MHR、频率3 次/周的有氧运动能明显减少MDD 患者的抑郁症状,其效果与药物治疗相同。在LEGRAND 等[30]的随机对照试验中,当运动强度控制在60%~80% MHR 时,与每周只进行1 次的低频率运动相比,每周进行3~5 次的高频率运动对成年抑郁患者症状的改善程度更加明显。KEKÄLÄINEN 等[31]将经过了3 个月抗阻训练的老年抑郁患者随机分为4 组:训练组每周1 次(RT1)组、每周2 次(RT2)组和每周3 次(RT3)组及对照组,对训练组的患者进行6 个月抗阻训练,运动频率分别为每周1、2 和3 次,训练结束后评估患者的生活质量和抑郁症状,结果显示RT1 组患者的生活质量较RT2 组和RT3 组降低,RT2 组患者的生活质量提高、抑郁症状改善。也有学者发现,频率为3次/周的有氧运动有利于改善轻度认知障碍老年人的认知功能、生活质量以及抑郁情绪[32]。一项探讨有氧运动对老年人心理调适应用效果的研究显示,持续8 周、3~4 次/周的有氧运动能使老年人的抑郁水平随干预时间的增加呈明显下降趋势[33]。
总体而言,虽然单因素运动频率对抑郁症影响的相关研究尚有欠缺,但现有研究结论一致认为高频率运动对预防和治疗抑郁症的效果更佳,详见表2。

表2 运动强度、运动频率对不同人群抑郁症干预的效果汇总Table 2 Summary of the effect of exercise intensity and exercise frequency on depression in different groups
2.2.3 运动量对抑郁症的影响 HUGHES 等[37]研究发现,12 周剧烈的有氧运动(>12 kcal·kg-1·周-1)可使青少年MDD 患者的症状得到明显改善。DUNN 等[38]的随机对照试验发现,与低剂量(≤7 kcal·kg-1·周-1)运动相比,高剂量(≥17.5 kcal·kg-1·周-1)的有氧运动改善成年MDD 患者的抑郁症状更加有效。一项利用国际体力活动量表和抑郁量表探究健康成年人运动量与抑郁关系的研究发现,当运动量为1 200~3 000 能量代谢当量(metabolic equivalent of energy,METs)-min/周时可明显降低抑郁症的发生风险;运动量达到1 200~1 800 METs-min/周的成年人,其抑郁症的发生风险降低10%;当运动量达到1 800~3 000 METs-min/周时,抑郁症的发生风险降低14%;而当运动量超过3 000 METs-min/周时,抑郁症的发生风险降低情况并不明显[39]。另一项研究显示,若每周进行至少1 h 的运动锻炼,可使成年受试者的抑郁症发生率降低12%[40]。CHANG 等[41]对老年抑郁患者分别进行4 种不同剂量的有氧运动干预:(1)3 次/周,15 min/次;(2)3 次/周,30 min/次;(3)6 次/周,15 min/次;(4)6 次/周,30 min/次。结果显示,即使是最小剂量(3 次/周,15 min/次)的有氧运动也能明显减少老年患者的抑郁症状,且干预效果与其他运动量相比并没有明显差异。TRIVEDI等[42]研究了12 周高强度步行(16 kcal·kg-1·周-1)和低强度步行(4 kcal·kg-1·周-1)对抑郁症的影响,结果显示这两种强度的运动均可明显改善患者的抑郁症状,高强度运动效果更佳。
综上所述,即便目前对运动量与抑郁症干预效果之间的“剂量-效应”关系还存在一定争论,但现有研究一致表明当运动频次为3~5 次/周、45~60 min/次,小剂量运动就能发挥出较好的抗抑郁效果,但高剂量运动可能会对抑郁症有更好的改善效果[43-44]。
3 运动抗抑郁的神经生物学机制
3.1 运动增强神经元可塑性 神经元可塑性指神经元在结构和功能上对内外环境刺激和损伤做出反应从而进行自我修复的能力,是维持神经系统发育和正常功能的重要生理特性。研究发现,情绪障碍个体和动物应激模型的神经元可塑性被破坏,而使用抗抑郁药物可增强神经元可塑性[45],表明神经元可塑性的改变会导致认知和情绪调控能力受损及神经系统疾病(如抑郁症的发生和发展)。神经元可塑性的改变主要由中枢神经系统组织的形态结构变化和神经营养因子的水平决定。
3.1.1 运动改善中枢神经系统组织的形态结构 研究发现,抑郁症患者中枢神经系统中的海马体、前额叶皮质(prefrontal cortical,PFC)、前扣带回皮质(anterior cingulate cortex,ACC)以及纹状体和眶额等部位的形态结构会出现异常,白质完整性受损[46]。海马体在机体的应激调节中发挥重要作用,是中枢神经系统发挥可塑性的关键部位,能通过调节丘脑-垂体-肾上腺轴(the hypothalamic-pituitary-adrenal axis,HPA 轴)的活动,并与其他边缘系统和前额叶区域建立联系,从而广泛地参与抑郁症相关的生理学过程[47]。
抑郁症患者大脑受影响最持久的区域是海马体,体积会减少约5%,这可能是由于抑郁症使患者海马体神经干细胞的增殖、分化及存活数量减少所导致[46]。运动可增大健康受试者海马体左右部分和皮质区域的体积,且增大幅度与CRF 呈正相关[47]。同时,研究发现12 个月的中等强度有氧运动干预(3 次/周)可使海马体体积增加约2%[45]。持续6 周(5次/周,30 min/次)的有氧运动即可增加受试者的海马体体积,但停止训练6 周后,受试者的海马体体积又恢复到基线水平[48]。提示若要通过增加海马体体积来缓解抑郁症,需要长期坚持有氧运动锻炼。
PFC 是大脑的控制和命令中心,其作用是处理感觉输入和执行调节运动。有研究发现,抑郁症患者的背前外侧PFC神经元平均体积较小且出结构异常,如神经元顶端树突分支数量减少和长度明显缩短[49]。ACC 是脊髓上中枢边缘系统的重要结构,参与情绪的调控。抑郁症患者ACC 和颞叶等结构的体积明显减小,这是由ACC 腹侧到胼胝体以及相应皮质组织的灰质减少所导致的[50]。运动干预能使抑郁症患者PFC和ACC 的体积增大,代谢功能得到改善,且其体积增大幅度与CRF 呈正相关,CRF 的提高还可以促进白质完整性,并延缓由年龄增长所导致的PFC 和ACC 体积的缩小[51]。此外,研究还发现抑郁症患者的额叶皮质和后扣带回皮质等结构的灰质体积与其体能密切相关,运动在提升患者体能的同时,能够明显增大其灰质体积[51]。
上述研究表明,运动能够降低海马体细胞凋亡率,促进海马体细胞生长,增大海马体体积、PFC 和ACC 的灰质体积,促进白质完整性,从而增强神经元可塑性,提高患者的学习记忆能力与情绪调控能力,进而发挥抗抑郁作用。
3.1.2 运动提高神经营养因子的水平 神经营养因子是调控神经元可塑性的关键递质,与抑郁症的发病机制和应激反应密切相关,其主要包括脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、胰岛素样生长因子1(insulinlike growth factor,IGF-1)以及血管内皮生长因子(vascular endothelial growth factor,VEGF)。BDNF 是发挥神经元可塑性的重要调节因子,对神经元的生长与存活至关重要。IGF-1是一种细胞增殖调控因子,能诱导细胞增殖分化,在调节神经系统的结构与功能中发挥关键作用。VEGF 是一种能够刺激大脑内皮细胞增殖,促进大脑血管生成的生长因子,在常氧条件(指O2浓度为19.5%~23.5%的环境)下对神经元的生长、成熟和增殖具有积极作用[52]。临床研究发现,抑郁症患者脑内BDNF、IGF-1 和VEGF 的表达量均明显降低,当注射上述神经营养因子至海马体体内时,能增强海马体的神经发生,使抑郁症状得到缓解[53]。抑郁动物模型亦表明,神经营养因子的缺失会破坏突触可塑性,降低海马体新生细胞存活率,导致大脑总体积和海马体体积减小[54]。
研究表明,受试者的BDNF、IGF-1 和VEGF 水平在运动后均有所提高,而在各种神经营养因子中,运动提高BDNF水平的作用最明显[55]。经有氧运动干预后,MDD 患者外周BDNF 水平有所提高,且提高幅度与患者运动强度呈正相关[56]。运动可通过促进BDNF 的表达,提高海马体以及皮质区域BDNF 的水平,从而促进海马体神经元的新生、存活和分化,改善海马体的结构和功能,进而增强认知功能,提高学习记忆与情绪调控能力,达到抗抑郁效果[57]。IGF-1 水平的提高可诱导海马体BDNF 表达上调,并促进神经元增殖和分化,从而增强神经元可塑性。VEGF 则通过调控大脑血管内皮细胞的增殖、分化和迁移,提高血管内皮细胞的通透性,进而促进大脑血管生成和神经发生。若阻断IGF-1 和VEGF进入大脑,则会削弱运动对海马体神经发生的诱导作用[58]。
3.2 运动改善神经分泌系统功能 HPA 轴是神经分泌系统的重要组成部分,参与个体的情绪和认知调节。临床研究发现,抑郁症患者通常患有HPA 轴功能障碍,表现为皮质醇〔一种糖皮质激素(glucocorticoid,GC)〕、促肾上腺皮质激素释放激素(corticotropin releasing hormone,CRH)和促肾上腺皮质激素(adrenocorticotropin,ACTH)分泌增加,GC 敏感性降低,糖皮质激素受体(glucocorticoid receptors,GR)功能减弱[59]。海马体是HPA 轴的主要负反馈中心,对GC 具有高度敏感性。急性暴露于GC 的海马体会对HPA 轴产生负反馈调节。然而,长期暴露于GC 会使与抑郁相关的大脑结构(如海马体)发生变化,导致HPA 轴功能障碍,进而导致CRH、ATCH 和皮质醇分泌异常,引起海马体神经元凋亡,破坏海马体对HPA 轴的正常负反馈调节,最终导致HPA 轴过度活跃并产生抑郁情绪[59-60]。数据表明,80%的MDD 患者的HPA 轴过度活跃[61]。因此作为慢性应激的神经内分泌标志,HPA 轴功能障碍被认为是抑郁症的诊断指标之一。
运动对HPA 轴涉及的神经分泌系统功能具有积极的调节作用,主要体现在运动能影响CRH、ACTH 和GC 等激素的分泌,改善HPA 轴功能。动物实验发现,大鼠随年龄增加会出现GC 水平增加、焦虑、抑郁和HPA 过度活跃等症状,而长期运动训练能降低大鼠GC 水平,改善HPA 轴功能,从而缓解大鼠的焦虑、抑郁症状[62]。另有研究发现,跑台运动能恢复由慢性注射皮质酮诱导的大鼠海马体CRH 和ACTH 分泌异常,促进海马体对HPA 轴的正常调节[63]。ZHENG 等[64]研究发现,运动能够逆转慢性应激引起的大鼠皮质酮升高和GR 的减少,使HPA 轴对应激产生适应,从而缓解抑郁症状。Meta 分析表明,运动有助于降低抑郁患者的皮质醇水平,促进HPA 轴的正常负反馈调节[65]。对老年抑郁患者进行12周中等强度有氧运动干预,能使其ATCH 和GC 水平降低,并改善抑郁症状[66]。基于上述研究可知,运动能通过调节CRH、ACTH 和GC(皮质醇)分泌,恢复HPA 轴的正常调节功能,减少海马体神经元的损伤和凋亡,改善神经分泌系统功能,从而起到抗抑郁的作用。
3.3 运动降低神经炎性反应 神经炎性反应是指发生在中枢神经系统中的一种机体为了保护大脑免受损害而启动的先天性免疫反应。研究发现,外周炎症可破坏血-脑脊液屏障的正常功能和神经系统的微环境稳态,使外周炎性细胞和促炎细胞因子易于进入脑组织,诱发神经炎症[67]。神经炎症功能紊乱会引起认知功能障碍,其通过参与调节神经发生、突触可塑性和神经元存活等过程,从而影响学习记忆的形成和情感的调控,进而诱发抑郁症等神经系统疾病[67]。
抑郁症患者体内一系列促炎细胞因子水平相比健康人有所升高,其在机体内水平的高低与症状的严重程度密切相关[68]。运动可通过调控多种促炎细胞因子的表达从而调节机体的炎性反应,主要有白介素6(interleukin-6,IL-6)、IL-1β、肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)等,其中以IL-6 最具代表性。IL-6 作为一种经典的促炎细胞因子参与神经炎性反应,但在急性运动过程中,骨骼肌可产生大量的IL-6,IL-6 水平骤升可引发外周抗炎效应,刺激其他组织抗炎细胞因子如IL-10、IL-1 受体拮抗剂的分泌,并抑制TNF-α、IL-1β 和IL-8 等促炎细胞因子的释放,降低外周炎性反应从而缓解神经炎症[69]。慢性运动则会使骨骼肌对IL-6 的分泌产生适应,降低IL-6 基础水平,从而阻碍其进入脑组织诱发神经炎症。
运动抗抑郁的机制还与运动对犬尿氨酸代谢的调节有关。犬尿氨酸是一种内源性谷氨酸受体激动剂,参与了神经元凋亡和神经炎性反应过程。运动能诱导骨骼肌产生犬尿氨酸氨基转移酶,将极具神经毒性且能自由通过血-脑脊液屏障的犬尿氨酸代谢为不能通过血-脑脊液屏障的犬尿酸,从而降低神经炎性反应[70]。
3.4 运动可降低氧化性应激,提高抗氧化水平 氧化性应激是指由自由基或活性氧(ROS)和活性氮(RNS)在体内产生的一种生物损伤效应。脑组织氧利用率高但抗氧化水平低,调控情感的相关脑区对各种应激刺激敏感,容易受到氧化性应激损伤。氧化性应激会导致神经元线粒体功能障碍,减少神经元的增殖和存活,影响神经递质的释放,引起神经元可塑性的改变[71]。研究发现,抑郁症患者血清自由基水平升高,超氧化物歧化酶、过氧化氢酶等抗氧化酶的活性降低,机体总抗氧化能力下降,氧化-抗氧化系统失衡,出现脂质过氧化和DNA 损伤;而经抗抑郁治疗后患者血清自由基和脂质过氧化水平明显降低[72],提示抑郁症的发生机制与氧化性应激损伤密切相关。
研究发现,运动可激活抗氧化系统,提高机体抗氧化水平,从而改善抑郁症[73],其机制是运动能通过促进抗氧化酶的产生,修复ROS 损伤的酶,使机体对ROS 产生适应,降低机体过氧化物水平,提高抗氧化通路效率,缓解由氧化应激导致的抑郁症状,保护神经元线粒体,减少脑组织损伤[73]。动物实验亦表明,运动可降低海马体氧化性应激水平,增强海马体抗氧化能力,从而改善抑郁样行为[74]。此外,系统评价和Meta 分析发现,即使运动类型、运动强度、运动量或目标人群均有不同,运动依然与氧化应激标志物水平的降低和抗氧化水平的提高相关[75]。
4 总结与展望
运动锻炼作为一种简便易行的身心健康促进行为,其对抑郁症的预防和治疗效果得到了广泛关注。在抑郁症运动干预中,有氧运动是最常见的运动类型,抗阻运动虽然在某些研究中也显示出对抑郁症的改善作用,但其结论仍存在争议,有待进一步研究验证。与单一的低强度运动相比,高频率、高剂量的中等到高强度有氧运动配合力量训练和各种协调锻炼,通常会产生更好的抗抑郁效果。
运动抗抑郁的神经生物学机制主要有以下几个方面:(1)运动增强神经元可塑性:运动可有效抑制海马体神经元凋亡,促进神经元再生,增加海马体体积以及PFC 和ACC 的灰质体积,改善中枢神经系统组织的形态结构,并能提高BDNF、VEGF 和IGF-1 等神经营养因子的水平,从而增强神经元可塑性,提高患者的学习、记忆能力与情绪调控能力;(2)运动改善神经分泌系统功能:运动可调节GC、ACTH 和CRH 等激素的水平,使HPA 轴的负反馈调节恢复正常,维持海马体对HPA 轴的正常调控,改善神经分泌系统功能;(3)运动降低神经炎性反应:运动通过调控促炎细胞因子的表达和犬尿氨酸的代谢过程,从而降低神经炎性反应,减少神经毒害作用和认知功能损伤,进而改善抑郁症;(4)运动降低氧化性应激,提高抗氧化水平:运动能平衡机体氧化性应激水平和抗氧化能力,减少氧化性应激对脑组织造成的损伤。
由于方法、技术等方面的限制,目前许多研究成果均出自动物模型,具有一定局限性。鉴于运动对抑郁症具有积极影响,未来应更加深入探索不同的运动类型、强度、频率和运动量等对抑郁症干预效果的影响,并综合考虑患者的年龄、性别、疾病和体能等因素,建立安全及有效的运动处方,让患者更加科学、合理地坚持运动锻炼。另外,运动抗抑郁的机制极为复杂,不仅涉及神经生物学,还与心理学、社会学等多种因素相关,今后应从多方面、多角度进行研究,以更全面地揭示不同因素在运动治疗抑郁症的机制中产生的作用,减少患者对抗抑郁药物的依赖,使患者症状得到更大程度的缓解。
作者贡献:王少堃负责文章的构思与设计、研究资料的收集与整理、论文撰写;王世强负责论文修订、文章的质量控制及审校、对文章整体负责,监督管理;王一杰、胥祉涵负责表格的编辑、整理。
本文无利益冲突。



