李想,陈炳,邬嘉波,吴海如,俞加法
·论 著·
地舒单抗治疗前列腺癌骨转移疼痛的临床研究
李想,陈炳,邬嘉波,吴海如,俞加法
舟山医院泌尿外科,浙江舟山 316000
探讨唑来膦酸和地舒单抗辅助去势疗法治疗前列腺癌骨转移疼痛的临床疗效。选取舟山医院2022年1—6月收治的前列腺癌骨转移疼痛患者84例,采用随机数字表法分为对照组和试验组,每组各42例;两组均采用去势疗法治疗,对照组给予唑来膦酸辅助治疗,试验组采用地舒单抗治疗,比较两组的客观缓解率、治疗前后视觉模拟评分(visual analogue scale,VAS)、卡氏评分及安全性。对照组和试验组客观缓解率分别为71.43%(30/42),80.95%(34/42);两组客观缓解率比较,差异无统计学意义(>0.05)。两组治疗后3、6及12个月VAS评分均显著低于治疗前(<0.05);试验组治疗后上述时间点VAS评分分别为(4.89±1.07)分、(2.26±0.71)分、(1.03±0.49)分,分别显著低于对照组的(5.68±1.32)分、(3.59±1.15)分、(1.95±0.65)分(<0.05)。两组治疗后3、6及12个月卡氏评分均显著高于治疗前(<0.05);试验组治疗后上述时间点卡氏评分分别为(60.69±6.65)分、(72.27±7.31)分、(80.10±9.57)分,均显著高于对照组的(55.36±4.97)分、(60.30±5.83)分、(69.65±7.45)分,差异有统计学意义(<0.05)。对照组和试验组不良反应发生率分别为7.14%(3/42)、2.38%(1/42),两组不良反应发生率比较,差异无统计学意义(>0.05)。相较于唑来膦酸,地舒单抗辅助去势疗法治疗前列腺癌骨转移疼痛可有效缓解疼痛症状,改善生活质量,且安全性良好。
地舒单抗;唑来膦酸;去势疗法;前列腺癌;骨转移;疼痛
前列腺癌是男性常见泌尿系统恶性肿瘤之一,我国每年新发病例数超过11万。骨骼是前列腺癌主要转移部位,随之产生的病理性骨折、脊髓压迫及骨痛等骨相关事件已成为影响患者生活质量及远期预后的重要原因[1-2]。已有研究显示,60%~75%前列腺癌骨转移患者确诊时已发生严重骨痛症状,给日常工作生活带来极大困扰[3]。以骨痛为代表的骨相关事件伴随前列腺癌骨转移患者病情发生、发展全过程,给患者、家庭及社会带来沉重经济负担[4]。唑来膦酸属于强效双膦酸盐类骨改良药物,近年来已被广泛用于骨相关事件的防治,但相当部分患者病情控制效果不佳,且肾毒性问题也使得其临床应用受限[5]。地舒单抗属于人免疫球蛋白G2单克隆抗体,已被证实能够有效降低破骨细胞分化、活性及存活,抑制骨吸收,有助于延长首次骨相关事件发生时间,且基本无肾毒性[6]。因此,本研究前瞻性纳入舟山医院2022年1—6月收治前列腺癌骨转移疼痛患者84例,探讨唑来膦酸和地舒单抗辅助去势疗法治疗前列腺癌骨转移疼痛临床疗效,现报道如下。
1 资料与方法
1.1 一般资料
选取舟山医院2022年1—6月收治的前列腺癌骨转移疼痛患者84例,采用随机数字表法分为对照组和试验组,每组各42例。对照组年龄56~82岁,平均(67.37±5.69)岁,转移部位:肩胛骨15例,脊柱14例,胸骨8例,肋骨5例。试验组年龄54~81岁,平均(66.89±5.60)岁,根据转移部位:肩胛骨18例,脊柱13例,胸骨8例,肋骨3例,两组患者一般资料比较,差异无统计学意义(>0.05)。本研究方案经舟山医院伦理委员会批准[伦理审批号:(2021)伦审第(007)号],且患者均签署知情同意书。
1.2 纳入排除标准
纳入标准:①经B超、前列腺磁共振成像(magnetic resonance imaging,MRI),前列腺增强电子计算机断层扫描(computed tomography,CT),前列腺穿刺活检术检查等初次确诊为晚期前列腺癌伴骨转移;②前列腺癌病灶骨转移依据:X线、CT、MRI、骨扫描或正电子发射断层-X线计算机断层组合系统检查证实存在骨转移性病灶[6];③血清钙2.0~2.9mmol/L;④东部肿瘤协作组身体状态评分0~3分;⑤肌酐清除率<30ml/min;⑥生存期预计≥3个月。排除标准:①前列腺组织标本病理学结果为神经内分泌前列腺癌,包括小细胞癌、肉瘤;②激素使用禁忌证,如活动性感染、人类免疫缺陷病毒等免疫性疾病;③存在需要长期口服激素的慢性病;④存在有垂体或肾上腺功能障碍的病史;⑤严重甲状腺功能障碍、肝功能障碍、心脑血管疾病等;⑥既往或目前使用双膦酸盐的患者;⑦对研究中所涉及的药物过敏。
1.3 治疗方法
两组患者均采用一线内分泌治疗药物去势,比卡鲁胺片(批准文号:国药准字J20150050,生产单位:阿斯利康制药有限公司,规格:50mg×28片)50mg,每日1次口服。对照组予唑来膦酸(批准文号:国药准字H20041346,生产单位:天晴依泰药业,规格:5ml∶4mg)每次4mg,用100ml 0.9%氯化钠注射液稀释后静滴,每4周给药1次;碳酸钙D3片(批准文号:国药准字H10950029,惠氏制药有限公司,规格:600mg/30片)每日1片口服;维生素D滴剂[批准文号:国药准字H2019329,生产单位:华夏国药(菏泽)制药有限公司,每粒含维生素D3 400单位]每日1粒口服。试验组予地舒单抗注射液[:S20190025,生产单位:百济神州生物药业有限公司,规格:120mg(1.7ml)/瓶]120mg皮下注射,每4周注射1次。两组均治疗12个月。
1.4 观察指标
①骨转移灶的复查评价标准:治疗后3个月复查X线、CT、MRI或骨扫描等评价疗效:完全缓解(complete response,CR):所有病灶完全消失至少4周;部分缓解(partial response,PR):溶骨性病灶的体积部分缩小,或溶骨性病灶出现钙化,成骨性灶密度减低;稳定(no change,NC):病灶没有明显的变化;疾病进展(progression of disease,PD):病灶增大或出现新病灶[7]。②疼痛程度评估采用视觉模拟评分法(visual analogue scale,VAS),分值0~10分,其中0分为未感疼痛,10分为疼痛难忍需要药物控制,分值越高提示疼痛越严重[8]。③生活质量评价采用卡氏评分法,分值0~100分,0分为死亡或病危,100分为生活正常,状态良好,分值越高,提示生活质量越佳[8]。④记录治疗过程中不良反应,包括胃肠道不适、发热及低钙血症等。
1.5 统计学方法
2 结果
2.1 两组客观缓解率比较
对照组和试验组客观缓解率分别为71.43%(30/42),80.95%(34/42);两组患者客观缓解率比较,差异无统计学意义(2=1.05,>0.05),见表1。
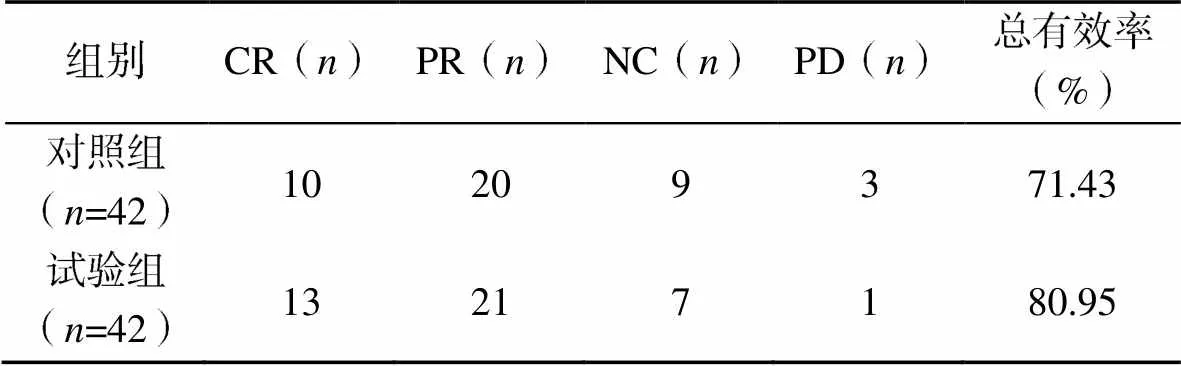
表1 两组患者客观缓解率比较
2.2 两组患者治疗前后VAS评分比较
两组患者治疗后3个月、6个月及12个月VAS评分均显著低于治疗前(<0.05);试验组治疗后上述时间点VAS评分分别显著低于对照组,差异有统计学意义(<0.05),见表2。
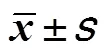
表2 两组患者治疗前后VAS评分比较(,分)
注:与治疗前比较,*<0.05;与对照组比较,#<0.05
2.3 两组患者治疗前后卡氏评分比较
两组患者治疗后3个月、6个月及12个月卡氏评分均显著高于治疗前(<0.05);试验组治疗后上述时间点卡氏评分分别显著高于对照组(<0.05),见表3。
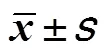
表3 两组患者治疗前后卡氏评分比较(,分)
注:与治疗前比较,*<0.05;与对照组比较,#<0.05
2.4 两组不良反应比较
对照组和试验组不良反应发生率分别为7.14%(3/42),2.38%(1/42),两组患者不良反应发生率比较,差异无统计学意义(2=0.263,>0.05)。
3 讨论
前列腺癌在男性恶性肿瘤死亡率方面高居第2位,近年来发现其在我国发病率逐年升高,且部分前列腺癌患者在第一次确诊时就已经发生转移[9]。我国每年新增约14.5万前列腺癌患者,其中65%~90%患者在进展过程中会发生骨转移,如果骨转移未接受进一步治疗,近1/2患者在确诊后1年内发生骨相关事件[10]。骨相关事件是指在恶性肿瘤骨转移或骨病患者中,由于疾病进展带来的一系列骨并发症的总称[11]。骨相关事件是一组事件,常作为研究终点用于评价治疗恶性肿瘤骨转移的疗效,主要包括病理性骨折、骨放疗、骨手术、脊髓压迫、恶性高钙血症、骨痛等[12]。各种骨相关事件均显著降低前列腺癌骨转移患者生活质量,还给患者造成沉重的经济负担[13]。
欧洲肿瘤内科骨健康指南对于骨转移患者骨靶向药物的应用推荐:骨转移诊断后即应开始骨靶向药物治疗,合并骨转移的晚期肺癌、肾癌和其他实体瘤患者,如果患者的预期寿命>3个月,且存在骨并发症高风险,应给予地舒单抗或唑来膦酸治疗[14]。双膦酸盐是使用广泛的抗骨重吸收药物,是降低骨转移患者的骨相关事件风险的标准治疗,针对不同适应证的双膦酸盐已得到监管机构的批准,包括阿仑膦酸钠、依替膦酸盐、伊班膦酸盐、帕米膦酸钠、利塞膦酸钠、唑来磷酸等,其中仅两种静脉注射制剂被全球监管机构批准用于降低骨转移患者的骨相关事件风险,即帕米膦酸钠和唑来膦酸[15]。
唑林磷酸是前列腺癌骨转移治疗常用药物之一,具有抑制骨吸收和破骨细胞活动的双重作用,同时其还能够诱导破骨干细胞死亡;唑来膦酸进入人体后可附着于骨骼中羟磷酸灰石晶体,并被破骨细胞吸收后富集滞留于细胞质中,抑制破骨细胞活性和抗吸收作用,进而缓解或延迟肿瘤造成的溶骨性改变,降低溶骨性骨转移所引发的病理性骨折,最终达到减轻或消除患者疼痛的效果[16]。静脉滴注唑来膦酸目前已被广泛用于前列腺癌骨转移患者骨相关事件的防治中,但唑来膦酸长时间应用可能对患者产生一系列严重并发症,如可能导致低钙血症、低磷血症和下颌骨坏死等,在使用时需要监测患者病情变化,同时给予对症治疗。对于肌酐清除率<30ml/min的患者,不建议给予唑来膦酸治疗[17]。
地舒单抗属于针对骨骼重塑通路全人源单克隆抗体,具有破骨细胞骨吸收抑制作用,在人体内通过结合核因子κB受体激活蛋白配体,阻止核因子κB受体激活蛋白配体和NF-κB受体激活蛋白相互作用,从而抑制骨吸收[18]。同时地舒单抗可还可紧密结合核因子κB受体激活蛋白配体,与双膦酸盐类药物不同,地舒单抗能同时抑制成熟破骨细胞骨吸收和拮抗破骨细胞存活[19]。
2020年欧洲泌尿外科协会前列腺癌指南去势抵抗性转移性前列腺癌患者中,地舒单抗(每4周皮下注射120mg)与唑来膦酸(每4周静脉注射4mg)相比,在降低前列腺癌骨转移患者骨相关事件发生率方面与唑来膦酸同等有效,并能够显著延缓首次骨相关事件发生时间,且地舒单抗较少影响肾功能,其较唑来膦酸更适合与一线化疗联合应用[20]。地舒单抗能够减轻骨转移病灶炎症反应,缓解骨疼痛症状;同时破骨细胞吸收地舒单抗后分化功能被抑制,活性明显下降,可进一步抑制肿瘤细胞骨侵犯,延缓溶骨性改变,对于减轻转移部位疼痛具有重要作用。此外,地舒单抗还能够提升骨转移局部微环境pH值,减轻酸性物质对于病灶的刺激,最终达到降低或消除疼痛的目的;而在药代动力学方面,地舒单抗个体差异极小,进入人体后被迅速吸收,单次给药作用时间可达9个月[21]。
本研究中,两组患者客观缓解率比较,差异无统计学意义(>0.05)。有报道认为地舒单抗辅助治疗前列腺癌骨转移有助于提高疾病缓解率,延长总生存时间[22],但本次研究未支持这一观点,笔者认为可能与纳入样本量较少,此后续将进一步通过扩大样本量验证。同时试验组治疗后3个月、6个月及12个月点VAS评分均显著高于对照组;试验组治疗后3个月、6个月及12个月卡氏评分均显著高于对照组,证实前列腺癌骨转移疼痛患者接受地舒单抗治疗在减轻疼痛症状及提高生活质量方面具有优势,而此优势主要与地舒单抗能够在抑制成熟破骨细胞骨吸收同时拮抗破骨细胞形成有关,而疼痛症状严重程度可直接影响生活质量。此外两组患者不良反应发生率比较,差异无统计学意义,提示地舒单抗辅助去势疗法用于前列腺癌骨转移疼痛患者治疗安全性良好,仅1例见低钙血症,且经对症治疗后血钙水平恢复正常,未影响后续临床治疗。
综上所述,相较于唑来膦酸,地舒单抗辅助去势疗法治疗前列腺癌骨转移疼痛可有效缓解疼痛症状,改善患者生活质量,且安全性良好。
[1] 胡丽娟, 戴奇山, 胡建波. 前列腺癌骨转移病人唑来膦酸不同给药间期疗效比较[J]. 临床外科杂志, 2020, 32(5): 614–617.
[2] 付玉娟, 雷田, 蔚荣豪, 等. 放射性核素氯化锶联合99Tc-亚甲基二膦酸盐治疗前列腺癌骨转移患者的疗效观察(附39例)[J]. 现代肿瘤医学, 2020, 28(11): 261–265.
[3] 杨帆, 潘敏, 胡嘏, 等. 骨转移性前列腺癌患者的生存分析和列线图的建立[J]. 新疆医科大学学报, 2021, 44(4): 104–109.
[4] PATELL K, AJAY K, AL ARMASHI A R, et al. Life-threatening sustained hypocalcemia following denosumab use in metastatic prostate cancer[J]. J Oncol Pharm Pract, 2022, 28(3): 698–702.
[5] 钟红, 邓慧远, 周义录, 等. 骨靶向药物双膦酸盐和地舒单抗治疗实体瘤骨转移的研究进展[J]. 中南药学, 2021, 19(10): 375–379.
[6] 中国抗癌协会泌尿男生殖系统肿瘤专业委员会. 前列腺癌骨转移和骨相关疾病临床诊疗专家共识(2021版)[J]. 中华肿瘤杂志, 2021, 43(10): 57–65.
[7] 宁宇. 伊班膦酸钠联合内分泌去势治疗前列腺癌对骨转移疼痛及骨密度的影响[J]. 中国临床医生杂志, 2018, 46(11): 1470–1472.
[8] 郭阳, 尹桂秀. ADC, PSA联合Gleason评分预测前列腺癌骨转移的价值[J]. 中华男科学杂志, 2020, 26(3): 64–68.
[9] 马成军, 吕景丽, 张金风.89SrCl_2治疗前列腺癌骨转移瘤患者的疼痛评分及其影响因素[J]. 包头医学院学报, 2019, 35(6): 376–377.
[10] 胡丽娟, 戴奇山, 胡建波. 89锶, 唑来膦酸及99锝-亚甲基二膦酸盐治疗老年前列腺癌骨转移的临床观察[J]. 岭南现代临床外科, 2019, 19(4): 216–221.
[11] 中国抗癌协会泌尿男生殖系肿瘤专业委员会. 地舒单抗在前列腺癌骨转移患者中的临床应用规范[J]. 肿瘤综合治疗电子杂志, 2021, 7(3): 17–21.
[12] ALZAHRANI M, CLEMONS M, VANDERMEER L, et al. Real-world practice patterns and attitudes towards de-escalation of bone-modifying agents in patients with bone metastases from breast and prostate cancer: A physician survey[J]. J Bone Oncol, 2020, 26(11): 100339.
[13] GÜL G, SENDUR M A, AKSOY S, et al. A comprehensive review of denosumab for bone metastasis in patients with solid tumors[J]. Curr Med Res Opin, 2016, 32(1): 133–145.
[14] SMITH M R, SAAD F, COLEMAN R, et al. Denosumab and bone-metastasis-free survival in men with castration-resistant prostate cancer: Results of a phase 3, randomised, placebo-controlled trial[J]. Lancet, 2012, 379(9810): 39–46.
[15] CADIEUX B, COLEMAN R, JAFARINASABIAN P, et al. Experience with denosumab (XGEVA®) for prevention of skeletal-related events in the 10 years after approval[J]. J Bone Oncol, 2022, 33(7): 100416.
[16] OTANI S, NAKAYAMA R, SEKITA T, et al. Pseudomyogenic hemangioendothelioma of bone treated with denosumab: A case report[J]. BMC Cancer, 2019, 19(1): 872–877.
[17] LUENGO-ALONSO G, MELLADO-ROMERO M, SHEMESH S, et al. Denosumab treatment for giant-cell tumor of bone: A systematic review of the literature[J]. Arch Orthop Trauma Surg, 2019, 139(10): 1339–1349.
[18] CHEN J, ZHOU L, LIU X, et al. Meta-analysis of clinical trials to assess denosumab over zoledronic acid in bone metastasis[J]. Int J Clin Pharm, 2021, 43(1): 2–10.
[19] 罗智鸿, 龚水帝, 魏秋实, 等. 基于文献计量学和可视化技术分析地舒单抗及双膦酸盐治疗骨质疏松性骨折的研究现状及趋势[J]. 中国医院药学杂志, 2021, 41(6): 1037–1043.
[20] 杨勇昆, 黄真, 苏永彬, 等. 骨巨细胞瘤的肿瘤血运变化与地舒单抗用药时间的相关性研究[J]. 临床肿瘤学杂志, 2020, 25(11): 386–391.
[21] ZHANG X. Interactions between cancer cells and bone microenvironment promote bone metastasis in prostate cancer[J]. Cancer Commun (Lond), 2019, 39(1): 76–81.
[22] HONG S, YOUK T, LEE S J, et al. Bone metastasis and skeletal-related events in patients with solid cancer: A Korean nationwide health insurance database study[J]. PLoS One, 2020, 15(7): e0234927.
Clinical study of Denosumab in the treatment of pain caused by bone metastasis of prostate cancer
Department of Urology, Zhoushan Hospital, Zhoushan 316000, Zhejiang,China
To investigate the clinical efficacy of Zoledronic acid and Denosumab in the treatment of bone metastasis pain of prostate cancer.A total of 84 patients with prostate cancer bone metastasis pain admitted to Zhoushan Hospital from January to June 2022 were randomly divided into control group and experimental group using the number table method, with 42 patients in each group. Both groups were treated with castration therapy, the control group was treated with zoledronic acid as an adjuvant therapy, and the test group was treated with Denosumab therapy. The objective remission rate, visual analogue scale (VAS) before and after treatment, Carlsberg score and safety of the two groups were compared. The objective response rates of the control group and the experimental group were 71.43% (30/42) and 80.95% (34/42), respectively; There was no statistically significant difference in objective response rates between the two groups (>0.05). The VAS scores of both groups at 3, 6, and 12 months after treatment were significantly lower than before treatment (<0.05); After treatment, the VAS scores of the experimental group at the above time points were (4.89±1.07) points, (2.26±0.71) points, and (1.03±0.49) points, which were significantly lower than the control group’s (5.68±1.32) points, (3.59±1.15) points, and (1.95±0.65) points (<0.05). After 3, 6, and 12 months of treatment, the Karst scores of both groups were significantly higher than before treatment (<0.05); After treatment, the Karst scores of the experimental group at the above time points were (60.69±6.65) points, (72.27±7.31) points, and (80.10±9.57) points, which were significantly higher than the control group’s (55.36±4.97) points, (60.30±5.83) points, and (69.65±7.45) points (<0.05). The incidence of adverse reactions in the control group and the experimental group were 7.14% (3/42) and 2.38% (1/42), respectively. There was no statistically significant difference in the incidence of adverse reactions between the two groups (>0.05).Compared with zoledronic acid, Denosumab assisted castration therapy can effectively relieve pain symptoms, improve quality of life, and has good safety.
Denosumab; Zoledronic acid; Castration therapy; Prostate cancer; Bone metastasis; Pain
R737.25
A
10.3969/j.issn.1673-9701.2023.18.004
(2022–10–09)
(2023–06–21)
舟山市医药卫生科技计划项目(2021YA04)
李想,电子信箱:zhoushanyiyuan@163.com



