魏淑芳,陈晓晓,刘继青,黄艳
肝脏超声弹性成像技术预测2型糖尿病的应用研究
魏淑芳,陈晓晓,刘继青,黄艳
杭州市西溪医院特检科,浙江杭州 310023
探讨肝脏超声弹性成像技术使用机器学习构建模型用于识别2型糖尿病(type 2 diabetes mellitus,T2DM)患者的应用价值。回顾性分析2017年4月至2021年8月于杭州西溪医院行超声弹性成像的161例疑似T2DM患者的临床资料,将纳入研究对象按7∶3比例随机分为训练组(=111)和验证组(=50)。使用多因素Logistic回归在训练组筛选独立预测因子,基于这些独立预测因子使用机器学习方法构建预测模型,同时使用验证组数据和受试者操作特征曲线评估模型的准确性和可靠性。使用随机森林算法构建的预测模型在训练组和验证组中识别T2DM患者的诊断性能分别为90.4%和89.8%,敏感度为81.1%和84.1%,特异性为89.2%和84.9%。在模型截断值为0.464时,其具有良好的临床分类效能。超声弹性成像技术使用随机森林构建的预测模型可识别T2DM。
2型糖尿病;弹性成像;机器学习;脂肪衰减指数;肝脏硬度值
2型糖尿病(type 2 diabetes mellitus,T2DM)是一种代谢异常疾病,预计至2030年,全球T2DM患者将增至5.52亿[1]。由于缺乏对该疾病的了解,导致近1/3的T2DM患者并不知晓自身患病情况[2]。长期高血糖严重损害身体健康,其中肝脂肪变性比例高达70%[3]。因此,检测肝脏组织学变化对筛查T2DM高风险人群从而采取预防措施抑制疾病进展和提高生活质量具有重要意义。肝脏瞬时弹性成像技术主要基于超声信号在肝组织中传播受肝细胞中脂滴的影响而出现显著衰减的原理来评估肝脂肪变性,其中脂肪衰减指数(fat attenuation index,FAI)和肝脏硬度值(liver stiffness measurement,LSM)等参数可用于定量表达肝脂肪变性程度[4-5]。但糖尿病是一种复杂的慢性疾病,单纯基于肝脂肪变性或许不能早期识别T2DM高危人群。机器学习可在临床实践中通过提供高精度和可靠的模型改进决策过程。多项研究采用机器学习技术开发筛查、诊断和预测工具,以检测T2DM发生和发病的可能性[6-7]。本研究基于机器学习使用瞬时弹性成像技术构建预测模型用于识别T2DM患者,旨在探讨其识别高风险T2DM人群的临床应用价值及可行性。
1 资料与方法
1.1 一般资料
回顾性分析2017年4月至2021年8月杭州市西溪医院161例疑似T2DM患者的临床资料,其中54例确诊为T2DM患者。纳入标准:①出现口渴、多饮、多食、多尿、体质量下降等临床症状或常规体检发现血糖升高的疑似糖尿病患者;②既往无恶性肿瘤病史;③行超声弹性成像检测;④临床资料齐全。排除标准:①合并糖尿病性视网膜病变等合并症者;②检查依从性差;③皮下脂肪过厚、植入起搏器、右上腹有创口未愈合者;④孕产妇;⑤合并重大心、脑、肾、血液系统疾病或精神疾病。将研究对象按7∶3比例随机分为训练组(=111)和验证组(=50),训练组用于构建模型,验证组用于验证模型效能。T2DM诊断符合1999年世界卫生组织糖尿病诊断标准,即空腹血糖≥7.0mmol/L,或随机血糖≥11.1mmol/L,或口服葡萄糖耐量试验2h血糖≥11.1mmol/L,或糖化血红蛋白≥6.5%。
1.2 超声瞬时弹性成像检查及定量值获取
使用海斯凯尔的Fibrotouch机型同时完成LSM和FAI测定,分别用于无创定量评价肝脏组织的硬度和脂肪衰减程度。测量时患者仰卧,右手放在头后,暴露肝右叶区的肋间隙。通常取剑突水平线、右腋中线及肋骨下缘所包围的区域为检测区域。探头垂直紧贴皮肤,于肋间隙选定测量位置,检查者按探头按钮开始采集图像并获得测量值,10次成功测定值的中位数即为最终测定值。
1.3 预测模型的构建
在训练组中对每个潜在预测变量包括性别、年龄、FAI及LSM进行单因素Logistic回归分析,筛选出T2DM的独立预测因子,之后通过多因素Logistic回归筛选出相关特征构建传统Logistic模型。此外,基于这些相关特征分别使用5种机器学习算法包括支持向量机(support vector machine,SVM)、贝叶斯网络(Bayesian network,Bayes)、k近邻(k-nearest neighbor,KNN)、决策树(decision tree,DT)和随机森林(random forest,RF)构建模型。
1.4 预测模型的选取
为选出最优机器学习算法,本研究对训练组数据进行100次的重采样,每次重采样选取80%训练组数据用于模型训练,10%数据用于调整模型参数,10%数据用于模型测试,并使用受试者操作特征曲线(receiver operating characteristic curve,ROC曲线)的曲线下面积(area under the curve,AUC)评估测试数据的性能。最终使用标准偏差(relative standard deviation,RSD)量化5种机器学习算法的性能和稳定性,并选择具有最小RSD值的机器学习算法作为构建模型的最佳方法[8]。RSD是变异系数的绝对值,通常以百分比表示。
1.5 预测模型的评估
本研究通过ROC曲线分别在训练组和验证组中计算模型的AUC、敏感度、特异性来评估模型的预测准确度。校准曲线以确定模型预测T2DM的估计概率与实际T2DM概率之间的一致性。Hosmer-Lemeshow检验模型的拟合度。最后,本研究使用机器学习预测模型计算每个患者的T2DM概率分数值,并基于训练组ROC曲线的约登指数对应的最佳截断值将所有患者分为低风险组和高风险组,并与其实际T2DM结果进行比较以评估模型的临床效能。
1.6 统计学方法

2 结果
2.1 患者的临床资料比较
训练组和验证组患者的性别、年龄、FAI及LSM比较差异均无统计学意义(>0.05),见表1。在训练组和验证组中,T2DM患者与健康人群的FAI比较差异均有统计学意义(<0.05),其余临床特征比较差异均无统计学意义(>0.05),见表2。
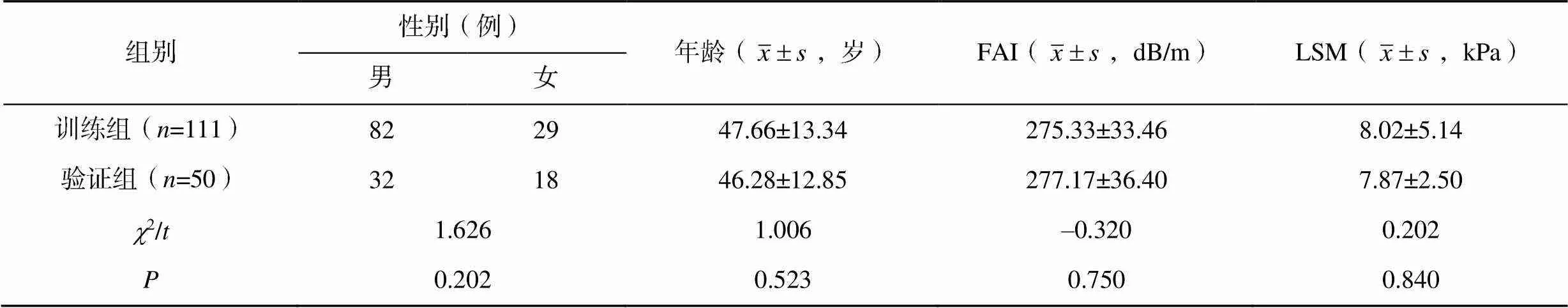
表1 训练组与验证组患者的临床资料比较
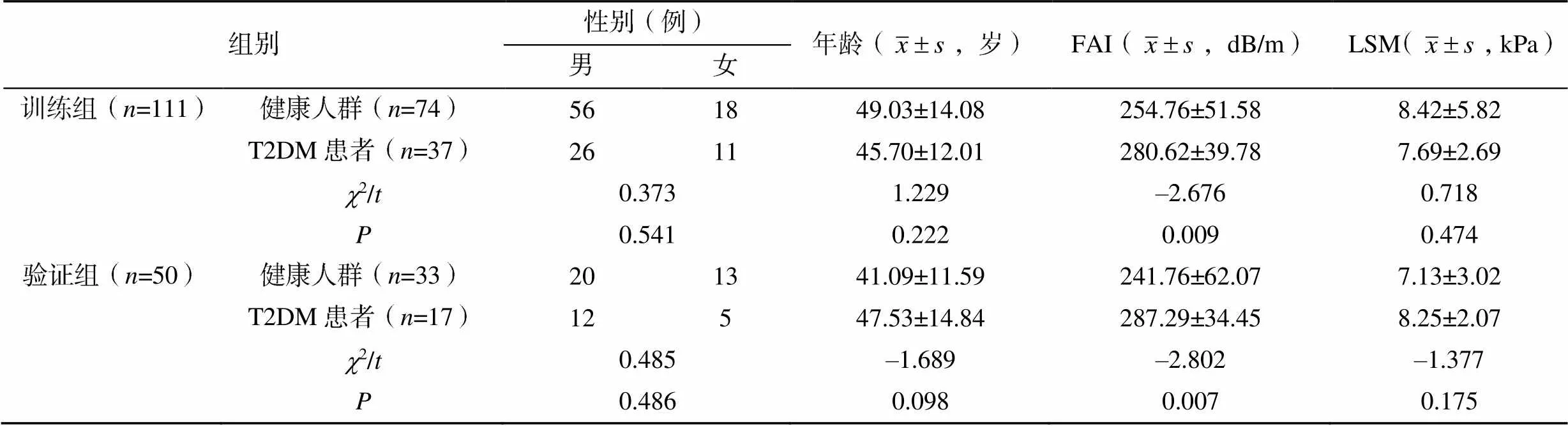
表2 两组中T2DM患者与健康人群的临床资料比较
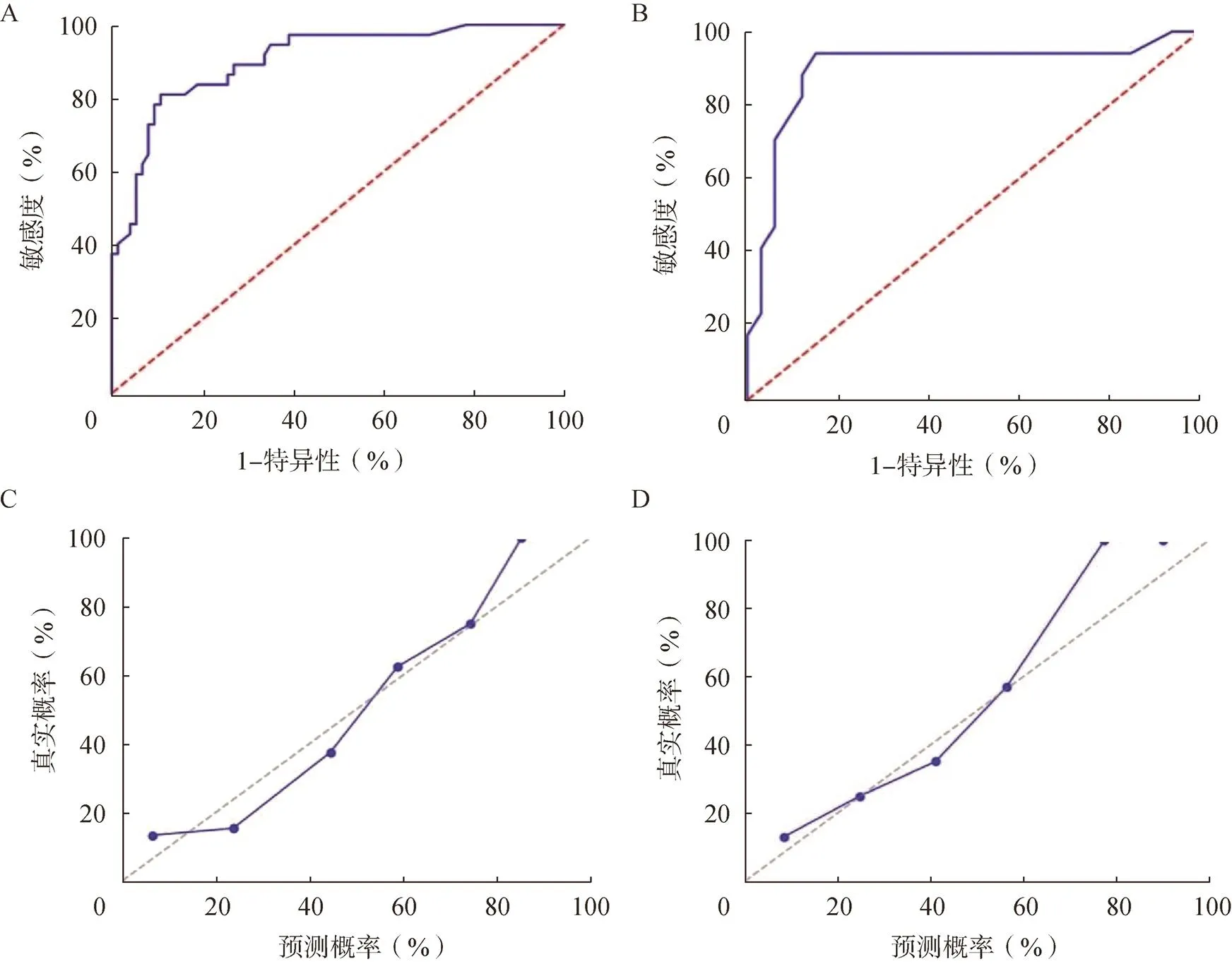
图1 RF模型的诊断效能及验证
A. RF模型在训练组中的诊断效能;B. RF模型在验证组中的诊断效能;C.RF模型在训练组中的验证;D. RF模型在验证组中的验证
2.2 预测模型的构建
多因素Logistic回归分析显示年龄(=1.038,=0.023)和FAI(=1.020,=0.002)是识别T2DM患者的相关特征。基于年龄和FAI使用Logistic回归、SVM、Bayes、KNN、DT及RF构建模型的RSD值分别为2.63%、2.122%、2.192%、2.329%、3.215%及1.826%,因此,本研究使用RF构建预测模型。
2.3 预测模型的验证
RF模型在训练组和验证组中的诊断性能分别为90.4%和89.8%,敏感度分别为81.1%和84.1%,特异性分别为89.2%和84.9%。校准曲线在训练组和验证组中显示出良好的校准性能,Hosmer-Lemeshow检验在训练组和验证组间均无统计学意义(>0.05),表明没有偏离拟合,见图1。此外,依据模型的最佳截断值(0.464)将所有研究对象分为高风险组和低风险组,两组间的T2DM患者有显著差异(<0.05),显示模型具有良好的临床效能,见图2。
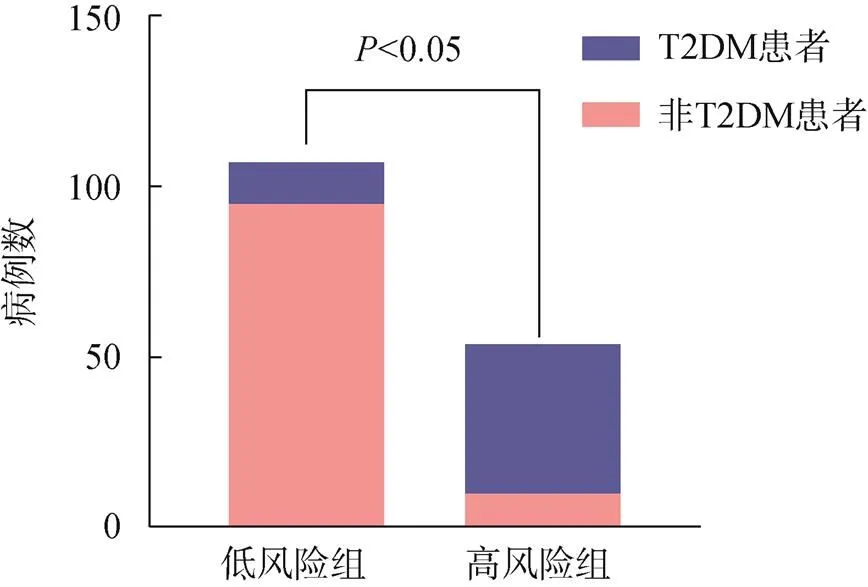
图2 低风险组和高风险组中T2DM患者的数量比较
3 讨论
本研究结果显示基于超声弹性成像的FAI联合年龄构建的预测模型可识别T2DM患者,这可能有助于通过无创及低成本的技术手段筛查T2DM的高风险人群。此外,使用RF构建的模型相比传统的Logistic模型其诊断效能有明显提升,这也进一步证实机器学习的诊断效能。
预测模型可筛查T2DM前期或患T2DM风险增加的人群,以帮助决定对患者的最佳临床管理。迄今已开发多种T2DM预测模型,其中Logistic回归是最流行的方法之一[9-12]。然而,研究表明Logistic回归在疾病风险预测方面的表现并不理想[13]。Razavian等[14]使用Logistic回归构建T2DM预测模型,模型诊断性能为0.75,与本研究结果相似。本研究中的Logistic回归构建的模型性能均低于其他机器学习算法,最终筛选出的RF算法构建的诊断模型性能明显优于Logistic回归,证实RF算法具有较高的准确性和优越性[15]。
超声弹性成像技术是新兴的针对肝脏的无创诊疗评估策略,对肝纤维化及脂肪变性均有良好的评估效果[16]。本研究也证实上述结论,FAI可作为独立预测因素纳入模型的构建。但本研究显示弹性成像的另一个定量参数LSW并不是独立预测因子,在T2DM和非T2DM人群之间也无差异,这可能是由于本次收集的T2DM患者病史不长从而导致肝脏硬度改变并不明显[17]。此外,本研究结果显示年龄也作为一个重要因素纳入模型构建中,这与Joshi等[18]研究结果相似,这可能是随着衰老,胰腺细胞对葡萄糖敏感性下降和胰岛素分泌受损。本研究结果进一步证实年龄是T2DM发病的危险因素,也是识别高风险个体的重要变量[19]。事实上,不同年龄段人群的T2DM发病率具有一定差异,这可能也是本研究中年龄因素纳入模型的可能原因[20]。
本研究仍具有局限性。首先,这是一项回顾性研究,未来应侧重于前瞻性研究的预测和分类模型的开发,这将允许使用时间演化信息来评估和修改预测模型;其次,需要通过更好的工程设计进一步优化模型本身,并通过整合其他临床数据进一步开发,以提高模型的整体性能,实现对T2DM更准确的诊断;最后,本研究缺乏对模型的外部验证,需要采用更大样本量的多中心验证来获取临床应用的高水平证据。
综上所述,应用机器学习构建的预测模型识别T2DM患者是可行的,该模型可为临床医生和患者提供有关T2DM发病的有价值信息,从而采取措施降低T2DM的风险并延缓进展。
[1] SHAW J E, SICREE R A, ZIMMET P Z. Global estimates of the prevalence of diabetes for 2010 and 2030[J]. Diabetes Res Clin Pract, 2010, 87(1): 4–14.
[2] CHOI S B, KIM W J, YOO T K, et al. Screening for prediabetes using machine learning models[J]. Comput Math Methods Med, 2014, 2014: 618976.
[3] TARGHER G, BERTOLINI L, PADOVANI R, et a1. Prevalence of nonalcoholic fatty liver disease and its association with cardiovascular disease among type 2 diabetic patients[J]. Diabetes Care, 2007, 30(5): 1212–1218.
[4] DENG H, WANG C L, LAI J, et a1. Noninvasive diagnosis of hepatic steatosis using fat attenuation parameter measured by fibrotouch and a new algorithm in CHB patients[J]. Hepat Mon, 2016, 16(9): e40263.
[5] 李银燕, 王学梅, 张义侠, 等. 超声弹性成像评分在脂肪肝分度中的应用价值[J]. 中国临床医学影像杂志, 2009, 20(12): 911–913.
[6] HANDELMAN G S, KOK H K, CHANDRA R V, et al. eDoctor: Machine learning and the future of medicine[J]. J Intern Med, 2018, 284(6): 603–619.
[7] LIU X, FAES L, KALE A U, et al. A comparison of deep learning performance against health-care professionals in detecting diseases from medical imaging: A systematic review and Meta-analysis[J]. Lancet Digit Health, 2019, 1(6): e271–e297.
[8] PARMAR C, GROSSMANN P, RIETVELD D, et al. Radiomic machine-learning classifiers for prognostic biomarkers of head and neck cancer[J]. Front Oncol, 2015, 5: 272.
[9] SCHWARZ P E, LI J, LINDSTROM J, et al. Tools for predicting the risk of type 2 diabetes in daily practice[J]. Horm Metab Res, 2009, 41(2): 86–97.
[10] YU W, LIU T, VALDEZ R, et al. Application of support vector machine modeling for prediction of common diseases: The case of diabetes and pre-diabetes[J]. BMC Med Inform Decis Mak, 2010, 10: 16.
[11] NAZ H, AHUJA S. Deep learning approach for diabetes prediction using PIMA Indian dataset[J]. J Diabetes Metab Disord, 2020, 19(1): 391–403.
[12] CHRISTODOULOU E, MA J, COLLINS G S, et al. A systematic review shows no performance benefit of machine learning over logistic regression for clinical prediction models[J]. J Clin Epidemiol, 2019, 110: 12–22.
[13] NUSINOVICI S, THAM Y C, CHAK YAN M Y, et al. Logistic regression was as good as machine learning for predicting major chronic diseases[J]. J Clin Epidemiol, 2020, 122: 56–69.
[14] RAZAVIAN N, BLECKER S, SCHMIDT A M, et al. Population-level prediction of type 2 diabetes from claims data and analysis of risk factors[J]. Big Data, 2015, 3(4): 277–287.
[15] RAVIZZA S, HUSCHTO T, ADAMOV A, et al. Predicting the early risk of chronic kidney disease in patients with diabetes using real-world data[J]. Nat Med, 2019, 25(1): 57–59.
[16] 赵雅琴, 郑艳芬. 超声检测技术结合临床检验指标评估早期肝硬化的研究进展[J]. 包头医学院学报, 2021, 37(10): 117–121.
[17] 田彩云, 胡晗, 张国远, 等. 糖代谢紊乱对肝硬化相关并发症的影响[J]. 临床肝胆病杂志, 2021, 37(5): 1197–1200.
[18] JOSHI R D, DHAKAL C K. Predicting type 2 diabetes using logistic regression and machine learning approaches[J]. Int J Environ Res Public Health, 2021, 18(14): 7346.
[19] PEER N, BALAKRISHNA Y, DURAO S. Screening for type 2 diabetes mellitus[J]. Cochrane Database Syst Rev, 2020, 5(5): CD005266.
[20] MAGLIANO D J, SACRE J W, HARDING J L, et al. Young-onset type 2 diabetes mellitus - implications for morbidity and mortality[J]. Nat Rev Endocrinol, 2020, 16(6): 321–331.
Application of liver ultrasonic elastography in predicting type 2 diabetes mellitus
Department of Special Inspection, Hangzhou Xixi Hospital, Hangzhou 310023, Zhejiang, China
To explore the application value of liver ultrasonic elastography using machine learning to build models to identify type 2 diabetes patients (T2DM).The clinical data of 161 patients with suspected T2DM who underwent ultrasonic elastography in Hangzhou Xixi Hospital from April 2017 to August 2021 were retrospectively analyzed. The included subjects were randomly divided into training group (=111) and verification group (=50) according to a ratio of 7:3. Multivariate Logistic regression was used to screen independent predictors in training group. Based on these independent predictors, a predictive model was constructed using machine learning methods. The accuracy and reliability of the model were evaluated using verification group data and receiver operating characteristic curve.The predictive model constructed using the random forest algorithm had a diagnostic performance of 90.4% and 89.8%, sensitivity of 81.1% and 84.1%, and specificity of 89.2% and 84.9% in training group and verification group, respectively. When the model cut-off value was 0.464, it had good clinical classification efficiency.Ultrasonic elastography can identify T2DM using a prediction model constructed from random forests.
Type 2 diabetes mellitus; Elastography; Machine learning; Fat attenuation index; Liver stiffness measurement
R445.1
A
10.3969/j.issn.1673-9701.2023.25.003
浙江省医药卫生科技计划项目(2020KY770)
黄艳,电子信箱:63100063@qq.com
(2023–01–08)
(2023–08–18)



