王瑞丽 阮林海 葛晓华
塞来昔布是一种选择性环氧合酶-2(COX-2)的抑制剂,是目前唯一被FDA批准治疗家族性腺瘤性息肉患者的辅助治疗的非甾体抗炎药,但塞来昔布的抗癌效果及分子机制尚不清楚。有研究表明,非甾体抗炎药(NSAIDs)通过抑制环氧化酶(COX),而此酶是催化花生四烯酸向前列腺素转化的关键酶,且诱导型环氧合酶-2(COX-2)的过表达与前 列腺素E的水平有关,从而抑制肿瘤细胞增殖、诱导细胞凋亡[1-2]。已有研究证实,COX-2在结肠癌、乳腺癌、肺癌、前列腺癌、皮肤癌、宫颈癌、胰腺癌、卵巢癌、膀胱癌和头颈部恶性肿瘤中均呈高表达[3]。这表明COX-2在肿瘤细胞中的过度表达与各种癌症的促进有关。目前,塞来昔布对血液系统肿瘤的研究较少,国外有学者研究塞来昔布对人类慢性髓系白血病细胞株的影响,结果表明塞来昔布在体外能诱导人慢性髓性白血病细胞系K562细胞凋亡,这说明塞来昔布在开发用于治疗慢性粒细胞白血病抗癌药物方面具有广泛的前景[4]。但这些研究对象仅限于细胞系,且塞来昔布对急性白血病原代细胞的影响在国内外报道较少,因此,本研究以塞来昔布作用于急性白血病原代细胞,观察其对白血病细胞增殖及凋亡的影响,以期更能反映其抗白血病的作用,为临床寻找白血病新的药物提供理论依据。
1 资料与方法
1.1 一般资料 收集2010年2月-2011年7月河南科技大学第一附属医院血液科初诊未治的急性白血病患者16例,其中男10例,女6例,年龄5~68岁,中位年龄36岁。急性髓系白血病患者12例(M26例,M33例,M53例),急性淋巴细胞白血病患者4例(L13例,L21例),所有患者均符合国内诊疗标准[5],全部病例均除外合并心、肝、肾功能异常及合并感染,除外合并其他恶性肿瘤及自身免疫性疾病。Ficoll密度梯度离心法取患者骨髓单个核细胞分离,接种于含体积分数为10%灭活的胎牛血清的RPMI1640培养基中常规培养。
1.2 仪器与试剂:COX-2细胞培养箱(MCO-175日本SANYO)、普通及倒置显微镜(GIX-DH-40 45 德国Leica)、净化工作台(SP-DJ-2B 金坛荣华),酶标仪(ELX800 美国Bio-Tek)、COX-2抑制剂塞来昔布胶囊(系辉瑞公司生产)、改良型RPMI1640培养基(批号:NWBO377)、胎牛血清(TBD公司)、四甲基偶氮唑盐(美国Sigma公司)、Annexin V-FITC试剂盒(美国Bender Medsystems公司)、流式细胞仪EPILSXL(Beckman-Coulter公司 )。
1.3 方法
1.3.1 MTT法测定塞来昔布对急性白血病原代细胞增殖的抑制作用 取急性白血病指数生长期的细胞,调整细胞浓度为1×105个/ml,接种于3个96孔板中,每孔细胞悬液100 μ1,加入用RPMI1640培养液稀释的塞来昔布,使其终浓度分别为0、20、40、60、80、100、120 μmol/L,并各设 5个复孔,同时设对照组(0 μmol/L),每组细胞培养不同时间(24、48和72 h),实验结束前4 h,每孔加入MTT(5 mg/ml)10 μl,再继续培养4 h后从培养箱中取出,每孔各加入100 μl 10%十二烷基磺酸钠(SDS)终止反应,37 ℃存放过夜,用酶标仪570 nm波长检测A值。根据如下公式计算细胞抑制率:细胞生长抑制率 (对照组A值-实验组A值)/对照组A值 100%。
1.3.2 80 μmoL/L的塞来昔布作用48 h后细胞形态学观察在细胞培养瓶里,用倒置显微镜分别观察对照组和实验组的细胞生长状况和形态学改变。
1.3.3 Annexin V/PI 双标记法检测细胞凋亡率 24 h后离心收集各组细胞,PBS洗涤,分别取6×105~10×105个细胞根据Annexin V-FITC试剂盒(美国Bender Medsystems 公司)说明书进行细胞凋亡检测,用1∶4的binding buffer缓冲液180 μl重悬细胞,加入异硫氰酸荧光素(FITC)标记的AnnexinVFITC 5 μl和 20 μg/ml PI 10 μl,置冰上作用10 min,流式细胞仪检测。
1.4 统计学处理 采用SPSS 13.0统计软件对所有数据进行处理,实验数据均以(s)表示,比较采用t检验,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 塞来昔布对急性白血病原代细胞的生长抑制作用 药物干预后,各浓度组细胞增殖均受到明显抑制,呈剂量和时间依赖性(P<0.05),见图1。
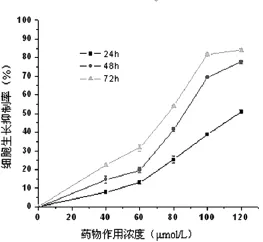
图1 塞来昔布对急性白血病原代细胞的抑制
2.2 80 μmoL/L的塞来昔布作用48 h后细胞形态改变 对照组细胞呈圆形,轮廓清晰,胞体透亮,生长旺盛,悬浮成团呈“葡萄样”生长,为典型的白血病细胞形态。实验组细胞体积缩小,细胞皱缩,集落减少,细胞中颗粒增多,细胞碎片明显增多。
2.3 塞来昔布对急性白血病原代细胞凋亡的影响 药物作用24 h后,对照组细胞凋亡率为(3.98 0.6)%,实验组40、60、80 μmol/L浓度的凋亡率分别为(8.1 0.9)%、(10.97 1.4)%、(19.78 2.3)%,与对照组相比实验组凋亡率均明显增高,差异具有统计学意义(P<0.01),见图2。
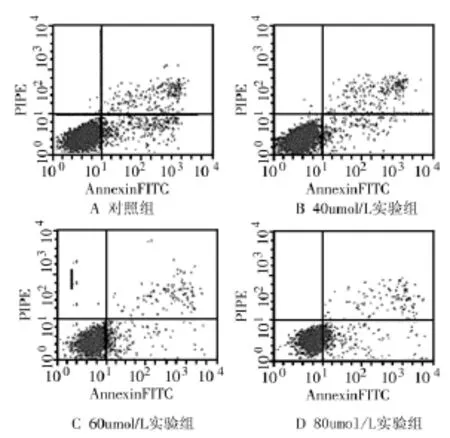
图2 Annexin V-FITC/PI双标记法检测细胞凋亡
3 讨论
事实上,目前大多数的化疗药物都是通过诱导细胞凋亡而清除肿瘤细胞的,在血液系统恶性肿瘤的治疗上,目前常用的化疗药物如烷化剂、蒽环类、抗代谢类等都能引起相应瘤细胞凋亡,这可能与活化Caspase和钙离子依赖性核酸酶有关。此外,紫杉醇是通过抑制微管解聚使肿瘤细胞有丝分裂终止促进肿瘤细胞凋亡达到抗肿瘤效应的。基于细胞凋亡异常在许多人体恶性肿瘤的发病学上占有十分重要的地位,有理由相信随着对细胞凋亡发生机制的深入认识,可望在恶性肿瘤的治疗学上取得新的突破,以选择性地诱导肿瘤细胞凋亡为目标的凋亡干预技术很可能成为治疗恶性肿瘤的基本策略。
研究表明,塞来昔布是高度选择性的COX-2抑制剂,能够诱导细胞发生凋亡,具有广泛的抗肿瘤作用,其作用机制主要是调控癌基因和抑癌基因的表达,抑制COX-2的活性,诱导细胞周期停滞和细胞凋亡等途径来诱导实体瘤细胞凋亡[6-7]。目前,特异性COX-2抑制剂塞来昔布对白血病的作用研究较少,且仅限于细胞系。因此,本实验研究了塞来昔布干预下的急性白血病原代细胞增殖情况,MTT法发现塞来昔布对急性白血病原代细胞具有明显增殖抑制作用,且随着作用浓度和时间的增加,增殖抑制率从7.86%提高到83.89%,呈时间和剂量依赖关系(P<0.05)。形态学观察发现80 μmol/L的塞来昔布作用48 h后细胞体积皱缩,集落减少,细胞中的颗粒增多,细胞碎片较对照组明显增多。Annexin V-FITC/PI双标记法检测细胞经不同浓度的塞来昔布处理24 h后,对照组和实验各组凋亡率有明显的差异,且发现实验组白血病原代细胞早期凋亡率随着药物浓度的增加,凋亡率呈逐渐增高趋势,对照组为(3.98 0.6)%,实验组从(8.1 0.9)%增加到(19.78 2.3)%,这说明塞来昔布能够诱导白血病原代细胞的凋亡且具有剂量依赖性。细胞凋亡是一个复杂的程序,而Bcl-2基因是血液系统恶性肿瘤中最为重要的抗凋亡基因,在一些白血病中呈过度表达。原癌基因Bcl-2定位于18号染色体臂2区1带,它的生理功能主要通过阻遏细胞凋亡而延长细胞的生存时间。此外,Bcl-2蛋白家族的成员通过阻止线粒体细胞色素C的释放而发挥抗凋亡的作用,同时Bcl-2可与bax基因组成同源二聚体或异源二聚体来抑制Bcl-2的作用而发挥促进细胞凋亡的功能,这与细胞凋亡动态平衡有关[8-9]。Rudner等[10]用塞来昔布干预Jurkat淋巴瘤细胞后,发现抗凋亡Bcl-2相关蛋白有关的Mcl-1迅速降低,而Mcl-1的下降足以诱导细胞凋亡,同时指出塞来昔布除了抑制COX-2有关外,还可通过Bcl-2家族成员控制的内在途径诱导细胞凋亡。Liu等[11]在塞来昔布诱导骨肉瘤细胞凋亡的研究中认为,塞来昔布发挥抗肿瘤效应与survivin和Bcl-2下调有关。Pyrko等[12]认为,塞来昔布发挥抗肿瘤的作用与下调survivin有关。目前认为,Caspases活性变化是调节细胞凋亡的重要机制,当凋亡过程启动后,Caspases酶原变成有活性的Caspases,从而产生“瀑布式”效应,最终导致细胞凋亡,其中起核心作用的是Caspases-3,研究表明药物或某些生物活性因子所诱导的白血病细胞凋亡中,Caspases-3活性变化起了重要的作用[13-14]。总之,塞来昔布诱导凋亡的作用机制非常复杂,需要进一步深入地研究。
然而笔者必须考虑到,本实验研究进行的体外培养急性白血病细胞并不能完全代表复杂的体内环境,此外样本数量有限,因此,塞来昔布诱导白血病细胞的凋亡的机制仍需深入研究。然而,本项研究证实了塞来昔布能够诱导白血病细胞的凋亡,且随着浓度的增加凋亡率升高,这将为临床探讨治疗白血病新的药物提供理论依据,同时也为白血病的治疗方法提供一个新的思路。
[1]Husain S S,Szabo I L,Tamawski A.NSAID inhibiton of GI cancer growth:clinical implications and molecular mechanisms of action[J].Am J Gastroenterology,2002,97(3):542-553.
[2]Brown J R,DuBois R N.COX-2:a molecular target for colorectal cancer prevention[J].Clin Oncol,2005,23(12):2840-2855.
[3]Andrew J,Dannenberg N K,Altorki J O,et al.Subbaramaiah,Cyclo-oxygenase 2:a pharmacological target for the prevention of cancer[J]Lancet Oncol,2001,2(9):544-551.
[4]Subhashini J,Mahipal S V,Reddanna P.Anti-proliferative and apoptotic effects of celecoxib on human chronic myeloid leukemia in vitro[J].Cancer lett,2005,224(1):31-43.
[5]张之南,沈悌.血液病诊断及疗效标准[M].第3版.北京:北京科学出版社.2007:131-134.
[6]Mustafa C,Suleyman B,Muzaffer D,et al.Overexpression of cyclooxy- genase-2 in multiple myeloma: aassociation with reduced survival[J].Am J of Hematology,2005,80(3):169-173.
[7]Wei C,Chang-hong YU,Ke-qin HU.In vitro and in vivo effects and mechanisms of celecoxib-induced growth inhibition of human hepatocellular carcinoma cells[J].Clin Cancer Res,2005,11(22):8213-8221.
[8]Adams J M,Cory S.The Bcl-2 apoptotic switch in cancer development and therapy[J].Oncogene,2007,26(9):1324-1337.
[9]Yo R J,Strasser A.The BCL-2 protein family:opposing activities that mediate cell death[J].Nat Rev Mol Cell Biol,2008,9(1):47-59.
[10]Rudner J,Elsaesser S J,Jendrossek V.Anti-apoptotic Bcl-2 fails to form efficient complexes with pro-apoptotic Bak to protect from Celecoxib-induced apoptosis[J].Biochemical Pharmacology,2011,81(1):32-42.
[11]Liu B,Shi Z L,Feng J,et al.Celecoxib,a cyclooxygenase-2 inhibitor,induces apoptosis in human osteosarcoma cell line MG-63 via down-regulation of PI3K/Akt[J].Cell Biol int,2008,32(5):494-501.
[12]Pyrko P,Soriano N,Kardosh A,et al.Downregulation of survivin expression and concomitant induction of apoptosis by celecoxib and its non-cyclooxygenase-2 inhibitory analogdimethy-celecoxib(DMC),in tumor cells in vitro and in vivo[J].Mol Cancer,2006,5(19):1476-1478.
[13]Jerome K R,Sloan D D,Aubert M,et al.Measurement of CTL-induced cytotoxicity: the caspase 3 assay[J].Apoptosis,2003,8(6):563-571.
[14]Fujimura S,Suzumiya J,Yamada Y.Downregulation of Bcl-xL and activation of caspases during retinoic acid-induced apoptosis in an adult T-cell leukemia cell line[J].Hematol,2003,4(5):328-335.



