连梓敏曹定睿王泓源马晓燕
丙泊酚对Wistar大鼠肝癌模型中Bax与Bcl-2表达的影响
连梓敏①曹定睿①王泓源①马晓燕①
目的:探讨不同浓度丙泊酚对Wistar大鼠肝癌模型中凋亡促进基因Bax和凋亡抑制基因Bcl-2表达的影响。方法:将50只雄性Wistar大鼠按随机数字表法分为五组,每组10只,分别为正常对照组(A组),肝癌模型组(B组),低剂量丙泊酚(3 mg/kg)组(C1组),中等剂量丙泊酚(6 mg/kg)组(C2组),高剂量丙泊酚(12 mg/kg)组(C3组)。给药结束后24 h处死大鼠,取肝脏标本观察肝脏特征,并做组织切片行苏木精-伊红(HE)染色及S-P免疫组化检测Bcl-2及Bax的表达,TUNEL法检测肝细胞凋亡指数(AI)。结果:(1)大体标本检查及HE染色:与A组比较,B组大鼠肝脏表面粗糙,部分肝叶表面出现黄色斑点,肝细胞脂肪变性,点状坏死及炎细胞浸润,少量胶原纤维增生;与B组比较,C1、C2、C3组肝细胞变性坏死以及胶原纤维增生程度有所减轻;(2)TUNEL检测结果:随丙泊酚剂量增加,肝癌细胞中凋亡细胞逐渐增多,AI逐渐递增,具有显着差异性(P<0.05);(3)与A组比较,B组肝脏细胞Bcl-2表达上调,Bax表达下降,差异均有统计学意义(P<0.05);与B组比较,C组(C1、C2、C3)肝脏细胞Bcl-2表达均下降,且随着丙泊酚剂量的增加而呈递减趋势,差异有统计学意义(P<0.05);Bax表达均上调,且随着丙泊酚剂量的增加而呈递增趋势,差异有统计学意义(P<0.05)。结论:丙泊酚可导致Wistar大鼠肝癌细胞中Bcl-2/Bax表达比例降低,促进肝癌细胞的凋亡,进而抑制肝癌细胞的增殖能力。
丙泊酚; 肝癌; 细胞凋亡; Bcl-2; Bax
研究显示,肿瘤不仅是表现出增殖与分化异常的疾病,同样也是表现出细胞凋亡异常的疾病。原发性肝细胞癌(hepatocellular carcinoma,HCC 简称肝癌)作为常见的原发性肝肿瘤,其发病率居全球恶性肿瘤的第5位,病死率居第3位,其中东亚及非洲的发展中国家是肝癌的高发病区[1]。丙泊酚是一种起效快,苏醒迅速,术后恶心呕吐发生率低,对机体功能影响小的麻醉剂,广泛应用于各种外科手术时全身麻醉的诱导、维持[2-5]。除高效安全的麻醉作用,近年来,丙泊酚抗肿瘤的作用也成为了目前的研究热点,但目前其对肿瘤细胞的影响尚存在争议[6-10]。本研究旨在探讨丙泊酚对Wistar大鼠肝癌模型中Bax与Bcl-2的影响,评价丙泊酚对Wistar大鼠肝癌的抑制效果。
1 材料与方法
1.1 实验动物 健康的成年Wistar大鼠50只,体重约200~250 g,购于山西医科大学生理动物实验室。
1.2 主要试剂 W256细胞株[购于通派(上海)生物有限公司],Bax兔抗鼠多克隆抗体、Bcl-2兔抗鼠多克隆抗体(均购于武汉博士德生物工程有限公司),DAB显色试剂盒、非生物素检测试剂盒、原位细胞凋亡检测(TUNEL)(均购于北京中杉金桥生物技术有限公司)。
1.3 主要药物 丙泊酚注射剂。
1.4 实验分组 将50只Wistar大鼠随机选取10只作为正常对照组(A组),将随机剩余40只Wistar大鼠制作肝癌模型后,以每组10只随机分为四组,分别为肝癌模型组(B组),低剂量丙泊酚组(3 mg/kg)(C1组),中剂量丙泊酚组(6 mg/kg)(C2组),高剂量丙泊酚组(12 mg/kg)(C3组)。
1.5 肝癌模型制备 W256细胞生长至浓度达到107/L时,经腹腔注射于2只刚断奶的健康雄性Wistar大鼠,6~8 d后大鼠腹水形成明显;抽取腹水10 mL,离心,弃上清液,接种至40只健康雄性Wistar大鼠肝脏。
1.6 标本采集 于给药结束24 h后断颈处死各组大鼠,剪取大鼠整个肝脏组织,10%中性甲醛溶液中进行固定,肉眼大体观察肿瘤组织生长情况,内部结构特点及与周围正常肝组织的关系,石蜡包埋肝脏组织,制成5 μm的病理切片备用。
1.7 观察指标及检测方法
1.7.1 苏木素-伊红染色 进行苏木素-伊红(hematoxylinand eosin,HE)染色,光镜下观察肿瘤组织的病理学特点。
1.7.2 原位细胞凋亡检测 组织经常规脱蜡、冲洗、高压氧修复后,用甲醛阻断内源性过氧化物酶活性。每片滴加5 μL 的TUNEL反应混合溶液且标本片加POD转化剂50 μL/片,置标本片于湿盒中,37 ℃孵育30 min,PBS浸洗5 min×3次。DAB显色,苏木素复染,中性树胶封片后置于光镜下观察结果。
1.7.3 Bax与Bcl-2表达检测 经脱蜡、水化、微波加热修复抗原、甲醇溶液消除内源性过氧化氢酶活性,加生物素标记二抗工作液,苏木素染色,光镜下观察。细胞浆中有棕黄色颗粒者为Bcl-2、Bax蛋白阳性表达细胞。每张切片在光学显微镜200倍视野下分别随机选择10个区域,每个区域计数100个细胞,计算Bcl-2及Bax蛋白阳性表达细胞百分比。
1.8 统计学处理 应用SPSS 13.0统计学软件对数据进行处理,计量资料以(±s)表示,比较采用单因素方差分析LSD法,以P<0.05为差异有统计学意义。
2 结果
2.1 大体标本检查及HE染色结果 与A组比较,B组大鼠肝脏表面粗糙,部分肝叶表面出现黄色斑点,于光镜下观察各组大鼠肝脏切片,可见肝细胞脂肪变性,点状坏死及炎细胞浸润,少量胶原纤维增生;与B组比较,C组(C1、C2、C3组)肝细胞变性坏死以及胶原纤维增生程度有所减轻。
2.2 促进凋亡基因Bax和抑制基因Bcl-2的表达 与A组比较,B组中Bcl-2的表达增高,Bax的表达下降,差异均有统计学意义(P<0.05);与B组比较,C组(C1、C2、C3组)肝脏细胞Bcl-2表达下降,且其随着丙泊酚剂量的增加而递减,差异有统计学意义(P<0.05);与B组比较,C组(C1、C2、C3组)肝脏细胞Bax表达上调,并随着丙泊酚剂量的增加而呈递增趋势,差异有统计学意义(P<0.05);与B组比较,C组(C1、C2、C3组)的Bcl-2/Bax比均减小,差异有统计学意义(P<0.05),见表1。
2.3 肝细胞凋亡指数(AI)的变化 随丙泊酚剂量增加,肝癌凋亡细胞的阳染颗粒逐渐增多;与B组比较,C组(C1、C2、C3组)肝脏细胞AI上调,并随着丙泊酚剂量的增加而递增,差异有统计学意义(P<0.05),见表1。
表1 各组的Bcl-2、Bax蛋白及AI值的比较(±s)
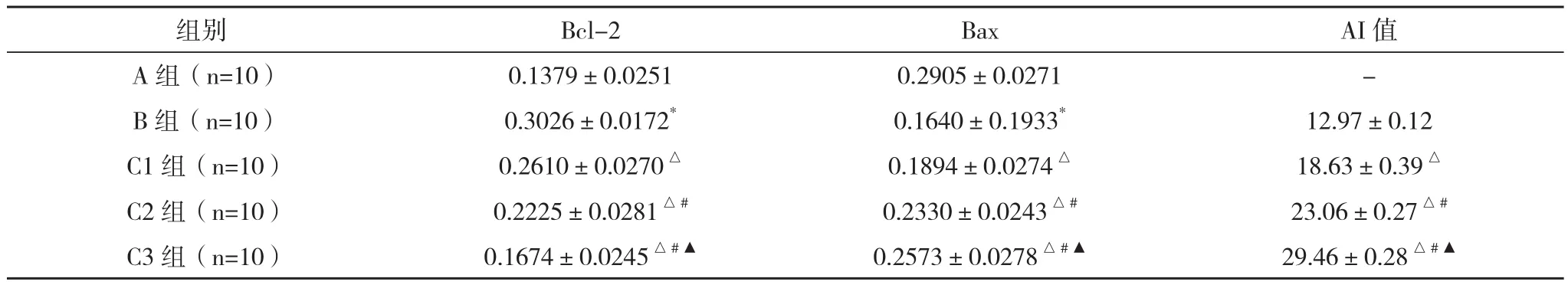
表1 各组的Bcl-2、Bax蛋白及AI值的比较(±s)
*与A组比较,P<0.05;△与B组比较,P<0.05;#与C1组比较,P<0.05;▲与C2组比较,P<0.05
组别 Bcl-2 Bax AI值A组(n=10) 0.1379±0.0251 0.2905±0.0271 -B组(n=10) 0.3026±0.0172* 0.1640±0.1933* 12.97±0.12 C1组(n=10) 0.2610±0.0270△ 0.1894±0.0274△ 18.63±0.39△C2组(n=10) 0.2225±0.0281△# 0.2330±0.0243△# 23.06±0.27△#C3组(n=10) 0.1674±0.0245△#▲ 0.2573±0.0278△#▲ 29.46±0.28△#▲
3 讨论
Bcl-2和Bax作为细胞凋亡过程中重要的调节因子,在恶性肿瘤的发生发展过程中,起着关键性的作用。国内外多项研究结果表明,在多种恶性肿瘤细胞中,均发现了Bcl-2的高表达。Bcl-2表达减少或缺失,或者Bax表达增高,均可导致对细胞的抑制作用减弱,促进细胞程序性死亡,在恶性肿瘤当中,表现为增殖减弱,预后趋好。反之,则会导致本来应停止增殖或凋亡的细胞进入细胞周期,造成恶性增生[11]。
近年来,麻醉药物对恶性肿瘤的影响成为了目前的研究方向之一,而丙泊酚因其起效快,苏醒迅速,术后恶心呕吐发生率低,对机体功能影响小等特点,在麻醉过程中广为使用,其对恶性肿瘤的影响亦成为了研究热点。
刘叶等[12]研究表明丙泊酚抑制人肝癌细胞HepG2中Bcl-2表达,同时Bax表达含量增高,认为丙泊酚可抑制人肝癌细胞的增殖,迁移和侵袭,并促进细胞凋亡。Zhang 等[13]发现,丙泊酚可通过Micro RNA-199抑制肝癌细胞中MMP-9蛋白的表达,从而降低肿瘤的侵袭能力。李培生等[14]使用明胶酶谱法对肝癌细胞中MMP-2及MMP-9活性的检测中发现,丙泊酚能抑制肝癌细胞中MMP-2的活性,且和丙泊酚的浓度呈一定的剂量依赖关系。
本实验结果发现不同剂量丙泊酚均可抑制细胞中Bcl-2蛋白并促进Bax在细胞中的表达,且呈一定的剂量依赖关系。对大鼠肝癌模型的实验中发现,丙泊酚的剂量与肝癌细胞的增殖能力密切相关。丙泊酚作为手术麻醉剂,在手术治疗过程中能抑制肿瘤的增殖能力,对肿瘤患者预后有一定积极意义。本实验中发现随着丙泊酚剂量的增加,凋亡率逐渐增大,可一定程度上抑制肝癌细胞的增殖能力。
综上所述,丙泊酚可促进大鼠肝癌细胞的凋亡,对其在临床的应用具有一定的指导意义。
[1] Anupam B,Neetika D.Resveratrol-mediated chemoprevention of diethylnitrosamine-initiated hepatocarcinogenesis: inhibition of cell proliferation and induction of apoptosis[J].Chemico Biological Interactions,2009,179(2-3):131–144.
[2]彭娅,贾振飞,程刚.丙泊酚及其制剂的研究进展[J].中国药剂学杂志,2012,10(5):17-23.
[3] Wang P,Chen J,Mu L H.Propofol inhibits invasion and enhances paclitaxel- induced apoptosis in ovarian cancer cells through the suppression of the transcription factor slug[J].European Review for Medical and Pharmacological Sciences,2013,17(5):1722-1729.
[4] Snyder J,Greenberg S.Effect of anaesthetic technique and other perioperative facters on canner recurrence[J].Br J Anaesth,2010,105(2):106-115.
[5] Santamaria L B,Schifilliti D,Torre D L,et al.Drugs of an aesthesia and cancer[J].Surg Oneol,2010,19(2):63-81.
[6] Luo T,Xia Z,Ansley D M,et al.Propofol dose-dependently reduces tumor necrosis factor-alpha-Induced human umbilical vein endothelial cell apoptosis:effects on Bci-2 and Bax expression and nitric oxide generation[J].Anesth Analg,2005,100(6):1635-1659.
[7] Mammoto T,Mukai M,Mammoto A,et al.Intravenous an aesthetic:propofol inhibits invasion of cancer cells[J].Cancer Lett,2002,184(2):165-170.
[8] Miao Y,Zhang Y,Wan H,et al.GABA receptor agonist, propofol inhibits invasion of colon carcinoma cell[J].Biomed Pharmacother,2010,64(9):583-588.
[9] Garib V,Lang K,Niggemann B,et al.Propofol induced calciumsign nalling and actin reorganization with inbreast carcinoma cells[J].Eur J Anaesthesio,2005,22(8):609-615.
[10]张灵敏,张明鑫,王宁,等.小剂量丙泊酚对食管鳞癌细胞Eca109生物学行为的影响[J].细胞与分子免疫学杂志,2011,27(4):402-404.
[11] Oltvai Z N,Milliman C L,Korsmeyer S J.Bcl-2 heterodimerized in vivo with a conserved hemology, Bax, that accelerates programmed cell death[J].Cell,1993,74(13):609-619.
[12]刘叶,阮林,刘华.丙泊酚对肝癌细胞Hep G2生物学行为的影响[J].临床麻醉学杂志,2013,29(10):491-494.
[13] Zhang J,Zhang D,Wu G Q,et al.Propofol inhibits the adhesion of hepatocellular carcinoma cells by upregulating micro RNA-199a and down regulating MMP-9 expression[J].Hepatobiliary Pancreat Dis Int,2013,12(2):305-309.
[14]李培生,黄晓光,杨惠钿.丙泊酚对肝癌细胞侵袭能力的影响分子[J].诊断与治疗杂志,2012,4(2),385-388.
The Influence of Propofol on Expressions of Bcl-2 and Bax in Wistar Rat Model with Hepatic Carcinoma
LIAN Zi-min,CAO Ding-rui,WANG Hong-yuan,et al.//Medical Innovation of China,2014,11(12):028-030
Objective:To investigate the influence of propofol with different concentrations on the expression of Bcl-2 and Bax in Wistar rat model of hepatic carcinoma.Method:50 Wistar rats were divided into 5 groups according to random number table method, each group had 10 rats, the normal group (the group A), the liver cancer model group (the group B),the low dose Propofol group: 3 mg/kg(the group C1), the moderate dose Propofol group: 6 mg/kg (the group C2), the high dose Propofol group: 12 mg/kg (the group C3). The liver tissue were collected in 24 h after the last injection and observedby morphology and hematoxylin and eosin(HE)staining. S-P immunohistochemistry was used to examine the expression of Bcl-2 and Bax in liver tissue of different groups of Wistar rats.Result:(1) Morphology and HE staining: compared with the group A, the group became B ragged and yellow spots appeared on some surfaces. Liver cells appeared steatosis, spotty necrosis and inflammatory cell infiltration by HE staining. Compared with the group B, there were less steatosis and spotty necrosis in the group C (C1, C2, C3). (2) TUNEL staining showed that increased the dosage of Propofol, apoptosis cells of liver cancer cells increased, the AI was increased gradually, the difference was statistical significance (P<0.05). (3)Compared with the group A, the expression of Bcl-2 increased, and the expression of Bax decreased in the group B, the difference was statistically significant(P<0.05). Compared with the group B, the Bcl - 2 expression decreased liver cells in the group C (C1, C2 and C3), and increased with the increase of dosage of Propofol showed a trend of decline, the difference was statistically significant (P<0.05); Bax expression was raised, and increased with the increase of Propofol dose increased trend, the difference was statistically significant (P<0.05).Conclusion:The rate of Bcl-2 /Bax is decreased by Propofol,which could inhibit the proliferation of HCC cells.
Propofol; Hepatic carcinoma; Apoptosis; Bcl-2; Bax
10.3969/j.issn.1674-4985.2014.12.010
2014-02-18) (本文编辑:蔡元元)
①山西医科大学第一医院 山西 太原 030001
曹定睿
First-author’s address:The First Hospital of Shanxi Medical University,Taiyuan 030001,China



