齐涛 王博 蒋满波 陈俊 张滨
男性阴茎勃起是在内源性或者外源性刺激诱导下通过神经内分泌的调节,作用于阴茎海绵体内皮细胞及海绵体血管平滑肌所产生一系列的血流动力学变化而导致的阴茎海绵体充血增大增粗现象。与阴茎勃起密切相关的外周勃起神经为阴茎海绵体神经(Cavernous nerve,CN),其为盆腔大神经节(Pelvic major ganglion,MPG)发出混合性神经纤维束,与伴行的血管组成神经血管束(Neurovascular bundle,NVB)。CN经阴茎脚支配阴茎海绵体前,与盆腔内的直肠、膀胱及前列腺紧贴。盆腔手术及外伤极易损伤CN,特别在男性盆腔恶性肿瘤手术根治、放疗、冷冻消融过程中,为了确保癌患清除彻底,CN损伤难以避免。为进一步研究CN损伤导致ED,则需建立一种稳定长久、简单易行、省时节约CN损伤性ED动物模型。
1 材料与方法
1.1 实验动物与分组 30只8周龄、体质量250~300 g、经性交试验明确有正常勃起功能的Sprague-Dawley(SD)雄性成年大鼠(由中山大学实验动物中心提供),随机不等分为两组,假手术组(正常对照组,NC组)5只,海绵体神经损伤组(实验组,CN组25只)。CN组中大鼠分别于术后1、2、4、8及12周时间点按照随机原则选取5只SD大鼠进行CN电刺激下测压并颈椎脱臼处死获取阴茎海绵体组织;NC组大鼠于术后12周再次手术进行CN电刺激下测压后获取阴茎海绵体组织,所有获取阴茎海绵体组织经石蜡包埋、切片、根据不同染色后观察组织结构变化。饲养环境为:屏蔽系统、温度25 ℃、湿度50%、周期12 h光照/12 h黑暗、自由获得食物及饮水、通风保持为0.1 m/s。
1.2 监测ICP/MAP 阴茎海绵体内压(Intra-cavernous pressure,ICP)测定:采用预先充满250 IU/mL肝素钠生理盐水溶液带导管22G输液针经阴茎根部穿刺进入阴茎海绵体内,导管再与压力换能器相连。平均动脉压(Mean artery pressure,MAP)测定:对同一大鼠行颈部正中切口,仔细分离出左侧颈总动脉,向心脏方向插入预先充满250 IU/mL肝素钠生理盐水溶液带PE50导管,导管连接压力换能器。使用泰盟BL-420F生物机能实验系统同时连续监测ICP、MAP变化。
1.3 手术操作 使用3%戊巴比妥钠(Sodium Pentobarbital)按照40 mg/kg剂量经腹腔注射麻醉,注射后1 min通过观察到呼吸平稳、夹尾反射消失而证实麻醉成功。刮净正中下腹部体毛,术野用碘伏溶液消毒两遍,自耻骨联合上缘向上正中切开腹壁约3 cm,逐层切开打开腹腔。分辨出精囊、膀胱、前列腺、输精管及直肠等,在10倍外科手术显微镜下充分暴露前列腺的后外侧并找到MPG及CN(图1)。自MPG向前列腺尖仔细分离CN后电刺激CN产生阴茎勃起(双极微电极电刺激参数:连续方波刺激、波宽5 ms、频率20 Hz、电压5 V,刺激持续60 s/次),证实CN解剖正确[1]。电刺激CN过程中观察阴茎勃起状态同时监测ICP/MAP。CN组给药每侧海绵体神经间隔1 cm双重钳夹,第1处位于距CN的MPG起始处0.5 cm,第2处位于第1处远端约2.0 cm处,用标准小弯血管钳夹住CN并闭合至最后咬齿,持续钳夹CN 30 s,再把双极微电极置于CN损伤中段,给予设定参数的电刺激,无阴茎勃起反应,证实CN损伤成功;对照组大鼠行下腹正中切口切开后仅仅暴露CN,不作其他处理,均以5-0 vicryl线连续缝合关闭切口,涂抹红霉素软膏预防术后切口感染。所有手术在中山大学实验动物中心SPF级动物手术室中进行,术后均送回中山大学实验动物中心SPF级环境行标准方法饲养,见图1。
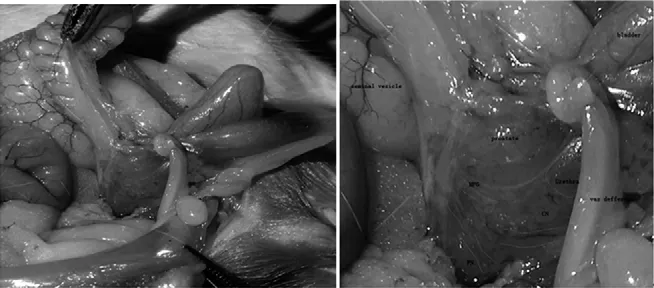
图1 海绵体神经CN与盆腔大神经节MPG放大图
1.4 APO试验 阿扑吗啡(Apomorphine,APO)是一种直接兴奋中枢神经系统的阴茎勃起诱导剂[2]。在正常勃起功能SD大鼠皮下注射剂量为150 μg/kg的APO,均可诱发SD大鼠的阴茎勃起,皮下注射后约5 min起效,约30 min作用消失。根据SD大鼠注射APO其阴茎是否勃起可以评估活体生理状态下CN损伤性ED的大鼠模型建模是否成功。所有大鼠均于处死前1 d行APO试验,具体过程:于大鼠颈部皮下按照150 μg/kg的剂量注射APO,置于自制透明盒内观察30 min,并用摄像机自下而上记录阴茎勃起情况。APO皮下注射后,大鼠均有躯体伸直、毛发竖起、活动增加、打呵欠等表现,有阴茎勃起时大鼠表现为蹲踞位,并舔舐阴茎体末端露出的阴茎头,同时臀部出现节律地抖动。以阴茎体末端外露算一次勃起,计算阴茎勃起次数并进行比较。
1.5 组织结构观察 大鼠行各项功能学检测后立即脱颈椎处死并切取阴茎中段组织,预冷PBS漂洗后,放入40 g/L多聚甲醛溶液固定,常规石蜡包埋后制作4 μm切片,用于HE染色。每张切片随机连续选取不重叠的5个高倍视野(×400),观察海绵体结构。
1.6 统计学处理 使用SPSS 17.0软件进行分析,计量资料采用(±s)表示,比较采用t检验及单因素方差分析(one-way ANOVA)进行统计处理,以P<0.05为差异有统计学意义。
2 结果
2.1 两组一般情况比较 30只大鼠中,CN组中1只手术后麻醉复苏失败死亡,余24只及NC组5只生长良好,未见切口感染。
2.2 两组APO试验结果比较 CN组术后第1、2、4、8及12周大鼠颈部皮下注射APO后观察30 min内阴茎勃起率和平均勃起次数均为0,NC组为100%(5/5)和(3.40±1.14)次。显示CN组术后12周内CN损伤未恢复、CN损伤性ED模型稳定持久。CN组与NC组间阴茎勃起率、阴茎勃起次数比较差异均有统计学意义(P<0.05)。
2.3 两组ICP/MAP测定结果比较 NC组术前、术后第12周ICP/MAP分别为(0.63±0.08)、(0.60±0.09),术前、术后比较差异无统计学意义(P>0.05)。CN组术前,术后第1、2、4、8及12周电刺激时ICP/MAP分别为(0.64±0.09)、(0.20±0.03)、(0.21±0.04)、(0.25±0.05)、(0.23±0.04)、(0.24±0.06),CN组术后两两比较差异均无统计学意义(P>0.05),CN组术前与术后比较ICP/MAP差异均有统计学意义(P<0.05)。
2.4 海绵体组织结构观察结果 NC组海绵体组织纤维化手术前后无明显改变。与术前相比CN组大鼠海绵体组织纤维化在术后第1周开始增加,第4~8周最明显,第12周时有所减轻。
3 讨论
前列腺癌是最常见的男性泌尿生殖系肿瘤,在美国男性新发癌症中列于第1位,男性癌症中死亡率位于第2位[3]。上个世纪局限性前列腺癌的常用治疗方法是前列腺癌根治术(RP),但术后常伴有ED,极大影响患者及其配偶的生活质量[4]。Walsh等[5]最先开展保留神经的前列腺癌根治术,但患者术后总体勃起功能恢复率仍不理想,ED最终发生率仍约为40%。尤其是对临床T2b期以上、PSA>20 ng/mL、Gleason评分≥7分的前列腺癌患者而言,保留神经会增加切缘肿瘤残留的几率,因而不得不切断单侧或双侧CN最终不可避免导致术后ED的出现[6-8]。
因勃起的神经传导通路损害导致勃起功能障碍,称为神经性ED。海绵体神经(CN)又称为勃起神经,是调控勃起的最重要的周围神经,因此也成为制作神经性ED的首选神经[9-12]。在人体上直接进行CN损伤性ED的探索性研究存在伦理、重复性等多方面因素的限制,许多治疗必须先在ED动物模型反复研究后才能运用于临床。手术、骨盆骨折合并尿道外伤、前列腺癌根治术等都极易损伤CN导致ED,因此可通过切断、冷冻或挤压损伤海绵体神经制作CN损伤性ED模型[11]。
1989年Quinlan等[13]采用大鼠建立了阴茎海绵体神经损伤模型,研究中发现大鼠的CN与人类的盆腔神经血管束具有相似的结构,且价格便宜,容易饲养,成为建立CN损伤模型的首选实验动物。El-Sakka等[14]用干冰冷冻单侧海绵体神经的方法制作神经性ED模型,发现1个月冷冻所造成的海绵体神经损伤的显着病理生理改变在第3个月时有所恢复,并且伴随着NOS的相应变化。Zhang等[15]在国内首次建立海绵体神经离断后ED大鼠模型,他们对大鼠海绵体神经进行解剖,在10倍外科显微镜下仔细找出并游离海绵体神经,使用电刺激诱发阴茎勃起证实其解剖学走行后,进行双侧海绵体神经离断术,术后第3周行APO均无勃起反应。孙磊等[16]也使用这种方法成功建立了神经性ED大鼠模型,并用ICP评估模型是否成功建立。王飞翔等[17]用血管钳双侧钳夹海绵体神经1 min制作海绵体神经损伤模型,造模1个月后,用电刺激试验证实,海绵体未见明显肿胀、充血,提示勃起功能丧失。本研究将采用双侧海绵体神经CN钳夹损伤法制作海绵体神经损伤性ED大鼠模型可以完全满足研究需要。相对于切断CN的方法,钳夹法也能导致神经性ED发生,同时不破坏CN固有结构的破坏,可以方便观察干预治疗CN损伤效果[18]。Yamashita等[19]通过比较双侧CN横断与CN游离ED大鼠模型,认为游离钳夹损伤更加类似盆腔手术后ED。另有研究表明在阴茎脚处CN(自主神经)、阴茎背神经(感觉神经)和阴部神经(躯体神经)有丰富的交通支[20]。为了避免单一钳夹CN后因交通支而导致损伤过早恢复,本研究采用CN序贯间隔双重钳夹法增强了CN损伤性ED模型稳定性,为CN损伤后ED的研究提供更加适合的动物模型。
[1] Martinez-Pineiro L,Brock G,Trigo-Rocha F,et al.Rat model for the study of penile erection:pharmacologic and electrical-stimulation parameters[J].Eur Urol,1994,25(1):62-70.
[2]王宝庆.盐酸阿扑吗啡联合金水宝胶囊治疗勃起功能障碍的临床研究[J].中国医学创新,2009,6(23):85-86.
[3] Gandaglia G,Karakiewicz P I,Briganti A,et al.Impact of the site of metastases on survival in patients with metastatic prostate cancer[J].Eur Urol,2015,68(2):325-334.
[4] Tewari A K.Perisphincteric cavernous nerve meshwork and its importance in radical prostatectomy[J].J Urol,2014,193(3):68.
[5] Walsh P C,Donker P J.Impotence following radical prostatectomy:insight into etiology and prevention[J].J Urol,1982,128(3):492-497.
[6] Porpiglia F,Ragni F,Terrone C,et al.Is laparoscopic unilateral sural nerve grafting during radical prostatectomy effective in retaining sexual potency[J].BJU Int,2005,95(9):1267-1271.
[7]苏同义.内分泌治疗在老年前列腺癌患者中的应用研究[J].中国医学创新,2012,9(30):99-100.
[8]贾东升,杨全成,王彤,等.前列腺癌内分泌治疗副作用的初步探讨[J].中国医学创新,2010,7(32):188-189.
[9] Hannan J L,Albersen M,Stopak B L,et al.Temporal changes in neurotrophic factors and neurite outgrowth in the major pelvic ganglion following cavernous nerve injury[J].J Neurosci Res,2015,93(6):23-25.
[10] Burnett A L,Sezen S F,Hoke A,et al.GGF2 is neuroprotective in a rat model of cavernous nerve injury-induced erectile dysfunction[J].J Sex Med,2015,12(4):897-905.
[11] Cho M C,Park K,Kim S W,et al.Restoration of erectile function by suppression of corporeal apoptosis,fibrosis and corporeal venoocclusive dysfunction with rho-kinase inhibitors in a rat model of cavernous nerve injury[J].J Urol,2014,193(5):1716-1723.
[12] Bae J H,Shrestha K R,Park Y H,et al.Comparison between subcutaneous injection of basic fibroblast growth factor-hydrogel and intracavernous injection of adipose-derived stem cells in a rat model of cavernous nerve injury[J].Urology,2014,84(5):1241-1248.
[13] Quinlan D M,Nelson R J,Partin A W,et al.The rat as a model for the study of penile erection[J].J Urol,1989,141(3):656-661.
[14] El-Sakka A I,Hassan M U,Selph C,et al.Effect of cavernous nerve freezing on protein and gene expression of nitric oxide synthase in the rat penis and pelvic ganglia[J].J Urol,1998,160(6 Pt 1):2245-2252.
[15] Zhang X H,Hu L Q,Yin J,et al.Rat model of erectile dysfunction caused by cavernous nerve ablation[J].Chin Med J (Engl),2002,115(8):1179-1182.
[16]孙磊,戴玉田,黄兴,等.海绵体神经损伤后勃起功能障碍的大鼠模型[J].医学研究生学报,2004,17(4):325-327.
[17]王飞翔,张玲莉,朱广友.大鼠海绵体神经的解剖及神经性ED模型的建立[J]. 法医学杂志,2006,22(3):183-185.
[18]卞军,戴宇平,孙祥宙,等.不同海绵体神经损伤方法建立前列腺癌根治术后勃起功能障碍大鼠模型的实验研究[J].南方医科大学学报,2011,31(2):230-233.
[19] Yamashita S,Kato R,Kobayashi K,et al.Nerve injury-related erectile dysfunction following nerve-sparing radical prostatectomy: a novel experimental dissection model[J].Int J Urol,2009,16(11):905-911.
[20] Yucel S,Baskin L S.Identification of communicating branches among the dorsal,perineal and cavernous nerves of the penis[J].J Urol,2003,170(1):153-158.



