梁君铭 曾宽 骆雪梅
胃癌的死亡率在全世界恶性肿瘤中居第二位,是临床最为常见的恶性肿瘤之一[1]。提高胃癌早期诊断率是降低死亡率的重要途径。多项研究表明胃癌的浸润转移是多种基因及其蛋白表达产物协同作用的结果[2]。本研究通过检测胃癌组织血管内皮生长因子(VEGF)及生长抑素受体(SSTR)的表达情况,同时以健康者作为对照,以评判其在胃癌浸润和转移过程中的作用,为临床早期防治提供参考。
1 资料与方法
1.1 一般资料 选取2010年1月-2014年12月就诊于本院的胃癌患者90例为胃癌组,其中男69例,女21例,年龄44~76岁,平均(59.24±7.19)岁,所有患者均经镜及病理检查确诊。90例胃癌患者中腺癌84例,原位癌4例,鳞癌1例,恶性间质瘤1例;分级结果:高分化18例,中分化49例,低分化23例;低分化腺癌39例,未分化癌17例。胃癌浸润深度:浸润达浆膜层者64例,未达浆膜层者26例;病理分期结果:Ⅰ期24例,Ⅱ期11例,Ⅲ期34例,Ⅳ期21例;胃周淋巴结转移情况:发生转移者61例,未发生淋巴结转移者29例。另取同期于本院体检的60例健康者作为对照组,其中男32例,女28例,年龄33~69岁,平均(58.24±6.31)岁。
1.2 主要试剂 兔抗人SSTR1、SSTR2、SSTR3多克隆抗体(美国santa cruz公司),VEGF单克隆抗体(福州迈新公司),SP-9000试剂盒及DAB试剂盒均购自北京中杉金桥公司。
1.3 实验方法
1.3.1 免疫组织化学染色 将组织蜡块制成厚约4 μm的切片,按照SP试剂盒说明书内容严格操作。使用已知阳性切片作为阳性对照,PBS代替一抗做阴性对照。
1.3.2 结果判读 (1)SSTR结果判读:光镜下进行观测,阳性表达位于细胞浆,呈黄棕色颗粒时为阳性反应,出现阳性反应的细胞即为阳性细胞。依据染色深浅与视野内阳性细胞所占比例评定阳性反应的强度。观察时每张切片上选取5个高倍视野,每个视野计数细胞100个,按照观察视野中阳性细胞所占的百分比例进行评分:百分比≤5%时为0,6%~25%之间为1,26%~50%之间为2,51%~75%之间为3,≥76%时为4。按照染色强度进行评分:0为阴性,淡黄色为1分,黄色为2分,棕黄色为3分。最后按两者乘积将标本的阳性反应分成4个等级:分别为阴性:1级(0、1、2);弱阳性:2级(3、4);中度阳性:3级(6、8);强阳性:4级(9、12)。两者相乘得分≥2分时为阳性表达,<2分时为阴性表达。(2)VEGF结果判读:VEGF阳性判定方法同SSTR,按照肿瘤细胞的染色比例进行分级,胞质染色<10%为阴性表达,≥10%为阳性表达[3]。
1.4 统计学处理 使用SPSS 20.0统计软件进行分析,VEGF和SSTR在不同组织中的表达差异比较采用 字2检验,两者的相关性分想要的采用Spearman相关性检验,检验水准α=0.05。
2 结果
2.1 胃癌组织和正常胃黏膜组织的VEGF表达 胃癌组VEGF表达阳性56例,阳性率为62.2%;对照组正常胃黏膜组中VEGF表达阳性5例,阳性率为8.3%,胃癌组VEGF表达阳性率显着高于对照组,比较差异具有统计学意义( 字2=43.328,P<0.05)。见表 1。
2.2 胃癌组织和正常胃黏膜组织的SSTR1~3表达胃癌组SSTR1表达阳性73例,阳性率为81.1%;SSTR2表达阳性67例,阳性率为74.4%;SSTR3表达阳性47例,阳性率为52.2%。对照SSTR1表达阳性47例,阳性率为78.3%;SSTR2表达阳性56例,阳性率为93.3%;SSTR3表达阳性51例,阳性率为85.5%。两组SSTR1阳性表达差异无统计学意义(P>0.05),胃癌组SSTR2、SSTR3表达阳性率低于对照组,比较差异具有统计学意义(P<0.05)。
2.3 VEGF与SSTR在胃癌组织中表达的相关性 VEGF与SSTR2~3在胃癌组织中的表达存在显着相关性(P<0.05),而与SSTR1的表达并未见显着相关(P>0.05)。见表 1。
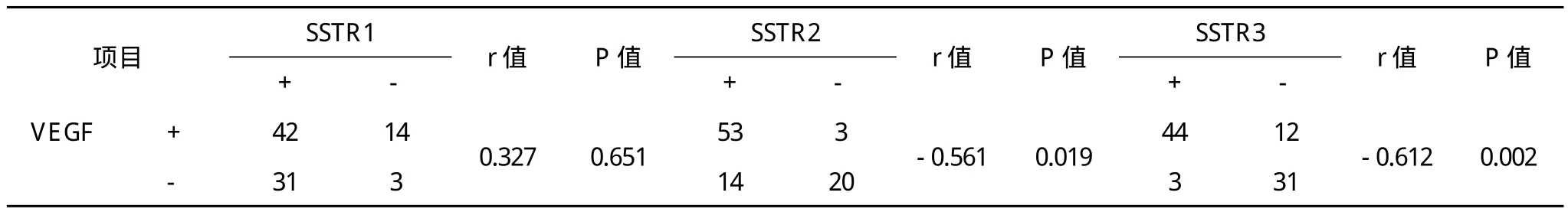
表1 VEGF与SSTR在胃癌组织中表达的交叉表 例
3 讨论
恶性肿瘤的发生与发展机制繁杂,不同肿瘤间的机制存在差异性,但其中的某些关键步骤基本相同,例如在肿瘤的转移与浸润过程中,细胞因子发挥着重要作用。胃癌的发生与发展涉及到原癌基因激活和抑癌基因失活等一系列改变,其中细胞周期调控基因的变异发挥着关键作用[4-6]。生长抑素(SS)是细胞周期调控过程的重要抑制激素,通过SSTR相关亚型的介导而发挥抑癌作用,对多种恶性肿瘤的生长具有抑制作用[7]。SSTR是一种G蛋白偶联受体,共包括SSTR1~5等5个亚型,各亚型通过不同的传导途径发挥抗肿瘤细胞增殖作用[8]。Reubi等[9]研究发现人的正常胃黏膜主要表达SSTRl。本实验中,胃癌组SSTR1表达阳性73例,阳性率为81.1%,SSTR2表达阳性67例,阳性率为74.4%,SSTR3表达阳性47例,阳性率为52.2%。对照组SSTR1、SSTR2、SSTR3的表达阳性率分别为78.3%、93.3%与85.5%。两组SSTR1阳性表达差异无统计学意义(P>0.05),胃癌组SSTR2、SSTR3表达阳性率低于对照组,比较差异具有统计学意义(P<0.05),与相关研究[10]结论一致。提示在胃癌的发生发展中伴有SSTR的丢失,SSTR表达率的降低影响了SS的抑制效应的发挥,从而在某种程度上促进了胃癌的发生与发展。
恶性肿瘤的局部生长和转移离不开血管新生,后者需要血管生成因子如VEGF、PDGF及IL-8等的生成和分泌[11-12]。VEGF是一种二聚体糖蛋白,具有特异性促进内皮细胞分裂增殖的作用,同时能以自分泌或旁分泌形式刺激肿瘤细胞发生分裂,在诸多血管生长因子中诱导肿瘤血管生成的作用最强[13-14]。研究表明VEGF过度表达通过多种途径参与了肿瘤血管的形成,在肿瘤的生长、转移及预后中具有重要作用[15]。本研究中,胃癌组VEGF表达阳性56例,阳性率为62.2%,对照组正常胃黏膜组中VEGF表达阳性5例,阳性率为8.3%,组间比较胃癌组VEGF表达阳性率高于对照组,差异具有统计学意义(P<0.05)。提示VEGF的高表达促进了肿瘤生长和血管形成,在胃癌的进展中发挥重要作用。
此外,对胃癌组织中VEGF与SSTR表达的相关性进行研究发现,VEGF与SSTR2~3在胃癌组织中的表达存在显着相关性(P<0.05),而与SSTR1的表达并未见显着相关(P>0.05)。VEGF与SSTR2~3表达存在负相关,与两者在胃癌组织中的表达阳性率结果相一致。
综上所述,VEGF在胃癌组织中高表达,而SSTR在胃癌组织中低表达,两者间显着负相关,在胃癌的发生发展调控中信号传导在上调VEGF的同时伴发SSTR的丢失。
[1] Onogawa S, Kitadai Y, Amioka T, et al. Expression vascular endothelial growth factor (VEGF)-C and VEGF-D early gastric carcinoma correlation with clinicopathological narameters[J]. Cancer Lett,2005,226(1):85-90.
[2]黄慧,廖文军,粟钰淇,等.TGF-β1、HIF-1α、VEGF在胃癌组织及癌旁组织中的表达及临床意义[J].现代生物医学进展,2014,14(18):3524-3527.
[3]罗慧英,杨林,王晓鹏,等.siRNA沉默胃癌SGC-7901细胞COX-2基因对VEGF-C表达与细胞迁移的影响[J].中国临床药理学与治疗学,2014,19(9):961-966.
[4]侯亚莉,王国荣,邱健,等.HP感染与胃癌组织中VEGF、MK蛋白表达的关系[J].现代肿瘤医学,2014,22(10):2370-2374.
[5]顾金花,顾涛,周丽娜,等.血清VEGF CEA CA19-9和SF水平变化在晚期胃癌患者化疗疗效评估中的价值[J].国际检验医学杂志,2014,35(18):2459-2461.
[6]黄美君,梁小裕,管敏昌,等.胃癌患者血清VEGF和IL-8水平变化及临床意义[J].中国卫生检验杂志,2014,24(19):2796-2798.
[7]武华,王小明,常杰.生长抑素受体亚型在胃癌中的表达及意义[J].肿瘤基础与临床,2009,32(4):297-301.
[8]宋成村,薛宏伟,赵燕伟,等.生长抑素受体亚型SSTR2、SSTR3在淋巴瘤中的表达及临床意义(英文)[J].现代生物医学进展,2012,12(22):4351-4354.
[9] Reubi J C, Waser B, Schaer J C, et al. Sanatostatin receptor sstl-5 expression in normal and neoptastic hum an tissues using reczptor autoradiography with subtype-selective ligands[J]. Eur J NuclMed,2001,28(7):836-846.
[10]杜有凤.生长抑素受体亚型SSTR1与SSTR3在胃癌组织中的表达及意义[J].山西医药杂志,2010,39(5):423-424.
[11] Sepeshazi K, Schallv A V, Nary A, et al. Preclinical evaluation of therapeutic effects of targeted cytotoxic analogs of somatostatin and bombesin on human gastric carcinomas[J]. Cancer,2003,98(7):1401-1410.
[12]邵国庆,张南征.生长抑素对裸鼠人胃癌种植瘤内VEGF和bFGF表达的影响[J].世界华人消化杂志,2014,36:5659-5664.
[13] Cahuk D, Basaran G, Celikel C, et al. Vascular endothelial growth factor, hypoxia-inducihle factor Ⅰ alpha and CD34 expressions in early-stage gastric tumors: relationship with pathological factors and prognostic impact on survival[J]. Oncoloyv,2007,72(1-2):111-117.
[14]于海英,刘畅,高凤兰,等.胃癌组织中MMP-9、CD44v6和VEGF的表达变化及意义[J].山东医药,2011,51(26):78-79.
[15]刘清涛,赵文慧,牛冰.胃癌组织中CD_(44)v6和VEGF的表达变化及意义[J].山东医药,2011,51(30):75-76.



