薛鸣,李春青,楚蕾蕾,刘佟,武莉萍
(新乡市中心医院 新乡医学院第四临床学院 a.放疗科;b.肿瘤内科,河南 新乡 453000)
肺癌是公认的全球头号癌症杀手,在全球范围内每年造成几十万人失去生命、几百万人忍受着肺癌病痛的折磨[1]。当前的肺癌治疗方法包括外科手术、化学治疗、放射治疗生物免疫治疗及靶向治疗等,但是各种治疗方式均有局限性,尽管肺癌的临床治疗效果在多年前有了显着的改善,但是肺癌患者的5 a生存率仍然较低。虽然目前的治疗方法在提高患者生存率方面做出了一定的贡献,但仍需要进一步的研究和创新,以改善肺癌的治疗效果[2]。
贝伐珠单抗(bevacizumab,Bev)是由世界着名药厂罗氏公司针对血管内皮生长因子(vascular endothelial growth factor,VEGF)的重组、人源化的用于多种肿瘤的抗癌药物,能够抑制癌组织中内皮细胞增殖及新血管生成,并可使已有的肿瘤血管退化[3]。奥希替尼(osimertinib,Osi)是近年来被临床上推荐为晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)的一线药物[4]。虽然两种药物在治疗中均有较好的效果,但是由于药物本身的局限性,当用药过久或者用药量大后会使患者出现耐药反应、高血压等副作用,但是用药量不足又发挥不了药物本身具备的效果[5]。因此针对这种“难题”,本研究针对以Bev与Osi“半单位”联合使用与两药“1单位”水平使用作为对比,研究联合用药协同抑制非小细胞肺癌A549细胞增殖及机制。
1 材料与方法
1.1 细胞
人肺癌A549细胞系,人胚肺MRC-5细胞均购自武汉普诺赛生命科技有限公司。
1.2 药品与试剂
贝伐珠单抗,货号CS00004,购自武汉科斯坦生物科技有限公司;奥希替尼,CAS 1421373-66-1,货号:wkq-09057,购自四川省维克奇生物科技有限公司;DMEM培养基、MEM(含NEAA)培养基、胎牛血清均购于上海研卉生物科技有限公司,青霉素链霉素及胰蛋白酶及磷酸盐缓冲液(phosphate-buffered saline,PBS)均由武汉华联科生物技术有限公司提供;CCK-8试剂盒,AnnexinV/PI凋亡试剂盒均由上海吉至生化科技有限公司提供;所有一抗抗体、HRP标记山羊抗兔IgG和HRP标记山羊抗鼠IgG均由武汉艾美捷科技有限公司提供;2’,7’-二氯荧光黄双乙酸盐(2’, 7’-dichlorofluorescent yellow diacetate,DCFH-DA)、BCA蛋白浓度测定试剂盒和ECL化学发光试剂均购于由北京百奥莱博科技公司。
1.3 实验方法
1.3.1细胞培养
人肺癌A549细胞使用含体积分数10%胎牛血清、100 U·mL-1青霉素及100 mg·L-1链霉素的DMEM培养液培养。人胚肺成纤维MRC-5细胞使用MEM培养基培养,两种细胞都被放置在温度为37 ℃、体积分数5% CO2、湿度为饱和的培养箱中进行生长。当细胞达到对数生长期时,本研究根据一定的比例将细胞分离出一部分,在新的培养基中继续培养。
1.3.2CCK-8检测
首先将A549及MRC-5细胞制成单细胞悬液,以每孔1×104的密度接种于96孔板中,36 h后分别加入浓度梯度为0、5、10、15、20、30 μmol·L-1的Bev、Osi,对照组加DMSO,每组设8个复孔。处理1 d后,按照试剂盒说明书将10 μL CCK-8试剂加入每个孔中,并将孔置于37 ℃下孵育2 h。随后,使用酶标仪在450 nm处测量吸光度值,得到细胞增殖抑制图,并计算出半数致死浓度(IC50值)。随后分组为空白对照组、Bev组、Osi组及联合处理组,处理方式分别为DMSO处理,IC50值Bev处理,IC50值Osi处理及1/2 IC50值Bev+1/2 IC50值Osi处理。
1.3.3流式细胞术检测各组细胞凋亡情况
将细胞浓度控制在大约80%的范围内,以确保细胞的数量处于合适的状态,后通过计数细胞数量来确定接种的细胞悬液的浓度。将细胞悬液均匀地分种至6孔板中,每孔接种1×105个A549细胞后继续培养。细胞密度达到每孔1×107后按照1.3.2的分组方式分别处理A549细胞,在收集细胞并经过PBS清洗后,根据Annexin V-FITC细胞凋亡检测试剂盒的操作说明,首先需要将细胞重悬于195 μL的Annexin V-FITC结合液中,这有助于细胞与相应的染色剂结合。随后,需要加入3 μL的Annexin V-FITC和2 μL的PI,以确保凋亡细胞能够被准确地检测出来。待混合均匀后,将混合液置于避光条件下的室温下孵育15 min,以促使染色剂与细胞发生充分的反应。补足总体积达到500 μL,随后将样品转移至流式管中,流式细胞仪分析细胞凋亡情况。
线粒体膜电位检测的前期处理同细胞凋亡,收集细胞后根据JC-1试剂盒说明书,取10 μL的DCFH-DA将细胞染色,随后将其转移至流式管中,流式细胞仪分析细胞钟活性氧变化情况。为了确保结果的准确性,实验重复了3次。
1.3.4流式细胞术检测A549细胞活性氧水平
前期处理同1.3.3。为了判断各组细胞ROS水平是否有差异,待按照分组处理24 h后,PBS洗涤1次,去除残留的上清液。加10 μmol·L-1的DCFH-DA,37 ℃恒温避光水浴孵育0.5 h,将孵育0.5 h后的细胞样品加入490 μL PBS中,将重悬后的细胞样品转移到流式管中,然后使用流式细胞仪来检测细胞内活性氧水平。
1.3.5Western Blotting法检测各种蛋白的变化情况
前期处理方法同1.3.3,在处理A549细胞培养物24 h后,将细胞收集于离心管中。然后,利用BCA蛋白浓度测定试剂盒来测定收集的细胞中的蛋白浓度。接下来,需要配制10%~15%的SDS-PAGE凝胶进行电泳分离蛋白。将分离得到的蛋白转移到硝酸纤维素膜(nitrocellulose filter membrane,NC)膜上,然后使用脱脂乳进行封闭处理,持续2 h。随后,在4 ℃的水平摇床上孵育一抗体,使其与目标蛋白发生特异性结合,并持续过夜。使用TBST缓冲液洗膜以去除未结合的一抗体。接下来,将用辣根过氧化物酶标记的二抗体孵育在室温下,以促使其与一抗体结合。随后,使用ECL发光试剂进行显色,从而产生荧光信号。最后,使用化学发光成像系统拍摄NC膜上的荧光信号。在Western Blotting过程中,内参蛋白α-tubulin被选择为标准来准确地衡量目标蛋白的信号强度。利用Image J软件,可以对所得到的蛋白条带进行灰度分析,从而量化蛋白的相对表达水平。
1.3.6统计学分析
采用SPSS 22.0软件对数据进行统计分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 Bev与Osi联合用药实现高效低毒的抗癌效果
如图1A的CCK-8结果所示,随着Bev与Osi处理水平的不断增加,A549细胞的存活率大幅下降,经计算Bev和Osi对A549细胞的半数致死水平分别为17.8 μmol·L-1及13.4 μmol·L-1。随后按照实验设计得出联合处理组水平应为8.9 μmol·L-1Bev+6.7 μmol·L-1Osi。得出各组用药水平后根据实验设计对A549及人胚肺MRC-5细胞进行了CCK-8实验,从结果1B中可以看出,联合处理组对A549细胞的增殖抑制效果要优于Bev和Osi单独处理组,同时联合处理组对MRC-5细胞的毒副作用要小于Bev和Osi单独处理组,差异有统计学意义(P<0.05)。
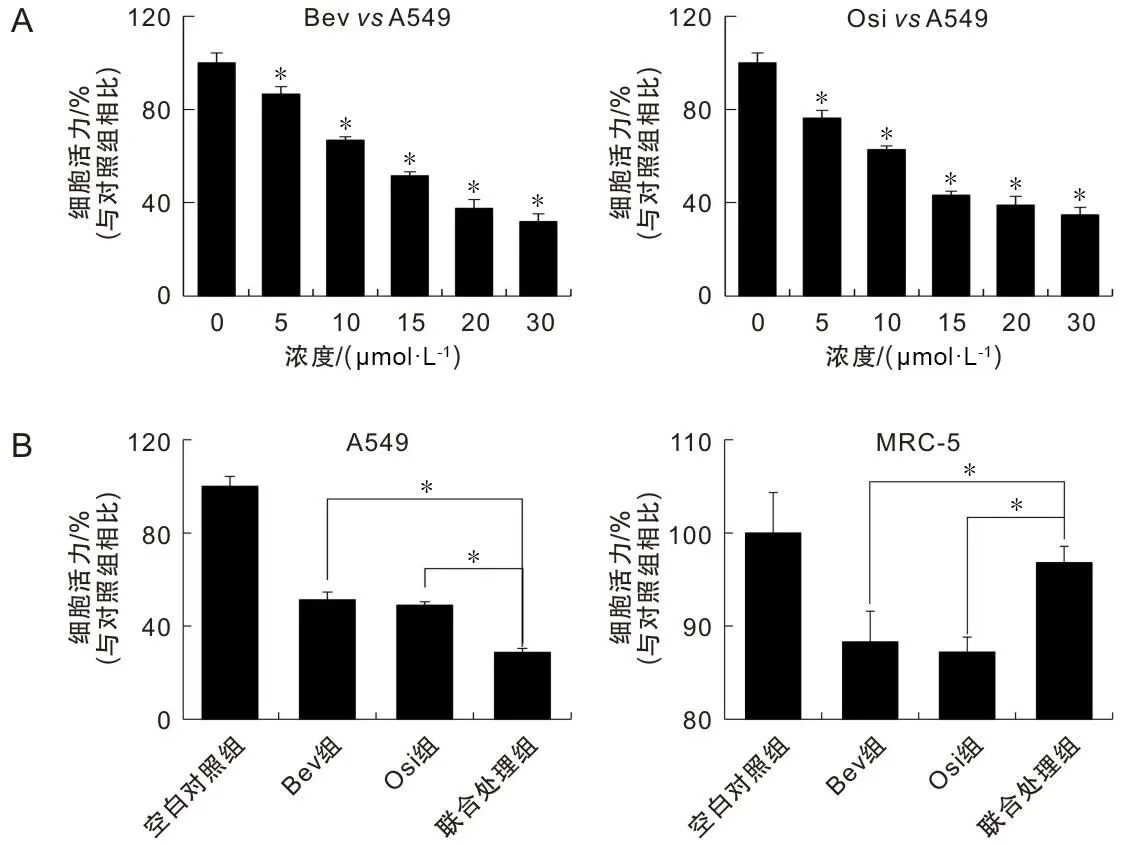
A为不同水平Bev及Osi对A549细胞的抑制增殖作用;B为各组处理对A549及MRC-5细胞的增殖抑制作用。
2.2 Bev与Osi联合用药通过线粒体依赖性途径诱导人肺癌A549细胞凋亡
分组处理A549细胞24 h后,检测细胞凋亡情况如图2A所示,Bev组、Osi组凋亡细胞比率分别为47%及45%,联合处理组的凋亡细胞比率为70.38%,差异有统计学意义(P<0.05)。同时检测了线粒体膜电位变化情况,如图2B所示,相比较于Bev组及Osi组来看,联合处理组的线粒体膜电位更为显着(P<0.05)。接下来对凋亡相关蛋白进行检测,可以看出联合处理组的Caspase-3,Cytochrome C及Bad的增幅及Bcl-2蛋白的降低幅度要大于Bev与Osi组(P<0.05)。

A为流式检测A549细胞凋亡情况;B为JC-1试剂盒检测线粒体膜电位变化情况;C为Western Blotting法检测细胞凋亡相关蛋白的表达量变化情况。
2.3 Bev与Osi联合使用上调人肺癌A549细胞中ROS水平
Bev与Osi联合使用能够诱导A549细胞发生凋亡,为了进一步探究联合使用诱导A549细胞发生大幅凋亡的机制是否与调节细胞内活性氧水平有关,分别按照实验设计分组水平处理24 h后,加入DCFH-DA荧光探针,并通过流式细胞术检测细胞内活性氧水平变化情况。从图3A中可以看出,Bev与Osi联合使用后,ROS水平上升,与两药单独处理组相比差异有统计学意义(P<0.05)。随后为了验证ROS的调节作用,加入ROS清除剂N-乙酰半胱氨酸(N-acetylcysteine,NAC)后检测细胞凋亡变化,从图3B中可以看出当加入NAC后联合处理组的凋亡细胞比率大幅下降,恢复至基本与Bev及Osi单独处理组的水平,差异无统计学意义(P>0.05)。
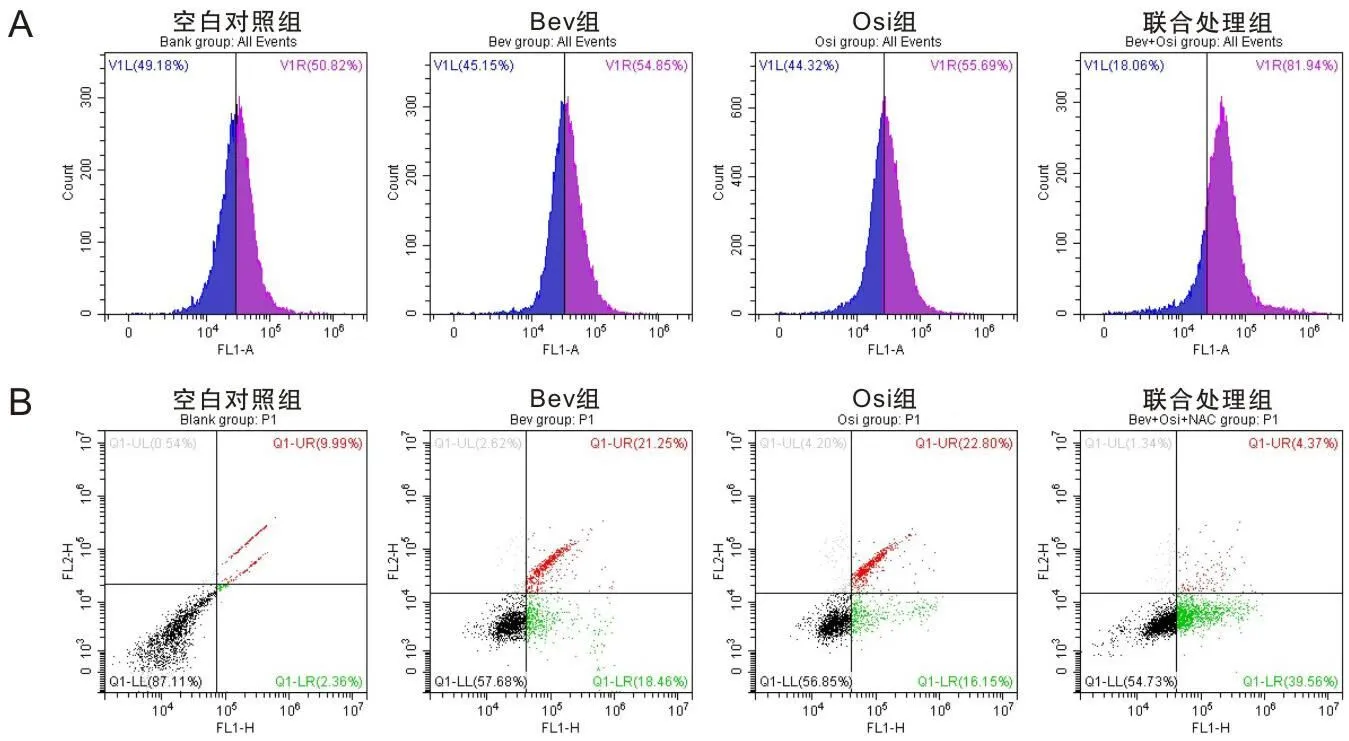
A为各组ROS水平变化情况;B为加入NAC后各组凋亡细胞变化情况。
2.4 Bev与Osi联合使用通过调控细胞中的p38/ERK信号通路来诱导大幅凋亡
针对ROS调控的p38/ERK信号通路进行了检测,从图4A中可以看出,Bev与Osi联合使用后,细胞中p-p38的表达水平上升,p-ERK的表达水平下降,与空白对照组、Bev组、Osi组相比差异有统计学意义(P<0.05)。随后,本研究进一步验证了1/2 IC50值Bev单独处理及1/2 IC50值Osi单独处理对A549细胞中p38/ERK信号通路的影响,结果如图3 B所示,低水平的Bev与Osi不会影响A549细胞中的p38/ERK信号通路。
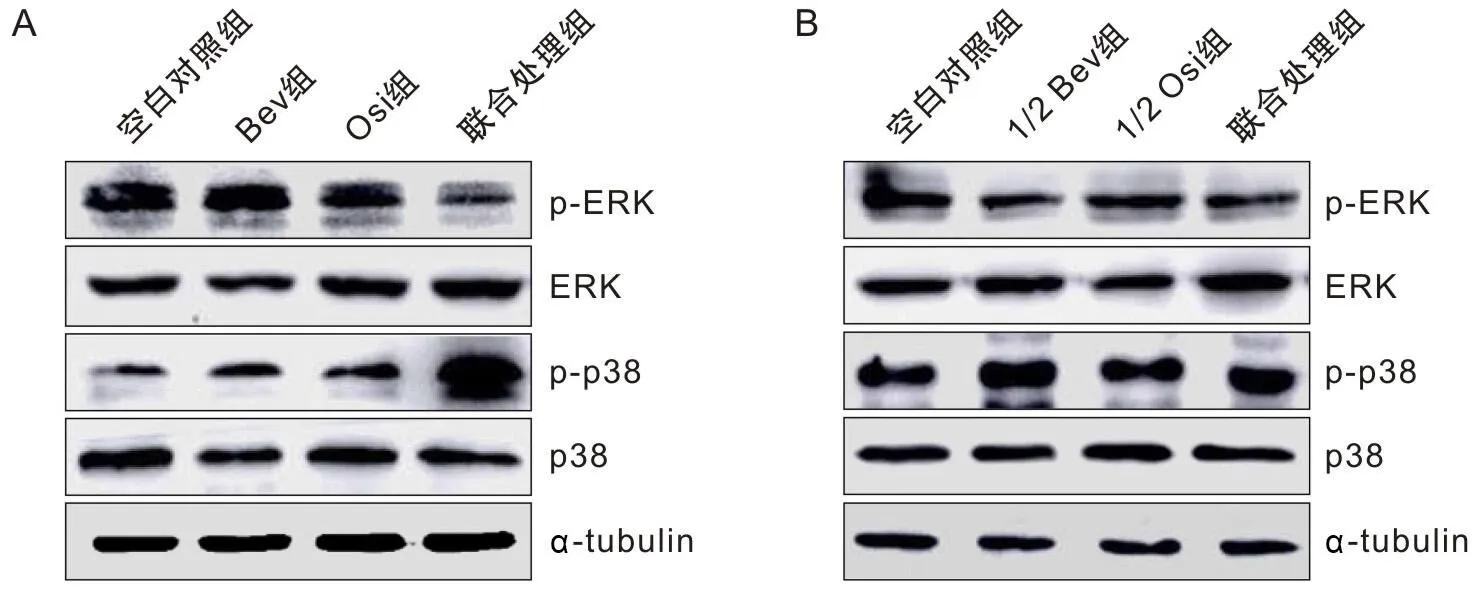
A为Western Blotting法检测各组细胞中p38/ERK信号通路相关蛋白的表达量变化情况;B为A图蛋白的定量分析;C为Western Blotting法检测低浓度Bev与Osi单独处理对A549细胞中p38/ERK通路相关蛋白的影响;D为C图蛋白的定量分析。
3 讨论
根据期刊A Cancer Journal for Clinicians(CA)公布2023年癌症数据,肺癌是全球癌症的首要死因,每天350人死于肺癌[6]。手术切除、放化疗、靶向治疗及免疫治疗是肺癌临床治疗的主流方法。Bev能够抑制肿瘤血管的生成从而阻断肿瘤营养供给,但其会带来的高血压、心脏毒性等较强的副作用[7]。Osi是属于第三代酪氨酸激酶抑制剂,它通过抑制肿瘤细胞中的EGFR激活来发挥抗肿瘤作用,同时Osi使用后存在痤疮样皮疹、鼻腔出血及耐药等副作用,也更有大批患者还没等耐药的出现,就因经济原因无奈中止治疗[8]。单药大剂量使用会出现较多的副作用和耐药性的问题,单药小剂量不能发挥药物的药效价值,因此寻找新的治疗方案已经成为当前肺癌治疗中迫在眉睫的关键[9]。联合使用不同的药物,能够在降低用药剂量的同时最大限度发挥药物的作用。因此在本研究中,首先针对Bev及Osi对A549细胞的IC50值进行核定,得出数值后将联合处理组的使用剂量调整为8.9 μmol·L-1Bev+6.7 μmol·L-1Osi,可以看出联合处理组对A549细胞的增殖抑制作用更强,同时在对正常肺部细胞的毒副作用检测中,联合处理组的毒副作用更小,初步证明联合使用较两种药物单独使用具有高效低毒的效果。
诱导癌细胞凋亡是每一种抗癌药物发挥药效的关键。线粒体依赖性凋亡是最为经典的凋亡信号途径。Cyt-c、Bax等促凋亡因子随着线粒体膜电位的降低释放出来,从而使Caspase-3蛋白被剪切,引发细胞凋亡[10]。从本实验结果中可以看出:联合处理组中凋亡细胞比率大幅增加,与Bev及Osi单药处理组相比分别增加45.7%和42.6%,在线粒体膜电位的检测中,联合处理组的膜电位较Bev及Osi单药处理组分别降低19.4%和18.3%,差异有统计学意义。随后Western Blotting实验结果表明,联合处理组的Bax及Caspase-3的表达水平升高程度及Bcl-2的表达水平下降程度均大于单药处理组,说明低浓度联合用药能够加大对A549细胞的诱导凋亡作用。
活性氧在机体中扮演着重要的角色,有研究指出,当机体中活性氧水平上升时,会抑制癌细胞的增殖和血管的生成,近几年来流行的高压氧舱治疗也直接印证了这一理论。研究证明,上调ROS水平能够通过调控多条信号通路蛋白的表达,诱导癌细胞发生凋亡,因此调控ROS水平也是诱导凋亡的重要手段[11]。在本研究中,Bev及Osi单药处理组中ROS水平无明显的变化,但是在联合处理组中ROS水平明显上升,与其他3组相比,差异有统计学意义。为了验证联合处理组引起的大幅细胞凋亡是否为通过上调ROS水平所达到的,加入了ROS清除剂NAC,随后又检测细胞凋亡情况,可以看出当联合处理组加入NAC后,凋亡细胞数量大幅下降,基本恢复到Bev及Osi单药处理组相当的水平,因此可以判断两药联合使用是通过上调ROS水平来诱导细胞发生凋亡来发挥作用的。
丝裂原活化蛋白激酶是一类蛋白激酶,主要包括ERK、JNK和p38 3个亚族,调控着细胞的生长、分化和凋亡等多项生命进程[12]。p38的磷酸化上调剪切过的Caspase-3的表达,诱导宫颈癌细胞发生凋亡。ERK的磷酸化在多种肿瘤类型的分化、凋亡和血管生成中发挥重要的作用,同时这两条信号通路能够调控着Bcl-2家族蛋白及Caspase家族蛋白进而多种癌细胞的凋亡进程。并且研究表明ROS能够直接调控p38及ERK信号通路,当ROS上升时,p-p38的表达会增加,p-ERK的表达会抑制[13]。在本研究中联合处理组中的p-p38的表达上升,p-ERK的表达被抑制,而这一变化在Bev及Osi单药处理组中是没有的。随后,本研究验证了1/2 IC50值Bev单独处理及1/2 IC50值Osi单独处理对A549细胞中p38/ERK信号通路的影响,结果显示低水平的Bev单独使用或者Osi单独使用不会影响A549细胞中的p38/ERK信号通路蛋白的变化。因此可以说明,联合用药能够调控p38/ERK信号通路蛋白进而调控下游的凋亡通路。
4 结论
小剂量Bev与Osi联合可上调细胞中ROS水平,进而调控p38/ERK信号通路蛋白的磷酸化。进而调控Bcl-2蛋白家族和Caspase蛋白家族从而引发细胞凋亡。此外,二者联合使用还能降低线粒体膜电位,激活线粒体依赖性凋亡途径,进一步促使A549细胞的凋亡。本研究初步证明了Bev与Osi联合使用具有较强的开发潜力,联合用药在肺癌治疗提供了一定的理论依据,但仍然需要更进一步的动物实验及临床试验来进行反复印证,以期更好地服务肺癌的研究。



