王 卉,杨勤军,周凡超,杨 程,童佳兵,李泽庚,,5
(1.安徽中医药大学,安徽 合肥 230038;2.安徽中医药大学第一附属医院,安徽 合肥 230031;3.安徽省中医药科学院中医呼吸病防治研究所,安徽 合肥 230031;4.新安医学教育部重点实验室,安徽 合肥 230038;5.中医药防治肺系重大疾病应用转化安徽省重点实验室,安徽 合肥 230031)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)是以慢性全身炎症、肺气肿、小气道破环等为主要病理改变的常见呼吸系统疾病。巨噬细胞是单核白细胞来源的炎症细胞,在COPD 患者气道、肺泡区和诱导痰中数量增加,与COPD 的 炎 症 反 应 和 肺 泡 壁 破 坏 有 关[1,2]。目 前 普遍认为香烟烟雾引起的氧化应激在COPD 炎症反应的发生及发展过程中起到了关键作用[3,4],其特征是炎症细胞的积累,细胞因子(如ROS、TNF-α、IL-6 和IL-1β)在肺实质中释放,诱导COPD 加重[5]。抑制细胞因子的产生或功能是控制炎症的一个关键机制。
参芪调肾方(Shenqi Tiaoshen, SQTS)是国医大师韩明向教授根据新安“固本培元”理论,在安徽省中医院院内制剂六味补气胶囊的基础上添加山茱萸、桃仁、白芥子演化而来,本课题组前期研究表明六味补气方能有效发挥免疫调节和炎症抑制作用[6,7],但参芪调肾方治疗COPD 的具体药理机制尚不明确。因此,为了进一步明确参芪调肾方的抗炎作用机制,本研究从体外实验角度研究参芪调肾方是否通过TLR4/NF-κB/NLRP3 信号通路来减弱CSE 诱导的MH-S 细胞炎症反应,为后期参芪调肾方对COPD 的中医学治疗研究提供理论学依据。
1 材料与方法
1.1 细胞
小鼠肺泡巨噬细胞MH-S(武汉普诺赛,CL-0597)。
1.2 参芪调肾方冻干粉药液制备
按相关文献报道的方法[8]。参芪调肾方(人参、炙黄芪、益智仁、玉竹、陈皮、肉桂、山萸肉、白芥子、桃仁。购于安徽中医药大学第一附属医院中药房,由韩燕全教授鉴定为正品。)加水浓煎至100 mL,混匀后分装入无菌培养皿,在-80 ℃冰箱冷冻后放入真空干燥机真空冻干36 h 得到蓬松的干燥物质,经研钵研磨成细粉,用不含血清的DMED 配置成1 mg/mL 的SQTS 冻干粉母液,将母液经0.22 μm 滤膜过滤后冻存于-20 ℃冰箱备用。
1.3 试剂
DMEM 高糖培养基(Procell,PM150210);MHS 专用培养基(Procell,CM-0597);CCK-8(上海,ES7011);IL-1β、TNF-α ELISA 试剂盒(武汉基因美 科 技 有 限 公 司 ,JYM0419RaH2DCFDA、JYM0635Ra);IL-6 ELISA 试剂盒(杭州联科生物技术股份有限公司,EK306/3-96);ROS 荧光探针(美 国MCE 公 司,HY-D0940);TLR4 抑 制 剂(TAK242,美国Selleck 公司,S745502);TLR4 抗体(biossbs,AG05125500);NF-κB 抗体(武汉Proteintech,10017763);p-NF-κB 抗 体(美 国CST 公 司,17);NLRP3 抗体(美国Abcam 公司,GR3369573-3);山羊抗小鼠IgG(Zsbio,140193)。
1.4 细胞培养
MH-S 细胞于37 ℃、5% CO2细胞培养箱中培养,以1∶3 比例传代培养。
1.5 CSE 的制备
按相关文献报道的方法[9]。将渡江牌香烟(每只烟成分:焦油10 mg,一氧化碳13 mg,尼古丁0.8 mg)点燃,使2 支香烟燃烧产生的烟雾烟雾匀速通过装有20 mL 无血清的DMEM 培养基的玻璃瓶,测定DMEM 培养基在320 nm 处的吸光度值,调节OD 值约为1.36±0.12,制成100% 香烟烟雾提取物原液,予以分装处理后置于-80 ℃环境下保存。
1.6 CCK-8 检测
1.6.1 筛选CSE 造模最佳浓度和时间 制备单细胞悬液,按每孔2×105个/mL 密度接种于96 孔板,培养过夜。弃去孔板中原培养基,加入不同浓度(1%、2%、4%、6%、8%、10%、12%)的CSE 100 μL,同时设置空白组(不含细胞)、对照组(正常细胞),继续培养24 h 后,每个待测孔加入CCK-8 试剂10 μL,孵育1 h 后,避光操作,在450 nm 波长下测定各孔吸光值。
1.6.2 筛选参芪调肾方作用最佳浓度和时间 细胞培养和种板操作同“1.6.1”,加入不同质量浓度(10、20、40、80、160、320、640 mg/L)参 芪 调 肾 方100 μL,继续培养24 h 后。CCK-8 检测操作方法及计数同“1.6.1”项。
1.7 ELISA 测定
制备单细胞悬液,以2×105/mL 密度接种于12孔板中,待细胞充分贴壁后,弃掉孔内液体,随机分为空白组(正常培养)、模型组(8% CSE 处理)、SQTS 低剂量组(40 mg/L)、SQTS 中剂量组(80 mg/L)、SQTS 高剂量组(160 mg/L)。24 h 后收集各组细胞上清液,检测各组细胞上清液中IL-1β、TNF-α、IL-6 含量。
1.8 DCFH-DA 荧光探针检测
细胞按照“1.7”项下方法分组培养24 h 后,弃培养 基,PBS 润 洗2 次,每 孔 加1 mL 稀 释 液(用DMEM 高糖培养基按1∶1 000 比例稀释DCFHDA),于培养箱内孵育30 min 后, 用PBS 洗涤3 次,于倒置荧光显微镜下设置激发波长460~500 nm,发射波长512~542 nm 进行荧光拍摄。用Image J软件进行ROS 荧光相对水平分析。
1.9 Western blot 检测
取对数期生长的MH-S 细胞分为空白组、模型组、SQTS 高 剂 量 组、TAK242 组、TAK242+CSE组、TAK242+CSE+SQTS 组。参考相关文献,取20 mg/L 浓 度 的TAK242,在 加 入SQTS 与CSE 之前预处理3 h[10]。提取各组细胞蛋白,按BCA 试剂盒说明测定蛋白浓度。电泳完成后,转膜90 min。5%脱脂牛奶封闭PVDF 膜2 h 后,一抗4 ℃孵育过夜,二抗37 ℃孵育90 min。ECL 化学发光底物检测蛋白,采用 Image J 软件分析各条带的灰度值。
1.10 统计学处理
采用SPSS 22.0 软件进行统计分析。数据以均值±标准差(±s)表示,多组间两两比较采用单因素方差分析。P<0.05 为差异具有统计学意义。
2 结果
2.1 CSE 诱导巨噬细胞炎症模型适宜条件
随着CSE 浓度的不断增加,与空白组比较细胞活力逐渐下降(P<0.05);浓度在6%~8%时,细胞活力未见明显改变(P>0.05),CSE 浓度达到10%时活力显着降低(P<0.05)且低于80%。因此,选取CSE 浓度8%为造模浓度进行后续实验。结果见图1 及表1。
表1 不同浓度 CSE 刺激对 MH-S 细胞活力的影响(n=6,±s)Tab 1 Effect of different concentrations of CSE on the viability of MH-S cells(n=6,±s)

表1 不同浓度 CSE 刺激对 MH-S 细胞活力的影响(n=6,±s)Tab 1 Effect of different concentrations of CSE on the viability of MH-S cells(n=6,±s)
注:与空白组比较, *P<0.05,**P<0.01。
存活率/%100.00±3.35 92.63±5.32*90.76±2.93**89.60±5.17**82.61±4.53**81.41±2.84**77.05±2.39**67.82±9.50**24.55浓度0%1%2%4%6%8%10%12%F

图1 不同浓度CSE 刺激对 MH-S 细胞活力的影响(n=6,±s)Fig 1 Effect of different concentrations of CSE on the viability of MH-S cells(n=6,±s)

图2 不同浓度SQTS 对 MH-S 细胞活力的影响(n=6,±s)Fig 2 Effect of different concentrations of SQTS on the viability of MH-S cells(n=6,±s)
2.2 SQTS 对MH-S 细胞活性的影响
SQTS 浓 度 在20~160 mg/L 时,与 空 白 组 比较,细胞的活力无明显差异(P>0.05);SQTS 浓度超过160 mg/L 后,与空白组比较,细胞活力明显下降(P<0.05)。 因 此,选 择40、80、160 mg/L 为SQTS 低、中、高剂量组进行后续实验。见表2。
表2 不同浓度SQTS 对 MH-S 细胞活力的影响(n=6,±s)Tab 2 Effect of different concentrations of SQTS on the viability of MH-S cells(n=6,±s)
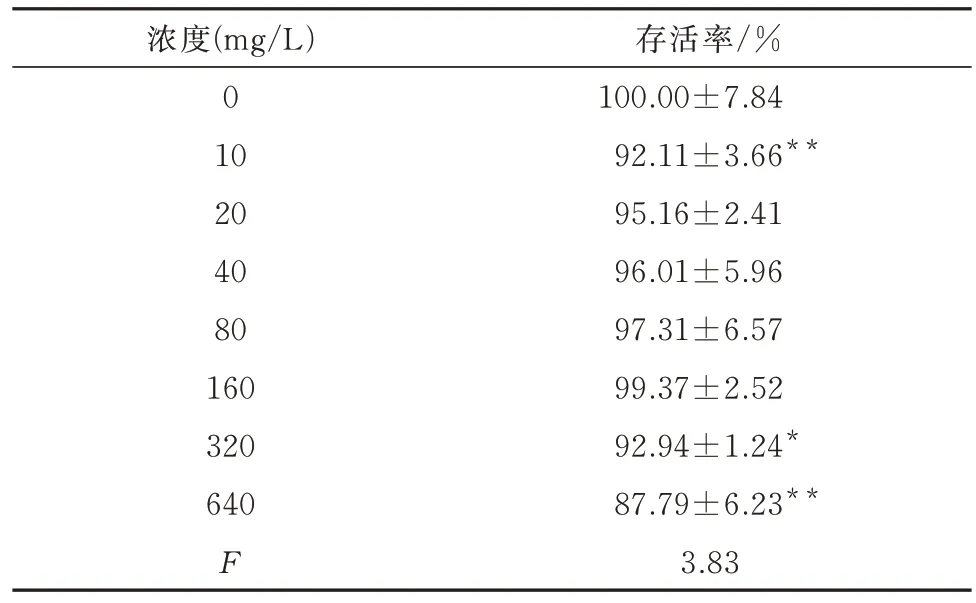
表2 不同浓度SQTS 对 MH-S 细胞活力的影响(n=6,±s)Tab 2 Effect of different concentrations of SQTS on the viability of MH-S cells(n=6,±s)
注:与空白组比较, *P<0.05,**P<0.01。
存活率/%100.00±7.84 92.11±3.66**95.16±2.41 96.01±5.96 97.31±6.57 99.37±2.52 92.94±1.24*87.79±6.23**3.83浓度(mg/L)0 10 20 40 80 160 320 640 F
2.3 ELISA 法测定各组细胞上清中IL-1β、TNF-α、IL-6 水平
与空白组比较,模型组IL-1β、TNF-α、IL-6 含量明显升高(P<0.01)。与模型组比较,SQTS 低、中、高剂量组IL-1β、TNF-α、IL-6 含量明显降低(P<0.05)。结果见图3 及表3。
表3 SQTS 对 MH-S 细胞炎症因子分泌的影响(n=3,±s,ng/L)Tab 3 Effect of SQTS on the secretion of inflammatory factors in MH-S cells (n=3,±s,ng/L)

表3 SQTS 对 MH-S 细胞炎症因子分泌的影响(n=3,±s,ng/L)Tab 3 Effect of SQTS on the secretion of inflammatory factors in MH-S cells (n=3,±s,ng/L)
注:与空白组比较, *P<0.05,**P<0.01;与模型组比较, #P<0.05,##P<0.01。
IL-6 16.90±3.55 58.39±5.73**44.89±4.55**#35.95±8.65**##26.13±3.12##25.92组别空白组模型组SQTS 低剂量组SQTS 中剂量组SQTS 高剂量组F IL-1β 10.56±2.94 44.69±10.34**32.25±6.18**#23.00±2.44*##18.03±3.03##15.51 TNF-α 11.54±1.84 58.99±2.98**51.04±6.38**39.26±8.24**##22.13±7.33##33.39

图3 SQTS 对 MH-S 细胞炎症因子分泌的影响(n=3,±s)Fig 3 Effect of SQTS on the secretion of inflammatory factors in MH-S cells(n=3,±s)
2.4 荧光探针DCFH-DA 检测荧光相对水平
与空白组比较,模型组ROS 荧光相对水平显着升高(P<0.01)。与模型组比较,SQTS 低、中、高剂量组ROS 荧光相对水平显着下降(P<0.01)。结果见图4 及表4。
表4 SQTS 对 MH-S 细胞中 ROS 荧光相对水平的影响(n=3,±s)Tab 4 Effects of SQTS on the relative fluorescence levels of ROS in MH-S cells(n=3,±s)

表4 SQTS 对 MH-S 细胞中 ROS 荧光相对水平的影响(n=3,±s)Tab 4 Effects of SQTS on the relative fluorescence levels of ROS in MH-S cells(n=3,±s)
注:与空白组比较, *P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
ROS 荧光相对水平0.70±0.12 6.70±0.30**##3.65±0.35**##3.19±0.28**##1.73±0.22**##94.63组别空白组模型组SQTS 低剂量组SQTS 中剂量组SQTS 高剂量组F

图4 SQTS 对 MH-S 细胞中 ROS 荧光相对水平的影响(DCFH-DA ×200; n=3,±s)Fig 4 Effects of SQTS on the relative fluorescence levels of ROS in MH-S cells(DCFH-DA ×200;n=3,±s)
2.5 Western blot 法检测细胞内通路TLR4、NFκB、NLRP3 蛋白表达水平
与空白组比较,模型组细胞内TLR4、p-NF-κB、NLRP3 蛋白表达增加(P<0.01)。与模型组比较,SQTS 组、TAK242+CSE 组TLR4、p-NF-κB、NLRP3 蛋 白 表 达 水 平 下 降(P<0.05),TAK242+CSE+SQTS 组 TLR4、p-NF-κB、NLRP3 蛋白表达水平下降(P<0.01)。与TAK242+CSE 组比较,SQTS 组、TAK242+CSE+SQTS 组TLR4、p-NFκB、NLRP3 蛋白表达无明显差异(P>0.05)。结果见图5 及表5。
表5 SQTS 对 MH-S 细胞 TLR4/NF-κB/NLRP3 通路蛋白相对表达量的影响(n=3,±s)Tab 5 Effect of SQTS on TLR4/NF-κB/NLRP3 protein in MH-S cells relative expressions(n=3,±s)

表5 SQTS 对 MH-S 细胞 TLR4/NF-κB/NLRP3 通路蛋白相对表达量的影响(n=3,±s)Tab 5 Effect of SQTS on TLR4/NF-κB/NLRP3 protein in MH-S cells relative expressions(n=3,±s)
注:与空白组比较, *P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别NLRP3/GAPDH浓度TLR4/GAPDH p-NF-κB/NF-κB空白组模型组SQTS 组TAK242 组TAK242+CSE 组TAK242+CSE+SQTS 组F 0.45±0.06 0.90±0.03**0.78±0.06**0.27±0.06##0.66±0.03#0.55±0.05##63.54 8%8%+160 mg/L 20 mg/L 20 mg/L+8%20 mg/L+8%+160 mg/L 0.32±0.03 0.95±0.09**0.76±0.07**#0.22±0.10##0.59±0.05#0.42±0.03##53.53 0.36±0.06 0.90±0.07**0.73±0.09*#0.21±0.01##0.63±0.03#0.53±0.05##98.61

图5 SQTS 对 MH-S 细胞 TLR4、p-NF-κB、NLRP3 蛋白相对表达量的影响Fig 5 Effect of SQTS on TLR4, p-NF-κB and NLRP3 protein in MH-S cells relative expressions
3 讨论
炎症和氧化应激是相互关联的过程,代表了COPD 的 潜 在 原 因[11]。炎 症 反 应 是COPD 的 关 键驱动和进展因素,持续存在于COPD 稳定期中,与免疫失衡、代谢紊乱等相互交织,主要特点为气道巨噬细胞、中性粒细胞、肥大细胞等免疫炎性细胞的活化,细胞内IL-1β、TNF-α、IL-6 和ROS 等因子的分泌以及相应通路的激活导致气道炎症的急性加重或持续存在,最终产生肺泡分离、肺实质改变等病理变化,形成不完全可逆和进行性的气流受限[12-14]。暴露于CSE 会由于产生高水平的ROS、TNF-α、IL-6 和IL-1β 等 细 胞 因 子 而 导 致 炎 症 反应[5,15]。ROS 是由细胞生理产生的,参与 维持细胞稳态和氧化应激,ROS 的过量积累会导致细胞成分的损伤[16],进一步加剧炎症的严重程度[17]。
在肺组织中,Toll 样 受体4(TLR4)被香烟烟雾、细菌和病毒感染等危险因素激活,进而激活NFκB 并 诱 导 炎 症 介 质 的 表 达[18],NF-κB 被 上 游 的TLR4 激活后释放TNF-α、IL-1β、IL-6 等细胞炎症因子,并活化入核[19]。NF-κB 入核后启动Nod 样受体蛋白3(NLRP3),进一步诱导IL-1β 的成熟与分泌,参 与 调 节 机 体 的 炎 症 反 应[20,21]。因 此,防 止TLR4/NF-κB/NLRP3 信号通路的活化是治疗炎症的重要靶点。
参芪调肾方是在国医大师韩明向临床经验方六味补气方的基础上加减化裁而来,具有补肺益肾,化痰祛瘀之效。研究发现,参芪调肾方的主要成分包括川陈皮素、肉桂酸、人参皂苷Rg1 等[22]。川陈皮素具有抗炎活性,可以抑制哮喘大鼠体内NLRP3 炎 性 体 活 化 来 减 少 促 炎 因 子IL-lβ、IL-6 和TNF-α 分 泌[23,24],从 而 减 轻 气 道 炎 症。肉 桂 酸 具 有清除ROS/RNS、抗病毒和抗菌等多种生物活性[25,26],通过作用于IL-1β 和TNF 等炎症因子发挥抗炎作用[27]。人参皂苷Rg1 可以减轻细胞氧化应激损伤和炎性细胞浸润,保护肺组织[28,29]。上述成分的作用与COPD 的治疗目的一致。
本研究发现正常MH-S 细胞经过CSE 刺激以后,炎症因子IL-1β、TNF-α、IL-6 的含量升高,同时,细胞中ROS 荧光相对表达水平、TLR4、p-NF-κB 和NLRP3 的蛋白表达明显升高,表明经CSE 刺激后,成功诱导了MH-S 细胞的炎症模型。而炎症细胞经过参芪调肾方作用后,细胞上清中IL-1β、TNF-α、IL-6 炎性因子的表达降低,细胞中ROS 荧光表达下降,说明经参芪调肾方作用后,细胞炎症反应得到改善。为进一步考察参芪调肾方调节炎性反应过程中与TLR4/NF-κB//NLRP3 之间的关系,本研究以TLR4 的 抑 制 剂TAK-242 进 行 干 预,TAK242 能够明显下调TLR4 下游p-NF-κB 和NLRP3 蛋白的表达,参芪调肾方亦能明显下调TLR4 下游p-NFκB 和NLRP3 蛋白的表达,与抑制剂组相比,上述蛋白表达无显着性差异,而参芪调肾方与抑制剂联用抑制上述蛋白表达作用更加明显,但与抑制剂组相比,差异无显着性意义。 结果表明SQTS 与TAK242 类似,也是通过抑制TLR4 来发挥抗炎作用。因此,推断SQTS 可能通过抑制TLR4/NFκB/NLRP3 信号通路减轻CSE 诱导的MH-S 细胞炎症。
综上所述,SQTS 可能通过抑制TLR4/NFκB//NLRP3 通 路 改 善CSE 诱 导 的MH-S 细 胞 炎 症反应,为了解参芪调肾方在COPD 中的作用和分子机制提供了新的视角。因此,参芪调肾方可能是治疗COPD 的一种新的有效药物。但需要进一步的实验来评估SQTS 在体内的作用。
作者贡献度说明:
王卉:实验操作,论文撰写与最终修订;杨勤军:提出研究思路,指导论文的撰写;周凡超:数据结果分析与校对;杨程:指导实验操作;童佳兵、李泽庚:所有实验试剂资金支持和技术指导。
所有作者声明不存在利益冲突关系。



