夏 冰,朱 辉,黄正旭,刘仲明,王 捷(.广州军区广州总医院医学实验科,广州 5000;.广州禾信分析仪器有限公司,广州 50530)
促甲状腺激素释放激素的电喷雾电离-飞行时间质谱检测*
夏 冰1,朱 辉2,黄正旭2,刘仲明1,王 捷1(1.广州军区广州总医院医学实验科,广州 510010;2.广州禾信分析仪器有限公司,广州 510530)
目的 探讨质谱技术在促甲状腺激素释放激素(TRH)检测中的应用。方法 将样品用电喷雾电离源在正离子模式下电离,然后置入飞行时间质谱仪检测。先使用利血平甲醇溶液观察仪器状况,再用稀释好的TRH溶液进样。结果 TRH产生5个明显的信号峰,分别位于m/z 249.074 8、363.138 2、385.111 9、401.000 0、763.234 5,其中m/z 249.074 8为TRH的特征性碎片峰。结论 该研究建立了电喷雾电离-飞行时间质谱技术鉴定TRH的方法,其特异性高及检测速度快,为下一步研究TRH的定量质谱检测方法奠定了基础。
促甲状腺激素释放激素; 质谱技术; 电喷雾电离
促甲状腺激素释放激素(TRH)是最早被发现的促垂体激素,其相对分子质量较小,仅为1个三肽(pGlu-His-Pro-NH2),主要产生于下丘脑[1]。近年来研究发现,TRH并不仅表达于脑内,其在肌体内广泛分布,发挥多种多样的生理功能。TRH除了调控促甲状腺激素(TSH)从垂体前叶释放,还具有抗抑郁、抗癫痫、神经修复、升血压,抗休克、降血糖、免疫调节、促进头发生长和变黑等作用[2-4]。在已有的TRH检测方法中,电化学荧光和高压液相色谱(HPLC)法的操作十分繁琐,放射免疫法灵敏度很高但特异性较低[5]。这些方法的缺点限制了在实际工作中的应用,尤其满足不了临床检验和药学研究的需要。为此,本研究尝试建立一种利用质谱仪检测TRH的新方法,报道如下。
1 材料与方法
1.1 仪器与试剂 (1)仪器:电喷雾电离源(广州禾信分析仪器有限公司自主研制);大气压电离飞行时间质谱仪(广州禾信分析仪器有限公司自主研制,型号APITOF5000);0.5 mL注射器(Hamliton);兰格实验室用注射泵LSP01-1A;喷针(内径250 μm、外径1/16英寸)、喷雾毛细管(内径100 μm、外径190 μm)。(2)试剂:促甲状腺激素释放激素(Sigma-aldrich,P1319-50 mg);利血平(阿拉丁试剂上海有限公司,HPLC级];甲醇(Dikma公司,HPLC级);纯净水(广州屈臣氏食品饮料有限公司,屈臣氏)。
1.2 方法 首先使用1.7×10-7mol/L利血平甲醇溶液[溶剂为甲醇∶水=80∶20(V/V)],观察仪器状况,然后取100 μL TRH水溶液(5×10-4mol/L)与2 mL溶剂[甲醇∶水=80∶20(V/V)]混匀,获得浓度为2.5×10-5mol/L的TRH溶液,上样。第1步使用电喷雾电离源将样品电离,第2步利用质谱仪进行分析。电喷雾离子化模式:正离子模式;TOF 运行模式:V 模式;分辨率:4 000~5 000;扫描范围:m/z 80~3 000;离子源电压3.5 kV;毛细管电压(Capillary):150 V;毛细管温度:150 ℃;四极杆接口电压150 Vpp;调谐溶液:利血平 (m/z 609.273),30 pg/μL。辅气为0.5 MPa高纯氮气,进样流速为7 μL/min。质谱检测与分析软件为禾信自主研发的TDC数据采集处理软件,版本号TDC-V1.1。
2 结 果
2.1 利血平溶液(1.7×10-7mol/L)实验结果 利血平相对分子质量为608.68,质谱图上显示的数据与之相符,表明仪器状况正常,可用于后续的样品检测。见图1。
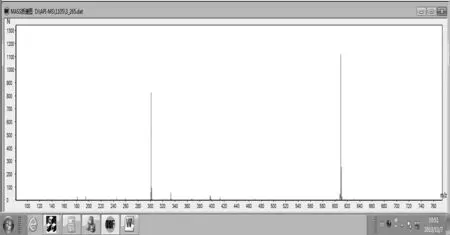
图1 利血平溶液(1.7×10-7 mol/L)实验
2.2 TRH样品的检测结果 将稀释好的TRH溶液(2.5×10-5mol/L)进样,一共产生5个明显的信号峰,分别位于m/z 249.074 8、363.138 2、385.111 9、401.000 0、763.234 5。见图2。

图2 TRH样品的检测结果
3 讨 论
1970年Guillemin小组首次报道了TRH这一参与调节垂体激素释放的物质,但后来的相关研究表明,该三肽的生理功能远不止于此,而且在某些疾病时其含量会发生变化。这些新发现要求建立一种检测TRH的特异而敏感的方法。目前已有的检测方法均存在各种缺陷,如放射免疫测定法由于仅针对免疫表位从而缺乏分子的特异性,导致定性与定量的不准确;荧光定量PCR技术则由于mRNA水平不总是反映实际的基因表达量而造成检测结果也不准确,因此有必要研发更高特异性的定性与定量手段检测TRH。
质谱技术被公认为是一种检测和分析蛋白质及小分子的重要方法。有学者研究报道,可用质谱法检测的生物活性多肽包括视紫质、C-反应蛋白、β-内啡肽等[6-8]。本研究建立了一种基于质谱的快速而敏感的TRH检测方法,本实验数据显示,m/z 249.074 8为TRH电离后产生的特异性碎片峰,相当于N端焦谷氨酸-组氨酸二肽,与Chambery等[9]用质谱方法检测的结果一致。TRH的相对分子质量为362.38,因此其分子离子峰(M+H+)理论上应在m/z 363.38。而本组实验的测定值为363.138 2,与理论值略有差异,可能是由于样品浓度过高、相应的峰过于饱和导致实验误差。m/z 385.111 9为TRH与Na+(MW=23)络合形成的峰(M+Na+),m/z 401.000 0为TRH与K+(MW=39)络合形成的峰(M+K+),m/z 763.234 5为2个TRH分子与1个K+络合形成的峰(2M+K+)。图谱中这些Na+、K+的掺入可能是由于原液在玻璃瓶中浸泡时间过长所导致。
综上所述,本研究方法用于检测TRH具有高度的特异性,而且操作简便,耗时少,从上样到取得结果仅需数分钟。下一步本组将研究TRH定量分析的质谱技术,最终达到检测生物体液和组织TRH含量的目标。
[1]夏冰,王钢,王捷.促甲状腺激素释放激素的广泛生物学作用[J].实用医学杂志,2014,30(22):105-107.
[2]Asai H,Watanabe Y,Yamauchi-Kohno R,et al.Reversal of hemorrhagic shock in rats using the metabolically stable thyrotropin-releasing hormone analog taltirelin hydrate[J].J Recept Signal Transduct Res,2011,31(6):416-422.
[3]Luo L,Luo JZ,Jackson I.Tripeptide amide L-pyroglutamyl-histidyl-L-prolineamide (L-PHP-thyrotropin-releasing hormone,TRH) promotes insulin-producing cell proliferation[J].Curr Aging Sci,2013,6(1):8-13.
[4]Gáspár E,Nguyen KT,Hardenbicker C,et al.Thyrotropin-releasing hormone selectively stimulates human hair follicle pigmentation[J].J Invest Dermatol,2011,131(12):2368-2377.
[5]Nillni EA,Vaslet C,Harris M,et al.Leptin regulates prothyrotropin-releasing hormone biosynthesis:evidence for direct and indirect pathways[J].J Biol Chem,2000,275(46):36124-36133.
[6]Barnidge DR,Goodmanson MK,Klee GG,et al.Absolute quantification of the model biomarker prostate-specific antigen in serum by LC-Ms/MS using protein cleavage and isotope dilution mass spectrometry[J].J Proteome Res,2004,3(3):644-652.
[7]Kuhn E,Wu J,Karl J,et al.Quantification of C-reactive protein in the serum of patients with rheumatoid arthritis using multiple reaction monitoring mass spectrometry and13C-labeled peptide standards[J].Proteomics,2004,4(4):1175-1186.
[8]Han SH,Kim JS,Lee Y,et al.Both targeted mass spectrometry and flow sorting analysis methods detected the decreased serum apolipoprotein E level in Alzheimer′s disease patients[J].Mol Cell Proteomics,2014,13(2):407-419.
[9]Chambery A,Severino V,Di Maro A,et al.Quantification of thyrotropin-releasing hormone by liquid chromatography-electrospray mass spectrometry[J].Amino Acids,2010,38(4):1031-1041.
Detection of thyrotropin-releasing hormone by electrospray ionization-time of flight mass spectrometry*
XIABing1,ZHUHui2,HUANGZheng-xu2,LIUZhong-ming1,WANGJie1
(1.DepartmentofMedicalResearch,GuangzhouGeneralHospitalofGuangzhouMilitaryCommand,Guangzhou,Guangdong510010,China;2.GuangzhouHexinAnalyticalInstrumentCompany,Guangzhou,Guangdong510530,China)
Objective To explore the application of mass spectrometry in the detection of thyrotropin-releasing hormone(TRH).Methods The sample was ionizated by electrospray source operating in positive-ion mode,and then was analyzed by a time of flight mass spectrometer.After we were sure that the equipment condition was fine by injecting reserpine first,we injected TRH to the system.Results TRH produced 5 peaks,which were at m/z 249.074 8、363.138 2、385.111 9、401和763.234 5 respectively,and the fragment at m/z 249.074 8 was a specific TRH product.Conclusion In this study we have established a method of detection of TRH by electrospray ionization-time of flight mass spectrometry,which has high sensitivity and high speed,so it has laid the foundation for our future study on quantification of TRH by mass spectrometry.
thyrotropin-releasing hormone; mass spectrometry; electrospray ionization
广东省科技计划项目(2013B021800052)。
夏冰,女,博士,副主任医师,主要从事基础医学研究。
10.3969/j.issn.1672-9455.2015.11.003
A
1672-9455(2015)11-1504-02
2014-12-15
2015-02-18)



