牛志立 综述,张平安 审校
(武汉大学人民医院检验科 430060)
·综 述·
棒状和环状蛋白在丙型肝炎病毒感染治疗中的研究进展
牛志立 综述,张平安 审校
(武汉大学人民医院检验科 430060)
丙型肝炎病毒;聚乙二醇干扰素-α;利巴韦林;RR抗体
丙型肝炎病毒(HCV)是单股正链RNA病毒,全球超过1.7亿感染者,仅15%的感染者能自行清除HCV,大部分发展为慢性持续性感染,部分患者可发展成为肝硬化和肝癌。临床治疗发现,标准化聚乙二醇干扰素(Peg-IFN-α)和利巴韦林联合用药,慢性丙型肝炎(简称丙肝)总体有效率不佳并且药物不良反应多。最近研究表明,HCV感染者经Peg-IFN-α和利巴韦林联合治疗后,体内可出现棒和环状(RR)自身抗体,尤其在无应答和复发的患者中比率较高。本文将从HCV、RR结构,以及HCV治疗和RR抗体之间的关系进行分析,综述如下。
1 HCV
HCV属于黄病毒科,是单股正链RNA病毒,其宿主限于人类和黑猩猩,可引起人类丙型病毒性肝炎[1]。HCV基因全长约9 600 kb,编码3 014个氨基酸多聚蛋白前体,经宿主细胞和病毒自身蛋白酶裂解成3种结构蛋白(核心蛋白、E1和E2)和7种非结构蛋白(P7、NS2、NS3、NS4A、NS4B、NS5A和NS5B)[2]。HCV进入宿主细胞主要通过病毒蛋白和细胞表面分子CD1、LDL受体、清道夫受体B1、紧密连接蛋白-1和紧密连接蛋白Occludin相互作用,并借助细胞内机制完成自我复制[3]。由于其RNA依赖性RNA聚合酶缺乏3′-5′外切酶活性,从而导致HCV-RNA的高突变率[4]。目前研究发现,HCV基因型有6型,其中基因型1、2、4、5普遍存在于非洲,而基因型3和6在亚洲较为常见[5]。
HCV持续感染可能与病毒通过破坏宿主防御功能有关[6]。从1990~2005年,全球血清HCV抗体阳性率从2.3%上升至2.8%。其中中亚和东亚,北非和中东患病率最高(>3.5%),东欧和西欧次之(1.5%~3.5%)。目前慢性丙型肝炎标准治疗方法是Peg-IFN-α和利巴韦林联合用药,但是总体有效率不佳,其中HCV 1b型慢性丙肝者仅为50%[7]。同时,Peg-IFN-α和利巴韦林联合治疗的不良反应和患者的耐受性差,以及治疗晚期患者的有效率较低的情况也不容忽视。近来研究发现,RR自身抗体与Peg-IFN-α和利巴韦林联合治疗HCV感染具有一定的关系。
2 RR结构
1987年首次提出RR并命名为Nematin,后被证实为棒状抗原。RR是一种新型的细胞质结构,既不富含波形蛋白、微管蛋白或肌动蛋白,也没有与任何已知细胞质结构相关联,并且不具有脂质双层膜的58×103大小的蛋白质[8]。RR形状主要包括棒状和环状。棒状蛋白在细胞质内的位置主要有两种,一种是沿着细胞核膜分布,另一种是散在分布在胞浆中,见图1。RR在大鼠(NRK)、大鼠(PTK2)和小鼠(3T3,RAW264.7)细胞系中较为常见,在人细胞株内还没有发现。到目前为止,RR的组成部分主要包含67×103的胞苷三磷酸合成酶(CTPS)和55×103的肌苷单磷酸脱氢酶(IMPDH),有无其他成分尚有争议[8]。
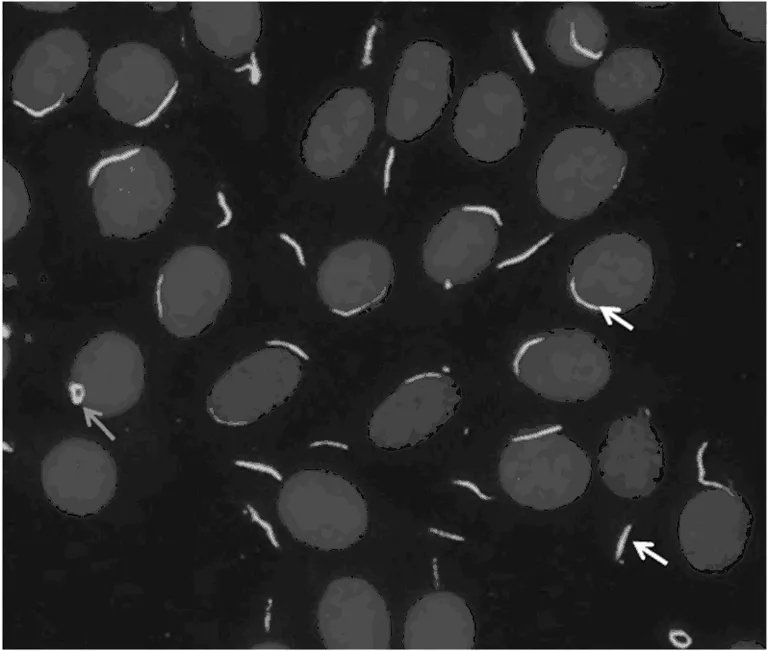
注:红色箭头指环状蛋白,白色箭头指棒状蛋白紧贴细胞核膜,黄色箭头指棒状蛋白位于胞浆。
图1 RR在细胞中的免疫荧光模型
2.1 CTPS和IMPDH 人CTPS有2个亚型,即CTPS1和CTPS2,具有74%相同的氨基酸[9]。CTPS能够催化尿苷三磷酸生成胞苷三磷酸及核酸和磷脂的生物合成。目前,CTPS主要作为抗病毒、抗肿瘤和抗寄生虫治疗的靶向分子。IMPDH有2个亚型,即IMPDH1和IMPDH2,具有84%相同的氨基酸序列[9]。IMPDH能够催化肌苷单磷酸(IMP)转化为黄苷-5′-单磷酸,是启动合成鸟嘌呤核苷酸的限速步骤。IMPDH是细胞增殖的重要调节器,是肿瘤和病毒性疾病治疗的靶向分子。
2.2 RR的其他成分 Stinton等[10]利用RR阳性的血清和蛋白质芯片技术检测RR的其他靶抗原,结果发现7种蛋白阳性,包括Myc基因相关的锌指蛋白、电压依赖性阴离子通道1、锚蛋白重复及SAM结构域蛋白6、肌动蛋白相关蛋白1及3个未知功能的蛋白质。这7种蛋白在功能上具有相似性,均参与嘌呤代谢、蛋白质折叠和聚合。虽然蛋白芯片能检测RR相关蛋白,但是无法阐明这些蛋白质在RR结构中的定位,而且蛋白中表位互补的干扰不利于免疫荧光定位研究RR的立体结构,这需要结合其他技术对RR进一步研究,如采用质谱仪对RR结构进行分析鉴定。
3 RR生物学功能
RR结构在人细胞培养中很难找到,只有在IMPDH和CTPS抑制剂或营养缺乏条件下才会形成RR,但是在非人细胞系,如大鼠NRK细胞和小鼠细胞系3T3等,即使不经过任何处理也会有RR结构。
3.1 棒与环的关系 通过记录活细胞免疫荧光时间点图像表明,RR结构开始很小,随后逐渐增大至5~10 m形成成熟尺寸[11-12]。目前尚不清楚,棒和环是否具有相同的功能,以及两种结构间是否相互转换,见图2。
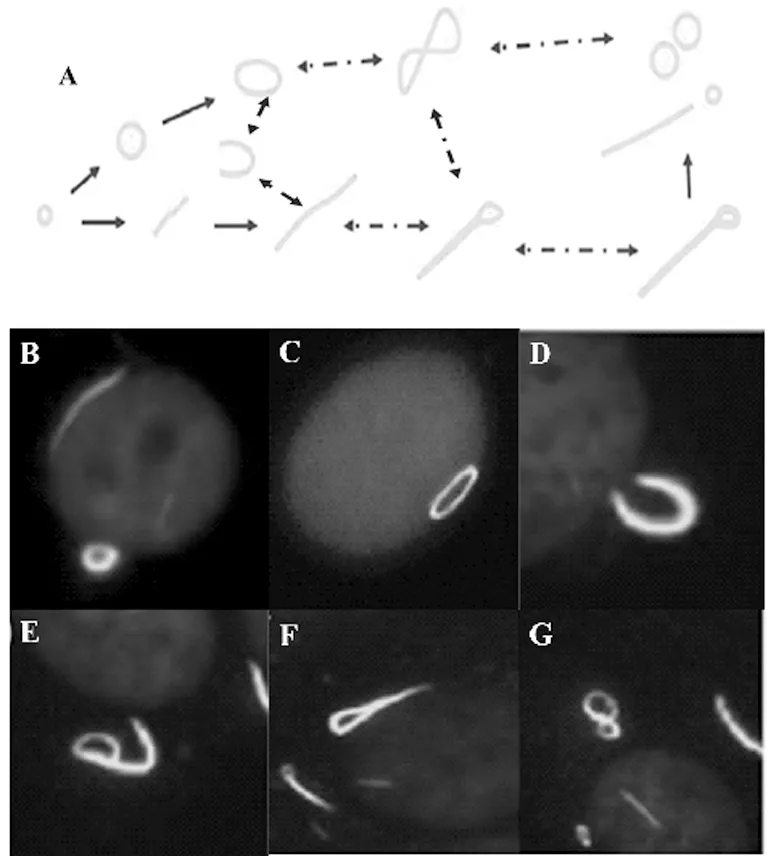
图2 棒状和环状蛋白结构
3.2 RR结构的形成 癌细胞和原代细胞使用IMPDH抑制剂如利巴韦林和霉酚酸(MPA),MPA 15~30 min,或CTPS抑制剂,如重氮氧代正亮氨酸和阿西维辛2~3 h均可诱导RR形成[8]。甚至上述细胞株在无谷氨酰胺的培养基中培养48 h也可以获得RR[11]。经过无谷氨酰胺培养的小鼠未分化胚胎干细胞几乎可以100%观察到RR结构,这与小鼠胚胎干细胞具有高度增殖性有关。由于快速增殖的细胞会消耗GTP/CTP,导致GTP/CTP数量减少而引起RR形成[8]。然而,NRK和RAW264.7细胞株较3T3、PTK2和CHO细胞株细胞增殖快,但是NRK、PTK2、3T3、CHO和RAW264.7细胞株不经过任何处理均可表现出RR[10]。这说明RR的形成可能并不只与细胞增殖速率和GTP/CTP消耗相关,还可能与宿主核苷酸代谢率和对GTP/CTP水平变化的敏感性有关。
用CTPS 和IMPDH抑制剂或无谷氨酰胺培养的mESCs和NRK、PTK2、3T3和RAW264.7细胞株形成的RR可被抗RR血清、抗IMPDH2抗体或抗CTPS1抗体检测,这表明诱导的RR和天然RR在结构上是相似的。然而,目前还不清楚它们是否具有相同的分子组成。近来研究发现,诱导生成的RR与天然形成的RR存在棒和环的比率差异,天然RR在胚胎干细胞中90%是环,而被CTPS或IMPDH抑制剂或无谷氨酰胺培养的细胞中90%是棒。同时CTPS或IMPDH抑制剂诱导形成RR后,可导致有丝分裂细胞的增殖数量下降。
3.3 棒在细胞质和细胞核的差异 CTPS或IMPDH抑制剂或无谷氨酰胺处理的细胞同样可以在细胞核中检测到RR结构,但是与细胞质中的RR结构具有一定差异。细胞核内的棒状结构比细胞质中的结构小,见图3。核棒长度1.6~4.5 m,而同一细胞的细胞质中棒长度2.5~16.8 m[9]。这表明核棒比细胞质棒短得多。虽然核棒和细胞质棒具有高度的相似结构,但是由于其亚细胞定位差异,目前尚不清楚它们是否具有相同的功能。
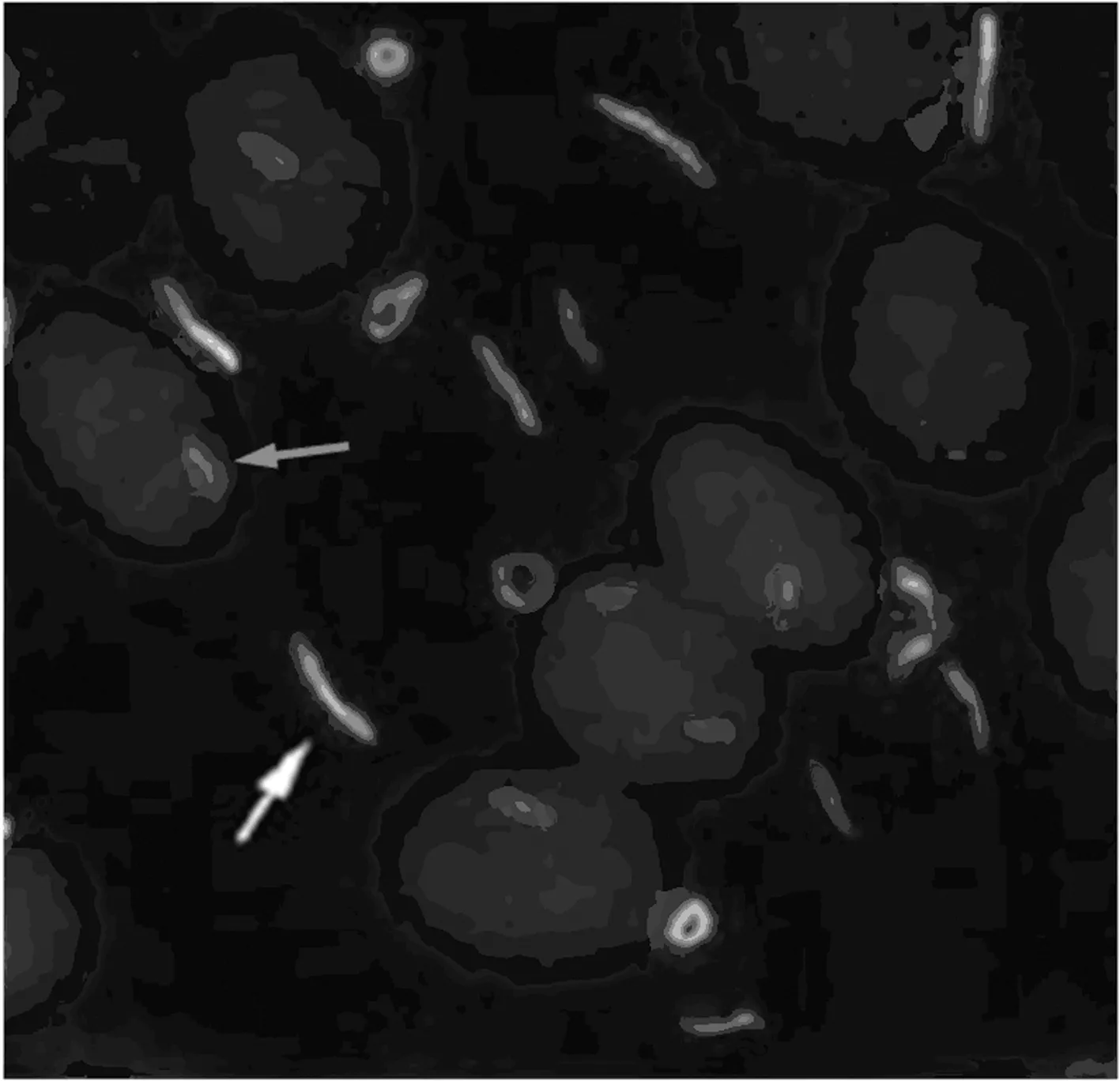
注:红色箭头指细胞核内的棒状蛋白,白色箭头指细胞质内的棒状蛋白。
图3 细胞核和细胞质内的棒状蛋白
3.4 RR结构的检测 Probst等[13]用抗RR阳性患者血清与重组IMPDH2反应,但效果不佳。原因有2点,首先,检测患者血清中的RR抗体取决于所使用的商用抗核抗体玻片。迄今为止,大多数抗核抗体HEp-2玻片不具有可识别的RR结构。另外,不是所有的抗体都能检测到RR上的构象表位,这可能是重组IMPDH2与天然IMPDH2的构象和表位数量存在差异,使许多免疫荧光抗体无法识别RR。然而,所有抗体可以通过Western印迹检测单体,而仅IMPDH2抗体通过免疫荧光能够检测到3/4的RR结构。因此,用抗体检测RR为阴性时,并不能排除RR结构的存在。
4 HCV感染与自身免疫性抗体
慢性HCV感染者抗核抗体阳性率为6%~22%,并且为低滴度(1∶40~1∶80),平滑肌抗体阳性率为10%~66%,抗肝肾微粒体抗体检出率为10%[14-15]。其他抗体也可在HCV感染者中被检出,但是目前尚不清楚是否与HCV感染有关,如抗唾液酸糖蛋白受体、抗肝细胞膜抗原、抗肝细胞质溶胶抗原、抗肝细胞质膜、抗甲状腺球蛋白、抗甲状腺过氧化物酶、抗甲状腺微粒体、抗磷脂和抗中性粒细胞胞浆等[16]。
4.1 RR抗体与HCV感染的关系 最近,RR抗体在HCV感染者中的研究备受关注。目前尚不清楚RR自身抗体的具体临床意义,但较为公认的是RR抗体的出现与干扰素和利巴韦林联合治疗丙型肝炎有关。Seelig等[17]利用放射免疫法首次证明了IMPDH2抗体在不同疾病中存在。IMPDH2抗体在携带HCV-RNA患者(35.2%,n=108)、抗肌动蛋白阳性自身免疫性肝炎患者(31.0%,n=42)、HBV-DNA阳性者(6.2%,n=113)、住院的HCV-RNA阴性患者(5.0%,n=100)、抗核抗体阳性患者(13.7%,n=51)、原发性胆汁性肝硬化并且M2型抗线粒体抗体阳性患者(3.2%,n=31)和健康人群(2.0%,n=100)中均有发现[17]。需要强调的是,放射免疫法并非检测IMPDH2抗体最准确的方法,并且有可能导致假阳性,但是可在一定程度上反映RR抗体与利巴韦林治疗的关系。
美国健康和营养协会调查无HCV肝炎史的患者4754例,其中0.8%呈RR抗体阳性[18]。Stinton等[10]却发现,健康人群和未经治疗的丙型肝炎患者体内不存在RR抗体。但是,Feng等[19]在1例HCV阴性的系统性红斑狼疮患者体内发现RR抗体阳性,这可能与狼疮患者常常处于Ⅰ型干扰素的环境中有关。这表明IMPDH特异性抑制剂单独或联合内源性干扰素可以促进RR自身抗体形成。
有研究发现,利巴韦林可以诱导组织培养细胞形成RR[12]。Keppeke等[20]并未在单独使用Peg-IFN-α或利巴韦林的患者体内发现RR抗体,但是Peg-IFN-α联合利巴韦林治疗HCV患者的RR抗体阳性率为38%,并且无应答或复发的患者比获得持续病毒学应答的患者具有较高的RR抗体。更重要的是,在联合治疗停药后,患者体内的RR抗体还可以保留6~12个月[21]。除此之外,抗RR自身抗体阳性率可能与种族无关。有研究发现,美国HCV感染人群中,无应答和复发者的RR抗体滴度高于应答者,而意大利复发者RR抗体滴度高于无应答和应答者[11]。
综上所述,RR抗体在Peg-IFN-α和利巴韦林联合治疗后无应答或者复发的HCV感染者体内较为常见。但是,目前尚有许多问题凾待解决,如RR的空间结构及RR除了CTPS1和IMPDH2组成外,是否还有其他蛋白成分;利巴韦林在体外可以诱导RR的形成却不能在体内发挥同样的效应;检查RR蛋白试剂的灵敏度有待进一步提高等。除此之外,更应关注RR蛋白的功能,尤其是棒状和环状蛋白的功能,希望其能成为HCV感染治疗过程的动态监测指标,并指导临床用药。
[1]Hajarizadeh B,Grebely J,Dore GJ.Epidemiology and natural history of HCV infection[J].Nat Rev Gastroenterol Hepatol,2013,10(9):553-562.
[2]Halliday J,Klenerman P,Barnes E.Vaccination for hepatitis C virus:closing in on an evasive target[J].Expert Rev Vaccines,2011,10(5):659-672.
[3]Zhu YZ,Qian XJ,Zhao P,et al.How hepatitis C virus invades hepatocytes:the mystery of viral entry[J].World J Gastroenterol,2014,20(13):3457-3467.
[4]Najera I.Resistance to HCV nucleoside analogue inhibitors of hepatitis C virus RNA-dependent RNA polymerase[J].Curr Opin Virol,2013,3(5):508-513.
[5]Simmonds P.Genetic diversity and evolution of hepatitis C virus-15 years on[J].J Gen Virol,2004,85(Pt 11):3173-3188.
[6]Heim MH,Thimme R.Innate and adaptive immune responses in HCV infections[J].J Hepatol,2014,61(Suppl 1):S14-25.
[7]Kim SR,El-Shamy A,Imoto S,et al.Prediction of response to pegylated interferon/ribavirin combination therapy for chronic hepatitis C genotype 1b and high viral load[J].J Gastroenterol,2012,47(10):1143-1151.
[8]Carcamo WC,Satoh M,Kasahara H,et al.Induction of cytoplasmic rods and rings structures by inhibition of the CTP and GTP synthetic pathway in mammalian cells[J].PLoS One,2011,6(12):e29690.
[9]Carcamo WC,Calise SJ,von Mühlen CA,et al.Molecular cell biology and immunobiology of mammalian rod/ring structures[J].Int Rev Cell Mol Biol,2014,308(1):35-74.
[10]Stinton LM,Myers RP,Coffin CS,et al.Clinical associations and otential novel antigenic targets of autoantibodies directed against rods and rings in chronic hepatitis C infection[J].BMC Gastroenterol,2013,19(13):50-59.
[11]Carcamo WC,Ceribelli A,Calise SJ,et al.Differential reactivity to IMPDH2 by anti-rods/rings autoantibodies and unresponsiveness to pegylated interferon-alpha/ribavirin therapy in US and Italian HCV patients[J].J Clin Immunol,2013,33(2):420-426.
[12]Thomas EC,Gunter JH,Webster JA,et al.Different characteristics and nucleotide binding properties of inosine monophosphate dehydrogenase (IMPDH) isoforms[J].PLoS One,2012,7(12):e51096.
[13]Probst C,Radzimski C,Blöcker IM,et al.Development of a recombinant cell-based indirect immunofluorescence assay (RC-IFA) for the determination of autoantibodies against “rings and rods”-associated inosine-5′-monophosphate dehydrogenase 2 in viral hepatitis C[J].Clin Chim Acta,2013,418(16):91-96.
[14]Acay A,Demir K,Asik G,et al.Assessment of the Frequency of Autoantibodies in Chronic Viral Hepatitis[J].Pak J Med Sci,2015,31(1):150-154.
[15]Ferri C,Sebastiani M,Giuggioli D,et al.Hepatitis C virus syndrome:A constellation of organ-and non-organ specific autoimmune disorders,B-cell non-Hodgkin′s lymphoma,and cancer[J].World J Hepatol,2015,7(3):327-343.
[16]Yang DH,Ho LJ,Lai JH.Useful biomarkers for assessment of hepatitis C virus infection-associated autoimmune disorders[J].World J Gastroenterol,2014,20(11):2962-2970.
[17]Seelig HP,Appelhans H,Bauer O,et al.Autoantibodies against inosine-5′-monophosphate dehydrogenase 2-characteristics and prevalence in patients with HCV-infection[J].Clin Lab,2011,57(9/10):753-765.
[18]Satoh M,Chan EK,Ho LA,et al.Prevalence and sociodemographic correlates of antinuclear antibodies in the United States[J].Arthritis Rheum,2012,64(7):2319-2327.
[19]Feng X,Huang J,Liu Y,et al.Identification of interferon-inducible genes as diagnostic biomarker for systemic lupus erythematosus[J].Clin Rheumatol,2015,34(1):71-79.
[20]Keppeke GD,Nunes E,Ferraz ML,et al.Longitudinal Study of a Human Drug-Induced Model of Autoantibody to Cytoplasmic Rods/Rings following HCV Therapy with Ribavirin and Interferon-alpha[J].PLoS One,2012,7(9):e45392.
[21]Covini G,Carcamo WC,Bredi E,et al.Cytoplasmic rods and rings autoantibodies developed during pegylated interferon and ribavirin therapy in patients with chronic hepatitis C[J].Antivir Ther,2012,17(5):805-811.
△通讯作者,E-mail:zhangpingan@aliyun.com。
10.3969/j.issn.1672-9455.2015.23.065
A
1672-9455(2015)23-3600-02
2015-04-25
2015-06-26)



