刘 芳,陈 端
(1.湖北省黄石市结核病防治院 435000;2.湖北省黄石市临床检验中心 435000)
特应性皮炎(AD)是一种常见的慢性炎性疾病,与遗传过敏体质有关,以皮肤干燥、脱屑、瘙痒为主要表现,易诊难治,反复发作,严重影响患者的生活质量。该病病因复杂,发病机制尚不清楚。目前认为AD的发生与免疫调节紊乱密切相关,其中CD4+T淋巴细胞在其发病机制中备受关注。有研究报道AD患者皮损中浸润的大量炎性细胞主要为CD4+T淋巴细胞[1]。滤泡性辅助性T(Tfh)细胞是一种新型CD4+T淋巴细胞亚群,与其他T淋巴细胞亚群功能不同,主要为促进和诱导B细胞的成熟和分化[2]。该细胞具有其独特的免疫表型,可高表达CXC趋化因子受体5(CXCR5)、诱导性共刺激分子(ICOS)、程序性死亡受体-1(PD-1)、B细胞淋巴瘤-6(Bcl-6)、白细胞介素-21(IL-21),其中ICOS、PD-1的表达对Tfh细胞的功能具有重要的作用[3]。但Tfh细胞在AD患者中的特征及意义尚不清楚。现探讨AD患者外周血Tfh细胞的表达特征,为阐明AD的发病机制提供实验室依据。
1 资料与方法
1.1一般资料 20例AD患者全部来自2015年6月至2016年7月该院门诊的就诊患者(AD组),符合Williams诊断标准,男12例,女8例,年龄12~31岁,平均年龄(20.13±5.01)岁;病程11~30年,平均病程(17.46±7.78)年。所有患者入组前1个月内未系统使用糖皮质激素及免疫抑制剂治疗,近1周内未口服抗组胺药及外用糖皮质激素,均未合并肿瘤及其他严重的系统性疾病。采用欧洲特应性皮炎评分系统(SCORAD)评估病情严重程度。进行为期1个月随访,随访期间所有患者均采用中药汤剂口服和他克莫司软膏外用治疗。健康对照者(健康对照组)为12例健康志愿者,男7例,女5例,年龄14~30岁,平均年龄(22.52±4.75)岁。2组研究对象的年龄、性别等一般资料比较,差异无统计学意义(P>0.05),具有可比性。所有研究对象均签署知情同意书。
1.2仪器与试剂 小鼠抗人CD4-Percp抗体、小鼠抗人CXCR5-FITC抗体、小鼠抗人ICOS-PE抗体、小鼠抗人PD-1-APC抗体,FACSCalibura流式细胞仪、溶血素均购自美国BD公司。
1.3方法 2组研究对象治疗前和治疗1个月后均于清晨空腹采取外周静脉血3 mL,肝素锂抗凝。取全血200 μL依次加入抗体:Percp-anti-CD4 6 μL,FITC-anti-CXCR5 4 μL,APC-anti-PD-1 5 μL,PE-anti-ICOS 5 μL,4 ℃避光孵育30 min,然后加入溶血素2 mL,震荡混匀,室温避光5 min,离心去上清液后再加入2 mL PBS洗涤1次,最后加入150 μL 4%多聚甲醛固定,4 ℃保存。标本于24 h内完成检测。
2 结 果
2.1AD组患者外周血Tfh细胞特征 AD组患者外周血Tfh细胞频率明显高于健康对照组[(10.29±1.87)%vs. (14.01±2.73)%,P<0.01)]。与健康对照组比较,AD组患者外周血Tfh细胞表面PD-1和ICOS的表达也明显升高[(0.45±0.16)%vs. (0.64±0.17)%,P<0.05;(0.33±0.08)%vs. (0.45±0.11)%,P<0.01]。见图1。
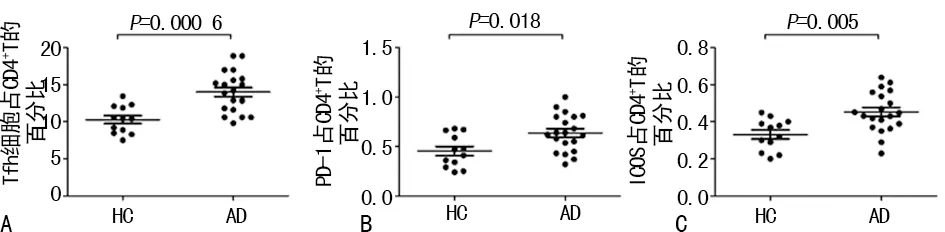
注:A表示外周血Tfh细胞频率;B表示外周血Tfh细胞表面PD-1表达;C表示Tfh细胞表面ICOS表达
图1 AD组患者外周血Tfh细胞特征
2.2AD组患者Tfh细胞与疾病严重程度的相关性 AD组患者外周血Tfh细胞频率与SCORAD评分呈明显的正相关关系(r=0.54,P=0.01);Tfh细胞表面PD-1和ICOS表达水平与SCORAD评分具有正相关趋势,但差异无统计学意义(r=0.43,P=0.06;r=0.27,P=0.25)。见图2。
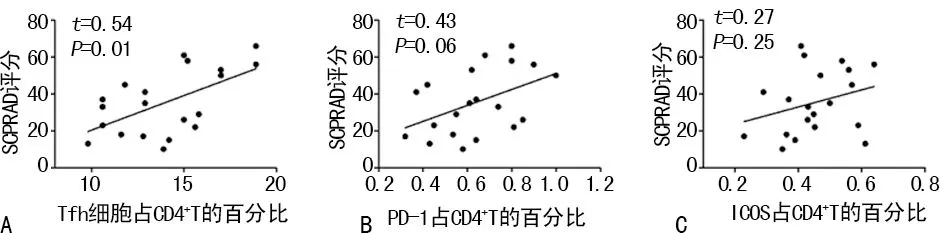
注:A表示外周血Tfh细胞频率与SCORAD评分呈正相关关系;B表示PD-1表达水平与SCORAD评分具有正相关趋势;C表示ICOS表达水平与SCORAD评分具有正相关趋势
图2 AD组患者Tfh细胞与疾病严重程度的相关性
2.3AD组患者治疗前后Tfh细胞频率及功能的变化 AD组患者采用中药汤剂口服和他克莫司软膏外用治疗,时间为1个月。治疗后皮疹及瘙痒减轻,且外周血Tfh细胞频率较治疗前明显降低[(14.01±2.73)%vs. (11.61±2.98)%,P<0.05]。与治疗前比较,AD患者外周血Tfh细胞PD-1和ICOS表达也明显降低[(0.63±0.17)%vs. (0.51±0.21)%,P<0.05;(0.45±0.11)%vs. (0.38±0.15)%,P<0.05]。见图3。
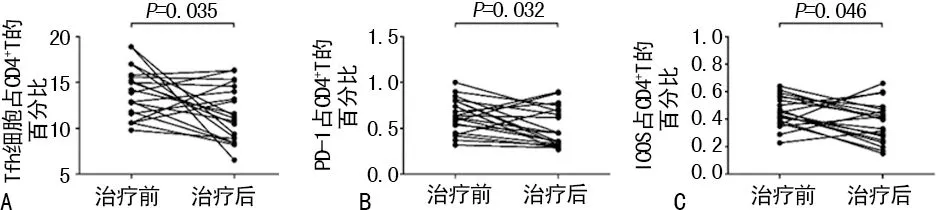
注:A表示外周血Tfh细胞频率较治疗前降低;B表示外周血Tfh细胞PD-1表达降低;C表示外周血Tfh细胞ICOS表达降低
图3 AD组患者治疗前后Tfh细胞频率及功能的变化
3 讨 论
AD是一种常见的慢性瘙痒性皮肤病,在发展中国家约为10%~20%儿童患有AD,是最常见的皮肤病。AD发病机制复杂,目前认为该病是由环境和基因等多种因素相互作用,导致机体免疫功能紊乱和皮肤屏障受损而引起的变态反应性皮肤病。既往研究表明,AD患者皮损中Th2细胞及其相关细胞因子均明显升高,因此认为AD主要是由Th2细胞介导的炎性疾病[4]。随着新型CD4+T细胞亚群的不断出现及对AD免疫发病机制研究的不断深入,近期研究报道Th17、Th22、调节性T细胞等细胞亚群在AD的发病机制中均具有重要作用[5-7]。Tfh细胞是一种新型CD4+T细胞亚群,起重要的免疫作用,参与多种免疫相关性疾病的发生、发展。
Tfh细胞最初发现于淋巴生发中心,主要功能为促进生发中心的成熟、诱导B细胞分化及促进抗体的产生[2]。近年来研究发现,外周血同样存在Tfh细胞,其与存在于生发中心的Tfh细胞具有相似的免疫表型及功能[8]。目前常用CXCR5+ CD4+T细胞定义外周血Tfh细胞。许多研究显示,多种免疫相关性疾病中存在Tfh细胞含量的改变和功能的紊乱,如Henoch-Schnlein紫癜、类风湿关节炎、强直性脊柱炎等[9-11]。本研究结果表明,AD组患者外周血Tfh细胞频率较健康对照组显着升高,提示Tfh细胞在AD的发病机制中起一定的作用。Tfh细胞表面分子ICOS的表达对Tfh细胞产生重要作用,可调节Tfh细胞的分化和功能[12]。PD-1是Tfh细胞另一个重要的表面分子,对Tfh细胞的活化具有重要的作用[13]。本研究结果显示,AD组患者Tfh细胞表面PD-1、ICOS表达水平明显升高,说明AD患者Tfh细胞不仅含量升高功能也处于活化状态。本研究结果显示,Tfh细胞频率与SCORAD评分呈明显的正相关关系,而Tfh细胞表面PD-1和ICOS表达水平与SCORAD评分具有正相关趋势,但差异无统计学意义(P>0.05),可能与患者标本数较少有关,因此需大样本量进一步验证Tfh细胞表面PD-1和ICOS的表达水平与SCORAD评分的相关性。治疗1个月后,AD患者皮疹好转,瘙痒减轻,外周血Tfh细胞频率降低,且功能性分子PD-1、ICOS表达水平也显着降低,说明Tfh细胞可能与疾病严重程度密切相关。
综上所述,AD患者Tfh细胞不仅频率升高且功能处于活化状态,治疗后疾病减轻,外周血Tfh细胞频率也降低,功能性分子PD-1、ICOS的表达水平也降低。本研究结果提示Tfh细胞在AD发病机制中可能具有重要作用,为阐明AD发病机制提供新的思路,为治疗AD提供新型的生物靶点。
参考文献
[1]WEIDINGER S,NOVAK N.Atopic dermatitis[J].Lancet,2016,387(23):1109-1122.
[2]QI H,CHEN X,CHU C,et al.Tfh cell differentiation and their function in promoting B-cell responses[J].Adv Exp Med Biol,2014,841(21):153-180.
[3]SUH W K.Life of T follicular helper cells[J].Mol Cells,2015,38(3):195-201.
[4]WERFEL T,ALLAM J P,BIEDERMANN T,et al.Cellular and molecular immunologic mechanisms in patients with atopic dermatitis[J].J Allergy Clin Immunol,2016,138(2):336-349.
[5]NODA S,SUAREZ-FARINAS M,UNGAR B,et al.The Asian atopic dermatitis phenotype combines features of atopic dermatitis and psoriasis with increased TH17 polarization[J].J Allergy Clin Immunol,2015,136(5):1254-1264.
[6]FURUE M,CHIBA T,TSUJI G,et al.Atopic dermatitis:immune deviation,barrier dysfunction,IgE autoreactivity and new therapies[J].Allergol Int,2017,87(12):234-238.
[7]LEE N,SHIN J U,JIN S,et al.Upregulation of CD47 in regulatory T cells in atopic dermatitis[J].Yonsei Med J,2016,57(6):1435-1445.
[8]MORITA R,SCHMITT N,BENYRNIBEL S E,et al.Human blood CXCR5(+)CD4(+) T cells are counterparts of T follicular cells and contain specific subsets that differentially support antibody secretion[J].Immunity,2011,34(1):108-121.
[9]ZHANG Z,ZHAO S,ZHANG L,et al.A higher frequency of CD4(+)CXCR5(+) T follicular helper cells in patients with newly diagnosed Henoch-Schonlein purpura nephritis[J].Int Immunopharmacol,2016,32(10):8-15.
[10]WANG J,SHAN Y,JIANG Z,et al.High frequencies of activated B cells and T follicular helper cells are correlated with disease activity in patients with new-onset rheumatoid arthritis[J].Clin Exp Immunol,2013,174(2):212-220.
[11]WU S,YANG T,PAN F,et al.Increased frequency of circulating follicular helper T cells in patients with ankylosing spondylitis[J].Mod Rheumatol,2015,25(1):110-115.
[12]WEBER J P,FUHRMANN F,FEIST R K,et al.ICOS maintains the T follicular helper cell phenotype by down-regulating Kruppel-like factor 2[J].J Exp Med,2015,212(2):217-233.
[13]CUBAS R A,MUDD J C,SAVOYE A L,et al.Inadequate T follicular cell help impairs B cell immunity during HIV infection[J].Nat Med,2013,19(4):494-499.



