李建英,毛玉环,刘珊玲
湖南省长沙市第一医院检验科,湖南长沙 410005
BCR-ABL融合基因由9号染色体长臂(9q34)上的原癌基因埃布尔森小鼠白血病病毒癌基因同源物1(ABL1)和22号染色体长臂(22q11)上的断裂点集簇区(BCR)基因易位而成,具有异常的酪氨酸激酶活性。BCR-ABL融合基因作为慢性粒细胞白血病(CML)的分子基础,既是CML诊断和监测疗效的生物学标志物,也是酪氨酸激酶抑制剂(TKI)治疗CML的靶点。因此,监测CML患者的BCR-ABL融合基因水平已成为评估疗效、早期识别耐药、监测疾病进展,从而指导治疗的重要手段[1-2]。CML患者在接受TKI及造血干细胞移植(HSCT)治疗后低BCR-ABL融合基因水平是普遍且长期存在的,因此BCR-ABL融合基因已成为TKI治疗过程中及HSCT治疗后疗效评估不可或缺的指标[3]。然而,目前用于检测BCR-ABL融合基因的实时荧光定量PCR(RT-qPCR)技术操作步骤较多,所采用的试剂、仪器及人员操作水平等均可能对检测结果造成影响。为了提高BCR-ABL融合基因检测水平,研制出标准化BCR-ABL融合基因质控物是当前的首要任务。装甲RNA(Armored RNA)技术可形成内含BCR-ABL融合基因不同类型特定RNA的病毒样颗粒(VLPs),可使BCR-ABL融合基因免受环境中核糖核酸酶(RNase)和脱氧核糖核酸酶(DNase)的降解,且无生物传染性,既能大量人工合成,又有长期稳定性,是制备BCR-ABL融合基因质控物的合适材料[4-5]。本研究旨在建立基于Armored RNA的BCR-ABL融合基因质控物,用于评价BCR-ABL融合基因检测试剂盒的性能,以促进BCR-ABL融合基因检测的标准化。
1 材料与方法
1.1材料 p210型BCR-ABL融合基因阳性骨髓标本。
1.2仪器与试剂 PCR产物纯化试剂盒、质粒抽提试剂盒、TA克隆试剂盒、琼脂糖凝胶DNA回收试剂盒均购自美国Promega公司;p210型BCR-ABL融合基因RT-qPCR试剂盒(以下称市场在售试剂盒)购自上海源奇生物有限公司; Top10 E.Coli 用于重组克隆的构建和扩增,购自天根生化科技有限公司;BL21(DE3) E.Coli 用于BCR-ABL融合基因特定RNA的MS2噬菌体VLPs的原核表达,购自天根生化科技有限公司。pACYCDuet-1购自德国Novagen公司;pACYC-MS2 由MS2噬菌体成熟酶蛋白基因和衣壳蛋白基因克隆于pACYCDuet-1而成,由中华人民共和国国家卫生健康委员会临床检验中心免疫室提供。
1.3方法
1.3.1Armored RNA质控物制备 收集p210型BCR-ABL融合基因阳性骨髓标本cDNA,采用PCR扩增p210 型BCR-ABL融合基因片段和ABL内参基因片段,纯化后的PCR产物分别插入pACYC-MS2载体,经Top10 E.Coli 转化、筛选、鉴定、扩增,提取pACYC-MS2-p210和pACYC-MS2-ABL阳性重组载体质粒后转导BL21(DE3) E.Coli,大量诱导表达形成pACYC-MS2-p210 VLPs和pACYC-MS2-ABL VLPs后分离、富集、纯化和鉴定。将纯化的VLPs标本原液用基本必需培养基进行倍比稀释,然后取1∶104和1∶105稀释的VLPs用RT-qPCR先进行预定量。
1.3.2质控物性能检测
1.3.2.1耐RNase试验 随机抽取分装好的pACYC-MS2-p210 VLPs和pACYC-MS2-ABL VLPs标本各10份作为p210 Armored RNA组和ABL Armored RNA组,另取2份p210型BCR-ABL融合基因裸露RNA标本作为裸露RNA组,在p210 Armored RNA组和ABL Armored RNA组的各5份标本与裸露RNA组的1份标本中分别加入RNase(1 μg/mL)后于37 ℃放置60 min;3组剩余标本不做处理。然后同时提取RNA进行RT-qPCR检测。
1.3.2.2均一性检测 随机抽取分装好的pACYC-MS2-p210 VLPs和pACYC-MS2-ABL VLPs标本各10份,提取RNA进行RT-qPCR检测,每份标本检测3次,获得平均Ct值。
1.3.2.3稳定性检测 随机抽取5份标本后分别置于下列环境:(1)-20 ℃环境中,检测7个月,每个月检测1次;(2)4 ℃环境中,检测3个月,每半个月检测1次;(3)室温(20~25 ℃)环境中,检测15 d,3 d检测1次;(4)37 ℃环境中,检测7 d,1 d检测1次。
1.3.3RT-qPCR判断质控物适用性 取两种VLPs水平约为106copy/mL的标本,依次稀释至105、104和103copy/mL,采用市场在售试剂盒对不同水平标本进行检测,以不同水平为横坐标、Ct值为纵坐标绘制两种VLPs的标准曲线,计算R2,判断线性,以验证该质控物能否评价BCR-ABL融合基因检测试剂盒的性能。
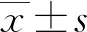
2 结 果
2.1PCR扩增目的片段结果 经PCR扩增后得到p210型BCR-ABL融合基因片段和ABL内参基因片段,长度分别为1 399 bp和1 633 bp,扩增结果见图1。
2.2pACYC-MS2-p210和 pACYC-MS2-ABL载体的验证 将目的片段克隆入pACYC-MS2载体,形成pACYC-MS2-p210和pACYC-MS2-ABL重组载体,转化后随机挑取克隆,提取质粒,做PCR验证,结果见图2。
2.3pACYC-MS2-p210 VLPs和pACYC-MS2-ABL VLPs的表达、纯化和鉴定
2.3.1分子筛纯化VLPs 分别将构建好的2个单质粒双表达载体转入表达宿主细胞BL21(DE3) E.Coli,经诱导、表达、超声碎菌离心后得到的上清液用RNase、DNase 消化过夜,经分子筛色谱纯化。

注:M为DL 2000 DNA marker;1为p210型BCR-ABL融合基因扩增产物;2为ABL内参基因扩增产物。

注:A中M为DL 2000 DNA marker,1、3、4、5为pACYC-MS2-p210重组载体质粒的PCR产物,2为阴性克隆;B中M为DL 2000 DNA marker,1~4、6、7为pACYC-MS2-ABL重组载体质粒的PCR产物,5为阴性克隆。
2.3.2反转录-PCR(RT-PCR)鉴定VLPs 提取pACYC-MS2-p210 VLPs和pACYC-MS2-ABL VLPs里的RNA,反转录合成cDNA,再进行RT-PCR鉴定。VLPs包装的RNA经RT-PCR扩增后产物长度依次为1 399 bp和1 633 bp,见图3。
2.4耐RNase试验 耐RNase试验结果显示,p210 Armored RNA组和ABL Armored RNA组经RNase处理的Ct值与未经RNase处理的Ct值差异无统计学意义(P>0.05);裸露RNA组经RNase处理后均无扩增曲线、无Ct值,裸露RNA在RNase作用下完全降解。见表1。
2.5均一性与稳定性检测 均一性检测pACYC-MS2-p210 VLPs和pACYC-MS2-ABL VLPs标本的变异系数(CV)分别为3.45%和3.64%,均<5.00%,表明标本中目的片段拷贝数水平是均一的。稳定性检测显示,两种VLPs标本在-20 ℃可至少稳定保存7个月,4 ℃稳定保存3个月,室温稳定保存15 d,37 ℃稳定保存1周(CV<5.00%),稳定性变化趋势见图4。

注:M为DL 2000 DNA marker;1为pACYC-MS2-p210 VLPs中RNA的RT-PCR产物;2为pACYC-MS2-ABL VLPs中RNA的RT-PCR产物。

表1 Armored RNA和裸露RNA经RNase处理与未经RNase处理的Ct值比较

注:A为-20 ℃下的稳定性;B为4 ℃下的稳定性;C为室温下的稳定性;D为37 ℃下的稳定性。
2.6RT-qPCR判断质控物的适用性 不同水平pACYC-MS2-p210 VLPs和pACYC-MS2-ABL VLPs均能被市场在售试剂盒检出,其标准曲线的R2分别为0.994 0和0.991 7,具有很好的适用性。见图5。

注:A为pACYC-MS2-p210 VLPs标准曲线;B为pACYC-MS2-ABL VLPs标准曲线;两种VLPs的水平均为实际值取lg。
3 讨 论
BCR-ABL融合基因检测对造血干细胞恶性克隆性疾病的筛查和诊断具有重要意义,为促进BCR-ABL融合基因检测标准化,本研究建立了基于Armored RNA的BCR-ABL融合基因质控物。此外,考虑到临床检测该融合基因采用的是RT-qPCR,除了含有融合基因转录本以外,还含有内参基因,而且目前常见的内参基因为ABL,为尽可能模拟真实临床标本,本研究还制备了内参基因ABL质控物。
Armored RNA是由MS2噬菌体衣壳蛋白和成熟酶蛋白自行装配包裹外源RNA形成的,将MS2噬菌体基因组中成熟酶编码序列、成熟酶核糖体结合位点、衣壳蛋白编码序列、包装位点和复制酶部分起始位点的cDNA序列克隆到原核表达载体上,并在其下游处插入外源RNA的cDNA序列,经转录后即可得到带有MS2噬菌体操纵子序列的外源RNA转录产物,引起衣壳蛋白自发组装,并将外源RNA序列包装到包膜内,形成VLPs。同时包装本身还是一个翻译调节的元件,当衣壳蛋白表达水平超过组装要求时,衣壳蛋白二聚体与包装位点结合,阻止核糖体结合到复制酶的起始位点,抑制了复制酶的翻译,从而完成了翻译的调节[6]。PEABODY[7]于1990年发现MS2噬菌体衣壳蛋白能够优先包装含有19 mer茎环结构的RNA,形成VLPs,但外源RNA长度超过500 bp则包装效率明显降低。随后,其他研究人员以此为基础,尝试包装更长的外源RNA片段[8-10]。我国学者ZHAN等[11]进一步优化条件并构建带有3个或2个C-variant 包装位点的表达系统,成功地将长3 034 bp的RNA包入VLPs中。
本研究通过探讨包装位点的亲和力及位置改变对MS2噬菌体包膜蛋白包装外源RNA的影响,采用Armored RNA技术,经大量原核表达纯化,制备了包装有p210型BCR-ABL融合基因和ABL内参基因的VLPs,用于制备BCR-ABL融合基因核酸检测质控物。原核表达纯化1次即可获得大量的VLPs,相比裸露的RNA和阳性细胞系成本更低,且对实验室生物安全要求低,目前被广泛应用于核酸检测质控和标准的研究[12]。BCR-ABL融合基因Armored RNA的推广应用,将为检测工作提供统一的质控物。
均一性和稳定性是质控物应具备的基本特性。均一性检测pACYC-MS2-p210 VLPs和pACYC-MS2-ABL VLPs标本的CV分别为3.45%和3.64%,均<5.00%,表明标本中目的片段拷贝数水平是均一的;本研究稳定性结果显示,质控物在-20 ℃可至少稳定保存7个月,4 ℃稳定保存3个月,室温稳定保存15 d,37 ℃稳定保存1周(CV<5.00%)。在均一性和稳定性允许的条件下,两种不同水平的VLPs均能被市场在售试剂盒检出,pACYC-MS2-p210 VLPs和pACYC-MS2-ABL VLPs标准曲线的R2分别为0.994 0和0.991 7,说明本研究研制的质控物将有助于核酸检测工作测量程序的评价、室内质控物和室间质评标本的建立和应用,促进我国BCR-ABL融合基因检测的标准化和规范化。
研究发现,随CML病情进展,BCR-ABL融合基因转录本水平进行性增高,该基因的定量检测有助于疗效观察和预后判断[13]。陈蕾等[14]发现,BCR-ABL融合基因转录本水平持续性增高对CML病情进展可能具有预测作用。随着分子靶向治疗药物的广泛使用,BCR-ABL融合基因的突变是导致治疗效果不佳的主要原因之一,且在治疗与预后中起着重要作用。研究发现,BCR-ABL 融合基因T315I突变是目前治疗CML耐药最难以克服的基因突变[15],国外报道 BCR-ABL 融合基因T315I突变在CML患者中的发生率约为15%[16],这为制备不同变异来源的BCR-ABL融合基因质控物提供了基础。



