马军伟,王 佳,宋 炜
延安大学附属医院肿瘤科,陕西延安 716000
食管癌是常见的上消化道肿瘤之一。目前,上消化道肿瘤是我国城市人口恶性肿瘤的重要死亡原因,同时也是世界范围内相对常见、多发的恶性肿瘤之一,其病因与吸烟、职业、环境、电离辐射等有关[1-2]。近年来,虽然人类对食管癌的研究加深,但截至目前其发病机制尚未完全弄清。分泌型卷曲相关蛋白1(SFRP1)和β-连环蛋白(β-catenin)是机体中的相对常见的2种生物学因子,在各种疾病的发生、发展和转归过程中均发挥了重要作用[3]。SFRP1作为一种新发现的候选抑癌基因,在人类的多种肿瘤包括上消化道肿瘤中均存在表达下调或缺失的现象[4],而其失活的原因则可能与上消化道肿瘤的子区高甲基化被启动有关。β-catenin是CTNNB1基因编码的蛋白,可与钙黏蛋白、α-catenin共同组成黏附连接复合体。既往研究显示,β-catenin可作为信号分子介导细胞黏附和信号传导[5]。一项Meta分析显示,β-catenin在肝癌、肠癌、胃癌等疾病中起重要作用,与食管癌的不良预后、疾病进展及肿瘤侵袭性均密切相关[6]。本研究选取本院肿瘤科收治的121例食管癌患者作为研究对象,探讨SFRP1、β-catenin在该病中的作用及其相关机制,现报道如下。
1 资料与方法
1.1一般资料 选取本院肿瘤科2014年1月至2018年1月收治的121例食管癌患者作为研究对象进行前瞻性研究。纳入标准:(1)符合中国抗癌协会食管癌专业委员会《食管癌规范化诊疗指南(2013版)》[7]中食管癌诊断标准;(2)活检标本满足诊断要求;(3)知情同意并签署知情同意书;(4)临床资料完整。排除标准:(1)食管癌合并其他恶性病变;(2)病理学检查时有放化疗、生物免疫治疗史;(3)治疗期间死亡、转院、失访。121例食管癌患者中男78例,女43例;鳞癌51例,腺癌70例;肿瘤分化程度:高分化31例,中分化62例,低分化28例;癌转移53例,未转移68例。根据国际抗癌联盟(UICC)和美国癌症联合会(AJCC)联合制定的标准[8],将121例食管癌患者分成Ⅰ期28例,Ⅱ期41例,Ⅲ期37例及Ⅳ期15例。本研究经本院医学伦理委员会批准后执行。
1.2仪器与试剂 仪器:细胞质分析仪[亚德诺半导体技术(上海)有限公司];全自动免疫组化检测仪[赛默飞世尔科技(中国)有限公司]等。试剂:鼠抗人SFRP1(ELISA)试剂盒(上海江莱生物科技有限公司,规格:96T/49T);鼠抗人β-catenin单克隆抗体(北京中山生物技术有限公司,型号:CAT-5H10)等。
1.3方法
1.3.1标本采集 操作者均为本院经验丰富的检验科医生,对本课题不知情,也不了解A、B组受试者的基线资料,采用单盲法判断。采集所有受试者癌组织及癌旁组织标本,均于标本离体后0.5 h内取材,并分成2份:一份放置于-80 ℃低温冰箱保存,用于DNA提取;一份石蜡包埋,采用常规苏木精-伊红(HE)染色法染色,用于免疫组织化学法(IHC) β-catenin检测。
1.3.2检测步骤 分别采用甲基化特异性PCR(MSP)和免疫组织化学法(IHC)检测癌组织及癌旁组织SFRP1、β-catenin水平。SFRP1检测:提取癌组织及癌旁组织标本,提取DNA,采用细胞质分析仪检测。β-catenin检测:(1)癌组织及癌旁组织标本均采用中性福尔马林脱水固定;(2)常规石蜡包埋和水化,接着用枸橼酸钠缓冲液(陕西兴邦药业有限公司,国药准字H61022282)煮沸后孵育10 min,加一抗4 ℃孵育过夜;(3)加生物素标记的二抗处理后再次孵育10 min,用苏木素复染,乙醇脱水,切片,然后用二甲苯透明中性树胶(南京森贝伽生物科技有限公司,编号:SBJ0126)封片;(4)采用全自动免疫组化检测仪进行检测。
1.3.3SFRP1、β-catenin结果判定 SFRP1结果判定每张切片随机选取10个高倍镜(×40)视野,计算阳性细胞百分数。阴性:肿瘤阳性细胞数<10%;阳性:阳性表达定位于细胞质,细胞质有棕黄色颗粒,肿瘤阳性细胞数≥10%。
1.3.4β-catenin结果判定 阳性细胞百分数与SFRP1的判定结果相同。阴性:染色结果无着色或单纯细胞质着色;阳性:呈棕黄色颗粒状,主要位于细胞膜。
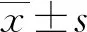
2 结 果
2.1癌组织及癌旁组织SFRP1、β-catenin表达水平比较 食管癌癌组织SFRP1表达水平较癌旁组织明显降低,β-catenin表达水平较癌旁组织明显升高,差异均有统计学意义(P<0.05)。见表1。
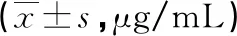
表1 癌组织及癌旁组织SFRP1、β-catenin表达水平比较
2.2不同临床病理特征食管癌患者SFRP1、β-catenin表达阳性率比较 是否淋巴结转移食管癌患者SFRP1表达阳性率差异有统计学意义(P<0.05),β-catenin表达阳性率差异无统计学意义(P>0.05);不同病理类型、分化程度、TNM分期食管癌患者SFRP1、β-catenin表达阳性率比较,差异均有统计学意义(P<0.05)。见表2。
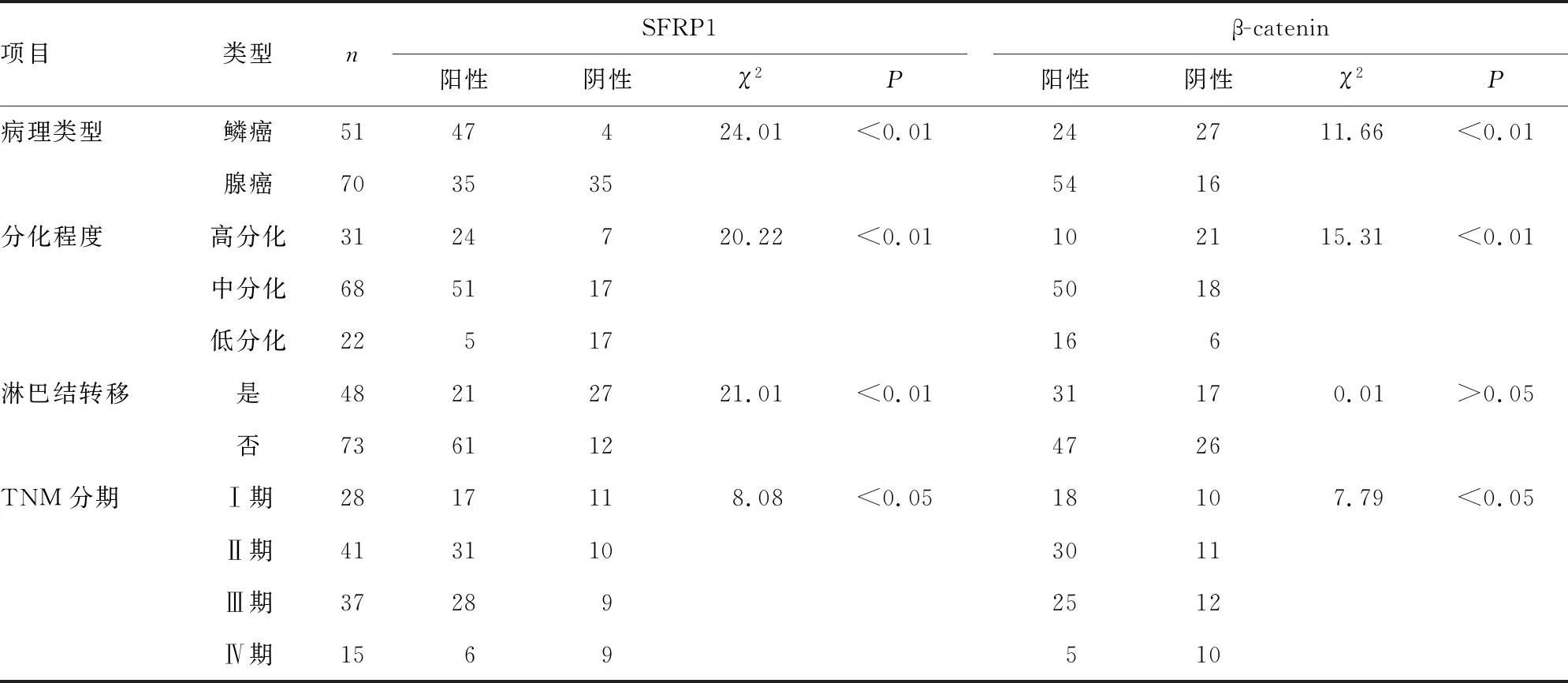
表2 SFRP1、β-catenin表达与食管癌的临床病理特征的关系(n)
3 讨 论
既往研究证实,SFRP1在胚胎发育阶段主要参与脑、血管等重要系统的细胞分化[9],但当其成体后,存在于机体的诸多组织中。作为一种重要的抑制因子,SFRP1的作用多集中在Wnt信号(配体蛋白质Wnt和膜蛋白受体结合激发)上游,有研究证实,虽然其在正常状态下对抵抗食管癌发生和发展、促进细胞凋亡等[10]生物过程均极有帮助,但若超过其临界值时,则会损伤机体组织。
本研究结果发现,食管癌患者癌组织中SFRP1的表达水平低于癌旁组织(P<0.05),而不同病理类型、分化程度、TNM分期、是否淋巴结转移食管癌患者SFRP1蛋白表达差异有统计学意义(P<0.05)。结合文献[10-12]及本研究结果,SFRP1在食管癌中的作用机制可能与以下几点有关:(1)SFRP1参与Wnt信号转导而对食管癌发生有影响。通常情况下,Wnt信号转导在成体组织细胞中的作用主要是协助细胞增殖,但若机体受损时,这条信号通路中的关键蛋白突变,导致Wnt信号活化出现异常,继而参与肿瘤发生。(2)SFRP1基因的第1个外显子周围有高密度的CpG岛,其是发生甲基化的重要区域。有研究显示,当机体中的SFRP1基因甲基化后Wnt信号通路则会被激活,继而导致本途径中的β-catenin在细胞质内累积、转移或与该途径中的某些转录因子结合[12]。而在这种情况下,靶基因的转录和表达也会随着被刺激,继而参与食管癌的发生、发展。(3)SFRP1可与Fra相互竞争而使Wnt信号通路被抑制。有研究发现,SFRP1利用部分类似氨基端序列结构与Wnt蛋白结合,进而抑制Wnt信号通路[13]。本研究中食管癌癌组织SFRP1阳性表达率明显低于癌旁组织,提示SFRP1表达降低会抑制Wnt信号转导,促进肿瘤细胞增殖。
作为一种细胞质蛋白,β-catenin主要分布于胞膜,可与E-钙黏蛋白(E-cadherin)相结合而形成的一种E-cadherin-β-catenin复合物。这种复合物在许多细胞反应中发挥重要作用,有研究证实β-catenin变异均会引起许多人类肿瘤,如结肠癌、肺癌[14-15]。正常情况下,肿瘤抑制(APC)基因对机体细胞中的β-catenin有较好的调节,促使β-catenin基因出现特殊片段磷酸化。然而,当β-catenin或APC基因突变时,细胞内的β-catenin水平随之递增,而其部分则会从胞膜上转移至胞核内聚集。本研究结果显示,β-catenin在食管癌癌组织中的表达较癌旁组织明显升高(P<0.05)。这表明β-catenin在食管癌病变组织呈高表达[16],而癌旁组织阳性率较低,严重影响食管癌患者的预后生存率。通常情况下,β-catenin主要分为两类,一类是游离型β-catenin,二类是结合型β-catenin。有研究证实,前者主要表达于食管癌细胞的细胞核中,是重要的靶基因,Wnt信号通路则是它与转录因子Tcf/Lef结合后形成的;后者的主要功能是调节细胞黏附功能,但无法进入细胞核,而这种调节功能还必须与其他细胞因子结合才可实现[17]。食管癌的发生则主要与游离型β-catenin相关,而导致这种现象的原因在于β-catenin降低了转录因子的转录活性,而使Wnt信号通路被激活,使信号转导途径异常而过度调节食管癌细胞的增殖[18]。因此,推测SFRP1与β-catenin之间还存在某种联系,但具体机制有待进一步研究。
综上所述,SFRP1低表达、β-catenin高表达可能是食管癌高发的主要诱因之一,二者主要通过相同的媒介物质Wnt信号通路导致食管癌的发生。SFRP1、β-catenin均在食管癌的发生、发展、转归及预后中发挥重要作用,可将其作为食管癌发生的早期肿瘤标志物。



